Общая характеристика
Головной мозг – это главный орган нервной системы. Его исследованием медики занимаются до сих пор. Головной мозг взрослого человека содержит 90-95 миллиардов нейронов. Тела нейронов образуют серое вещество мозга, а нервные волокна (отростки нейронов) – белое вещество.
Рис. 1. Отделы головного мозга.
Данный орган имеет следующие виды оболочек:
- мягкая или сосудистая;
- паутинная (между паутинной и мягкой оболочкой циркулирует спинномозговая жидкость – ликвор, которая служит своеобразным амортизатором и защищает от ударов, а также поддерживает трофические и обменные процессы между кровью и мозгом);
- твёрдая.
Мозг мужчин и женщин отличается по своей массе. У представителей сильного пола его вес на 100-150 г больше. Однако умственное развитие никак не зависит от этого показателя.
Функции генератора и передачи импульсов выполняют нейроны. Внутри головного мозга есть желудочки (полости), в которых образуется спинномозговая жидкость. От головного мозга в разные отделы человеческого тела отходят черепно-мозговые парные нервы. Всего в организме насчитывается 12 таких пар.
Строение
Главный орган нервной системы состоит из трёх частей:
ТОП-4 статьи
которые читают вместе с этой
Спинной мозг: строение и функции
Речь
Спинной мозг: строение и функции
Память
- два полушария переднего мозга;
- ствол;
- мозжечок.
Так же он имеет пять отделов:
- конечный или передний, составляющий 80 % массы;
- промежуточный;
- средний;
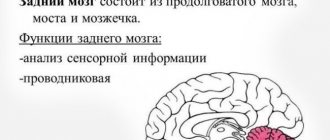
- задний, включающий в себя мост и мозжечок;
- продолговатый.
Белое вещество больших полушарий переднего мозга представлено в виде нервных волокон, которые могут быть трёх видов:
- ассоциационные – связывают корковые участки в одном полушарии;
- комиссуральные – соединяют два полушария;
- проекционные – связывают кору с нижерасположенными образованиями.
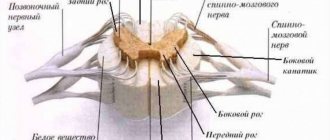
Серое вещество состоит из тел нейронов, в больших полушариях это вещество образует кору и подкорковые ядра.
Рис. 2. Доли коры больших полушарий.
Следующая таблица поможет подробнее разобраться со строением и функциями различных отделов головного мозга:
Результаты
На этапе нейрофизиологического картирования полученные результаты сравнивались с МР-картиной представительства функциональных зон, синхронизированной на навигационной станции (табл. 2).
Таблица 2. Результаты прямой электростимуляции коры в области ФЗЗ и белого вещества вблизи пирамидного тракта
При сравнении результатов картирования с данными фМРТ и трактографии у 12 (18%) пациентов выявлено более широкое представительство речевых зон, что, на наш взгляд, объясняется погрешностью выполнения тестовых заданий при фМРТ и имеющимся дооперационным неврологическим дефицитом (элементы сенсорной афазии).Всем пациентам в 1-е сутки после операции выполнялся МРТ-контроль с контрастным усилением (рис. 9 и 10). Тотального удаления опухоли (100% опухоли) удалось достичь у 39 (60%) пациентов (см. рис 1, 9, 10), субтотального (80—95% опухоли) — у 16 (24%), 10 (16%) пациентам проведено частичное удаление опухоли (опухоль прорастала внутреннюю капсулу, речевые центры или первичные моторные центры). На момент выписки состояние пациентов по шкале Карновского составило 80±10 баллов. Срок пребывания пациента в стационаре после операции составил 7±1 день. У 47 (72%) пациентов ухудшения неврологического статуса не произошло. У 18 (28%) пациентов в раннем послеоперационном периоде было отмечено усиление неврологического дефицита в виде нарастания пареза на 1—2 балла или усугубления речевых нарушений: у 11 пациентов усилился двигательный дефицит на 1 балл, у 7 пациентов усилилась выраженность афазии (в группу вошли 5 пациентов, которым awake не проводился, и 2 пациента, оперированных с картированием речевых зон). У 8 пациентов в течение 7 дней после операции отмечен частичный регресс пареза (в среднем на 1 балл). При отслеживании катамнеза через 4 мес у 18 пациентов в группе с усилением неврологического дефицита у 10 из них был отмечен регресс неврологического дефицита. Через 4 мес неврологический дефицит на послеоперационном уровне сохранился у 5 пациентов: у 3 — гемипарез 2—3 балла, сильнее выраженный в руке, у 3 — элементы моторной афазии, у 2 — гемипарез 3—4 балла, сильнее выраженный в ноге. Таким образом, стойкий неврологический дефицит через 4 мес сохранился у 8 (12%) пациентов, что соответствует данным мировой литературы.
Рис. 9. Дооперационные и контрольные снимки: МРТ головного мозга, Т1-взвешенное изображение с контрастированием, аксиальная проекция. а — дооперационное изображение: картина объемного образования левой островковой доли, интенсивно накапливающего контрастное вещество; б — послеоперационное изображение в 1-е сутки после операции: опухоль удалена тотально, накопления контрастного вещества нет.
Рис. 10. а — дооперационные снимки, Т2-взвешенное изображение в аксиальной проекции до операции: определяется объемное образование левой лобной доли (в проекции зоны Брока) с выраженным перифокальным отеком; б — послеоперационные снимки, Т-взвешенное изображение в 1-е сутки после радикального удаления опухоли левых лобной, островковой и височной долей головного мозга: признаков остаточной ткани опухоли нет.
Таблица «Строение и функции головного мозга»
| Отдел | Особенности строения | Функции |
| Конечный или передний | Состоит из двух полушарий, которые соединяются между собой мозолистым телом. Поверхность полушарий имеет множество борозд и извилин. | Правое полушарие отвечает за левую сторону тела, а левое – за правую сторону. Здесь расположены центры регуляции произвольных движений, центры условных рефлексов и психических функций. Височная доля коры головного мозга регулирует слух, вкус и обоняние, затылочная – зрение, теменная – осязание; лобная – произношение речи. |
| Промежуточный | Состоит из гипоталамуса и таламуса. | Таламус является посредником в передаче раздражителей к полушариям и помогает адекватно приспособиться к изменениям в окружающей среде. Гипоталамус регулирует работу обменных процессов и эндокринных желёз. Руководит работой сердечнососудистой и пищеварительной системы. Регулирует сон и бодрствование, управляет пищевыми и питьевыми потребностями. |
| Задний | Состоит из мозжечка и моста, который представлен в виде белого толстого валика, расположенного над продолговатым отделом. Мозжечок расположен позади моста, имеет два полушария, нижнюю и верхнюю поверхности и червя. | Данный отдел обеспечивает функцию посредника при передаче импульсов в расположенные выше отделы мозга. Мозжечок отвечает за координацию и точность движений. |
| Средний | Расположен от переднего края моста до зрительных трактов. | Отвечает за скрытое зрение, а также осуществление ориентировочных рефлексов, (поворот тела в направлении звука). |
| Продолговатый | Является продолжением спинного мозга. | Управляет равновесием, содержит центры дыхания, глотания, чихания и кашля, рвоты, сердечно-сосудистый и пищеварительные. |
Материал и методы
В период с 2014 по 2015 г. в отделении нейрохирургии № 2 НМХЦ им. Н.И. Пирогова пролечены 65 пациентов (43 (66%) мужчины и 22 (34%) женщины в возрасте от 32 до 68 лет) с глиальными опухолями ФЗЗ головного мозга. При первичном неврологическом осмотре у 46 (71%) пациентов был выявлен моторный дефицит разной степени выраженности (у 6 пациентов диагностирован гемипарез со снижением силы до 1 балла, у 15 — до 2—3 баллов, у 25 — до 4 баллов). У 17 (26%) пациентов диагностирована афазия (у 12 из них — сочетание речевых и двигательных нарушений, у 5 — изолированные речевые нарушения).
У 40 (62%) пациентов наблюдалась локализация опухолей в лобной и височной долях. Изолированное поражение одной доли было лишь у 9 пациентов: у 4 — островковой, у 2 — лобной, у 3 — височной. У 37 (58%) пациентов опухоль поражала левое полушарие, у 24 (36%) — правое. У 4 (6%) пациентов опухоль распространялась на оба полушария головного мозга (табл. 1).
Таблица 1. Локализация глиальных опухолей у оперированных пациентов
64 пациента оперированы первично. Один пациент оперирован за период наблюдения 2 раза: первично по поводу опухоли лобной, височной и островковой долей слева (с вовлечением зоны Брока и зоны Вернике) и спустя 16 мес — повторно в связи с продолженным ростом опухоли. Обе операции проводились по протоколу asleep-wake-asleep. Контроль радикальности удаления опухоли (МРТ с контрастированием) выполнялся всем пациентам в 1-е сутки после операции (рис. 1).
Рис. 1. Снимки дооперационного планирования на навигационной станции. МРТ-головного мозга, Т1-взвешенное изображение с контрастированием. а — фронтальная; б — сагиттальная; в — аксиальная проекции. Определяется объемное образование (1) левой височной и теменной долей головного мозга (в проекции верхней височной, угловой и надкраевой извилин) с нечеткими неровными контурами, с выраженным перифокальным отеком, интенсивно накапливающее контрастный препарат. Стрелками обозначены моторная кора (2), пирамидные тракты (3) и речевые зоны (4); г — 3D-модель мозга с проекцией ФЗЗ и опухоли.
Наряду с МРТ в стандартных режимах, 50 (77%) пациентам на этапе предоперационной диагностики проводилась фМРТ в связи с наличием речевых нарушений у 17 пациентов и заинтересованностью внутренней капсулы у 4 пациентов (дополнительно в группу были включены 9 пациентов, проявлений афазии у которых не было, но риск ее развития после операции был высок). Методика фМРТ основана на регистрации регионарных гемодинамических изменений, возникающих при активации коры головного мозга в ответ на специфическую стимуляцию (чередование фаз покоя и двигательной, мыслительной или иной активности). По итогам обследования у этих больных были установлены взаимоотношения опухоли с моторными путями, зонами Вернике и Брока (рис. 2 и 3).
Рис. 2. Снимки с навигационной станции МРТ головного мозга, Т1-взвешенное изображение с контрастированием, сагиттальная (а) и аксиальная (б) проекции: определяется объемное образование (1) правой височной и теменной долей головного мозга, с нечеткими неровными контурами, с выраженным перифокальным отеком, интенсивно накапливающее контрастный препарат. Обозначены пирамидные тракты (2), проходящие кпереди от опухоли; в — 3D-модель пространственного взаимоотношения опухоли (1) и пирамидных трактов.
Рис. 3. Дооперационные и контрольные снимки МРТ головного мозга, Т2-взвешенное изображение, сагиттальная и фронтальная проекции. Дооперационное Т2 (а) и Flair (б) изображения: картина объемного образования левой лобной доли с вовлечением премоторной зоны и передних отделов прецентральной извилины; послеоперационное Т1 (в) и Flair (г) изображения в 1-е сутки после операции. Опухоль удалена тотально.
У пациентов с лобно-височной локализацией опухоли в доминантном полушарии и близостью к речевым центрам с целью снижения риска появления или нарастания послеоперационной моторной, сенорной и амнестической афазии удаление опухоли проводилось с интраоперационным пробуждением (по протоколу asleep-awake-asleep) (16 пациентов). Для этого бригадой анестезиологов и нейрохирургов накануне операции с пациентом проводилась беседа, в ходе которой рассматривались все этапы будущего оперативного вмешательства. Особое внимание уделялось моменту пробуждения в операционной. Анестезиолог добивался осознанного представления пациента о том, что ему предстоит увидеть в операционной. Обсуждалось, какие ощущения он будет испытывать, когда проснется, какими могут быть особенности при пробуждении. Кроме того, проводилось тестирование с картинками, в ходе которого пациент называл и описывал изображенные предметы, а также отрабатывался устный счет, запоминание последовательности слов, чтение. Критериями отбора пациентов для протокола asleep-awake-asleep являлись отсутствие выраженных мнестических нарушений т. е. способность вступить в полноценный вербальный контакт, отсутствие выраженной психической лабильности, отсутствие грубого моторного и сенсорного речевого дефицита. В ходе тестирования у 5 пациентов были выявлены явные мнестические нарушения или выраженные явления сенсомоторной афазии, в результате чего от проведения краниотомии в сознании решили воздержаться.
Во ходе операций ИОНМ проводился на аппарате Natus Xltek protektor. Цель ИОНМ — динамическое отслеживание спонтанной и вызванной био-электрической активности головного мозга (моторные вызванные потенциалы). В ходе нейрофизиологического контроля моторные вызванные потенциалы оценивались при помощи транскраниальной электростимуляции, основанной на активации пирамидных клеток кортикоспинального тракта (поле 4 по Бродману прецентральной извилины). Стимулирующие электроды располагались в проекции точек С3, С4, согласно международной схеме 10—20 [3]. В зависимости от хирургического доступа использовались различные варианты установки электродов. Для оценки проводимости электрического импульса по пирамидным трактам всем пациентам выполнялась транскраниальная электростимуляция, независимо от степени выраженностиневрологического дефицита. Регистрация моторных ответов проводилась при помощи игольчатых электродов, установленных в мышцы (m.
OrbicularisOculis,m.OrbicularisOris,m.Deltoideus,m.Thenari/Hypothenari,m.RectusFemori,m.TibialisAnterior
). Транскраниальная стимуляция (рис. 4) выполнялась единичными трейнами по 4 коротких высокочастотных стимула (500 Гц). Параметры напряжения подбирались индивидуально до получения репрезентативных М-ответов со всех тестируемых мышц. Регистрация М-ответов проводилась в условиях чувствительности усилителя 50 мкВ/дел при режекторном фильтре 50 Гц. В ходе операции моторные ответы регистрировались с обеих сторон. Разность амплитуды и латентности варьировали в зависимости от исходного неврологического дефицита и вариантов установки стимулирующих электродов.
Рис. 4. Мониторинг пирамидных путей (транскраниальная стимуляция) при удалении глиомы нижних отделов прецентральной извилины лобной и нижних отделов постцентральной извилины теменной долей левого полушария. Тестовыми мышцами были выбраныm. Deltoideus (а), m. Thenari (б, в), m. Tibialisanterior(г, д). Оранжевой стрелкой указан М-ответ, полученный с тестируемой мышцы. Красной стрелкой обозначена серия стимулов.
Моторное картирование коры (рис. 5) применялось у 50 пациентов с заинтересованностью прецентральной извилины или коры премоторной зоны. Для этого применялась методика прямой стимуляции коры биполярным электродом пачками по 4 стимула с внутренней частотой 500 Гц и силой стимула до 25 мА с регистрацией моторных ответов с тестируемых мышц контралатеральной стороны.
Рис. 5. Моторное картирование средних и нижних отделов прецентральной извилины перед энцефалотомией у пациентки при удалении глиомы лобно-височной локализации. Тестовымимышцамивыбраны m. Longinalis superior (а), m. Orbicularis oris (б), m. Deltoideus (в), m. Thenari (г), m. Tibialis Anterior (е), m. Rectus.
Пациентам (n
=16) с локализацией опухоли в проекции речевых зон удаление опухоли производилось по протоколу asleep-awake-asleep [4]. После угнетения сознания введением внутривенно раствора пропофола в дозе 1,0—1,5 мг/кг, аналгезии раствором фентанила в дозе 2,5—3,0 мкг/кг и миорелаксации рокуронием в дозе 0,7 мг/кг, проводилась интубация трахеи и начиналась ИВЛ в режимах нормовентиляции. Контроль уровня сознания пациента обеспечивался ингаляцией дезфлюрана в дозах 0,3—0,6 МАК в условиях мониторинга глубины угнетения сознания (целевыми значениями BIS были 50—60). Для оценки уровня мышечной релаксации использовался монитор нейромышечной проводимости по методике TOF. Линия кожного разреза инфильтрировалась раствором 0,2% ропивокаина в суммарных дозах, не превышающих 300 мг с учетом проводниковой анестезии. Анестезия твердой мозговой оболочки (ТМО) проводилась путем аппликации ватников с лидокаином. После выполнения краниотомии и достижения уровня восстановления нейромышечной проводимости, TOF 0,9 и более, прекращали подачу дезфлюрана, пациента пробуждали и экстубировали. Картирование ФЗЗ мозга выполнялось в 2 этапа. До пробуждения пациента методом прямой электростимуляции коры верифицировались моторные зоны, граничащие с образованием. После пробуждения и экстубации налаживался вербальный контакт, а затем проводилось картирование речевых зон (рис. 6). Для интраоперационной верификации зоны Вернике были выбраны задания на повтор серий частотных слов по три, позволяющие диагностировать нарушения фонематического слуха и объема слухоречевого восприятия (а также произносительной стороны речи), тестирование с называнием картинок, чтение и счет. Процедура интраоперационного речевого тестирования была отработана с пациентами накануне операции, в тестовый набор были включены только задания, доступные для стабильного безошибочного выполнения. В ходе стимуляции коры биполярным стимулятором в зонах Брока и Вернике ритмичными пачками по 4 стимула силой 15—20 мА у некоторых пациентов были зарегистрированы различные варианты нарушения речи: speech-arest (5 пациентов), элементы моторной афазии, литеральные парафазии с заменой звуков по акустической близости и вербальные парафазии с заменой слов по акустической близости, характерные для нарушения фонематического слуха (7).
Рис. 6. Интраоперационное картирование речевых зон. Интраоперационное фото (а). Трепанационное окно сформировано в левой лобно-височно-теменной области. ТМО вскрыта. После пробуждения пациента проведено картирование речевых зон. Определена зона Брока, (22, 21, 25 — желтый контур), зона Вернике (16—18, 20 — зеленый контур) и нижние отделы прецентральной извилины (22, 26 — голубой контур). На фМРТ (б) зеленым цветом обозначены речевые центры, опухоль локализована в левой островковой доле.
После верификации зон Брока и Вернике проводилось удаление опухоли при неврологическом и нейрофизиологическом контроле сохранности речевых функций и моторных трактов (рис. 7). У 2 пациентов после картирования речевых зон развились двигательное беспокойство, эмоциональная лабильность, что потребовало возобновления эндотрахеального наркоза (среднее время awake составило 30±12 мин).
Рис. 7. Интраоперационное фото. Этап удаления опухоли с интраоперационным картированием речевых зон. На этапе awake проведено картирование речевых зон. Метками обозначена зона Вернике, обнаруженная в ходе прямой стимуляции коры на этапе пробуждения. Зеленым контуром обозначена проекция опухоли.
У остальных 14 пациентов тестирование продолжалось на протяжении всего удаления опухоли (время awake составляло 120±20 мин). После удаления опухоли пациенты вновь были введены в наркоз, интубированы с использованием коротких миорелаксантов, и операция завершалась под общей анестезией с продолжающимся мониторингом в виде транскраниальной стимуляции.
У 11 (17%) пациентов с распространением опухоли во внутреннюю капсулу проводилась стимуляция моторных проводящих путей (рис. 8). Порог стимуляции ступенчато снижался с 10 до 5 мА (по данным литературы, изменение на 1 мА соответствует изменению расстояния на 1 мм). Изменение силы стимула до минимально репрезентативного позволило проводить удаление опухоли в непосредственной близости от внутренней капсулы. У 5 (8%) пациентов в процессе удаления опухоли из-за появления моторного ответа на силу стимула 5 мА удаление было прекращено в связи с крайне высоким риском возникновения неврологического дефицита.
Рис. 8. Удаление опухоли лобной доли с интраоперационным картированием моторных зон. а — интраоперационное фото: этап удаления опухоли левой лобной доли, стрелкой обозначен биполярный стимулятор, применяемый в ходе картирования моторных проводящих путей в белом веществе. На фМРТ стрелками отмечено моторное представительство руки (б) и ноги (в), опухоль находится в непосредственной близости от этих зон и соприкасается с пирамидными трактами.
Независимо от локализации опухоли и выбранного протокола анестезии (в том числе краниотомии в сознании) всем пациентам проводился фоновый мониторинг транскраниальных моторных вызванных потенциалов. У 8 пациентов амплитуда М-ответа в ходе удаления опухоли снижалась более чем на 50%. При оценке послеоперационного неврологического статуса все они вошли в группу из 11 пациентов, у которых нарос моторный дефицит. У 21 пациента отмечалось временное снижение амплитуды (не более чем на 40%), что, по-видимому, объясняется наличием эффекта смещения мозга после удаления опухоли или действием коротких миорелаксантов на этапе повторной интубации по протоколу asleep-awake-asleep.
У 43 (66%) пациентов гистологический диагноз соответствовал глиобластоме (WHO Grade IV), у 7 (11%) — фибриллярной астроцитоме (WHO Grade II), у 6 (9%) — олигодендроглиоме (WHO Grade II). Анапластическая астроцитома (WHO Grade III) была верифицирована у 9 (14%) пациентов, из них 2 пациента были оперированы повторно с использованием картирования по поводу продолженного роста опухоли.