- Как часто встречаются нейробластомы?
- Факторы риска при нейробластоме
- Каковы причины возникновения нейробластомы?
- Можно ли предотвратить развитие нейробластомы?
- Возможна ли ранняя диагностика нейробластомы?
- Как диагностируется нейробластома?
- Лечение нейробластомы у детей
- Что происходит после окончания лечения нейробластомы?
Нейробластома — один из видов злокачественных опухолей и встречается обычно у младенцев и детей и очень редко у детей старше 10 лет. Клетки этой опухоли напоминают нервные клетки на ранних этапах их развития у плода.
Одна треть нейробластом развивается в надпочечниках, другая треть — в брюшной полости по ходу нервных стволов вдоль позвоночника и остальные — в грудной полости и на шее. Некоторые нейробластомы возникают из спинного мозга. Иногда в связи с широким распространением опухоли на момент диагностики трудно установить точно место, откуда возникла опухоль.
Не все опухоли нервной системы относятся к злокачественным.
Ганглионеврома — пример доброкачественной опухоли.
Ганглионейробластома является смешанной опухолью и содержит как злокачественные, так и доброкачественные участки. Незрелые (злокачественные) клетки этой опухоли могут расти и метастазировать.
Ганглионевромы обычно удаляют хирургическим путем и затем тщательно изучаются под микроскопом для выяснения нет ли там участков ганглионейробластомы. В случае установления диагноза ганглионевромы дополнительное лечение не требуется. Напротив, ганглионейробластомы лечат так же, как и нейробластомы.
Нейробластома является необычной опухолью по многим причинам. Эта опухоль выделяет гормон, приводящий к необычным изменениям в организме, например, вращательным движениям глазных яблок, спастическим подергиваниям мышц, наличию постоянного жидкого стула.
Указанные изменения носят название паранеопластических синдромов.
Нейробластома может вести себя необычным образом. Иногда опухолевые клетки произвольно погибают и опухоль исчезает. Такое явление встречается чаще всего у очень маленьких детей и значительно реже у больных более старшего возраста. В ряде случаев опухолевые клетки самопроизвольно созревают и перестают делиться. Таким образом нейробластома превращается в ганглионеврому — доброкачественную опухоль.
Как часто встречаются нейробластомы?
Нейробластома является самой частой опухолью у младенцев и занимает четвертое место по частоте среди всех злокачественных опухолей у детей более старшего возраста после острых лейкозов, опухолей центральной нервной системы и злокачественных лимфом.
Ежегодно нейробластомой в России заболевают 6-8 детей на 1 млн. детского населения до 15 лет (средний возраст- 2 года).
Каждый год в США диагностируется приблизительно 650 новых случаев нейробластомы и эта цифра держится стабильно в течение многих лет. У мальчиков нейробластома возникает несколько чаще, чем у девочек. На каждые 6 случаев опухолей у мальчиков приходится 5 случаев у девочек.
Средний возраст больных на момент диагностики составляет 17 месяцев. Одна треть случаев диагностируется у детей до 1 года. Почти 90% нейробластом выявляется до 5-летнего возраста. Лишь 2% опухолей обнаруживается в возрасте после 10 лет и у взрослых больных. В редких случаях нейробластому можно выявить с помощью ультразвукового исследования еще до рождения ребенка.
В 7 из 10 случаев нейробластома на момент диагностики уже имеет метастазы.
Факторы риска при нейробластоме
Фактор риска — это то, что увеличивает вероятность возникновения опухоли.
Факторы, связанные с образом жизни, являются основными при раке у взрослых. В качестве примеров можно привести нездоровую диету (малое потребление фруктов и овощей), малоподвижность, курение и употребление алкоголя. Факторы риска, связанные с образом жизни детей, не влияют на возникновение злокачественных опухолей.
Вероятность возникновения нейробластомы по всему миру почти одинаковая. Это дает возможность предположить, что факторы окружающей среды, например, ее загрязнение, не являются причиной развития этой опухоли.
Единственным известным фактором риска при нейробластоме является наследственность. Полагают, что некоторые люди очень редко могут наследовать риск развития нейробластомы. Только в 1-2% случаев диагностируется семейная форма нейробластомы, т.е. возникновение опухоли у ребенка, в семье которого имелись случаи этого заболевания.
Средний возраст больных на момент диагностики семейных случаев нейробластомы составляет 9 месяцев. Это меньше возраста больных со спорадическими (не наследуемыми) случаями опухоли. Кроме того, у детей с семейной нейробластомой возможно возникновение двух и более аналогичных опухолей в различных органах, например, в обоих надпочечниках.
Важно различать нейробластомы, развивающиеся одновременно в различных органах, от метастатической нейробластомы, когда опухоль возникает в одном органе и затем распространяется по организму. Если нейробластома возникла в нескольких местах, то можно предположить семейную форму заболевания. Метастазы нейробластомы могут возникать как при семейных, так и спорадических случаях опухоли.
Лечение
Как и при других видах рака, приоритетным направлением в лечении нейробластомы является оперативное вмешательство. При этом может выполняться как полное, так и частичное удаление новообразования. Если во время операции было удалено менее половины опухоли, то на втором этапе проводят химиотерапию. Затем снова рассматривается вопрос о проведении повторной операции, целью которой будет являться удаление оставшейся нейробластомы.
При невозможности проведения хирургического лечения, назначают химиотерапию. Если пациент относится к высокой группе риска, то ему назначают высокодозную химиотерапию и дополнительно проводят пересадку стволовых клеток. При неэффективности химиотерапии применяют лучевую терапию.
Прогноз при нейробластоме относительно благоприятный. Если опухоль была выявлена на ранней стадии, то показатели 3-летней выживаемости приближаются к 100%. При III стадии нейробластомы этот показатель составляет 80-98%, а при IV — 60-76%.
Запись на консультацию круглосуточно +7+7+78
Каковы причины возникновения нейробластомы?
Точные причины возникновения нейробластомы не ясны. Однако известны различия между клетками нейробластомы и нормальными нейробластами. Выяснены различия между нейробластомами, которые отвечают на лечение и которые не поддаются терапии и имеют плохой прогноз (исход) заболевания. Эта информация важна при выработке подходов к лечению.
Многие исследователи полагают, что нейробластома возникает в том случае, когда нормальные эмбриональные нейробласты не созревают в нервные клетки или клетки коры надпочечников. Вместо этого, они продолжают расти и делиться.
Нейробласты могут полностью не созреть к моменту рождения ребенка. В действительности, показано, что небольшие скопления нейробластов часто выявляются у младенцев до 3-месячного возраста. Большинство таких клеток в итоге созревают в нервные клетки и не образуют нейробластому. Иногда нейробласты, остающиеся у младенцев, продолжают расти и образуют опухоль, которая может даже метастазировать в различные органы. Однако многие такие опухоли, в конце концов, созревают или исчезают.
По мере роста ребенка вероятность созревания таких клеток уменьшается, а вероятность формирования нейробластомы увеличивается. При достижении нейробластомой больших размеров и появлении симптомов созревание клеток прекращается, они продолжают расти и распространяться, если не проводится лечение.
У некоторых онкологических больных имеются мутации (изменения) ДНК, которые они унаследовали от одного из родителей, что повышает риск развития опухоли. Некоторые полагают, что некоторые семейные случаи нейробластом возникли в результате наследуемых мутаций гена, угнетающего опухолевый рост.
Большинство нейробластом не являются следствием наследуемых мутаций ДНК. Они вызваны мутациями, приобретенными в ранний период жизни ребенка. Эти мутации присутствуют в опухолевых клетках родителя ребенка и не передаются детям. Причины, вызывающие изменения ДНК, приводящие к возникновению нейробластом, не известны.
Возможна ли ранняя диагностика нейробластомы?
Проведенные исследования показали, что скрининг (проведение обследования при отсутствии симптомов заболевания) у детей с целью ранней диагностики нейробластомы не имеет ценности.
С помощью скрининга (исследования мочи на выявление определенных веществ) в 6-месячном возрасте действительно удалось диагностировать больше случаев нейробластомы.
Однако эти опухоли относились к таким, которые или исчезали затем самостоятельно или же созревали и, возможно, никогда и не были бы диагностированы.
По той же причине считается, что такой скрининг не приведет к снижению смертности от нейробластомы.
Более того, современные методы скрининга не являются столь специфичными, как бы хотелось. Из двух детей с подозрением на нейробластому, по данным скрининга, лишь в одном случае действительно имелась опухоль. Эти ложные результаты приводили к неоправданному беспокойству родителей и операциям у детей при отсутствии нейробластомы.
В редких случаях нейробластому можно диагностировать до рождения с помощью ультразвукового исследования (УЗИ). Данный метод применяется для определения возраста плода, прогнозирования времени рождения ребенка и выявления некоторых врожденных дефектов. Совершенствование УЗИ и других методов может привести к более точной диагностике нейробластомы до рождения ребенка.
Как диагностируется нейроблстома?
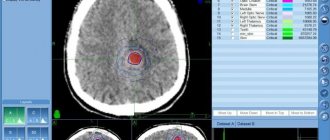
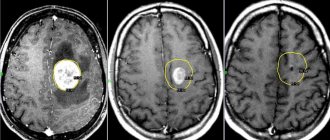
Если у ребенка имеются признаки и симптомы, позволяющие предположить наличие нейробластомы, то потребуется дополнительное обследование, включая анализы крови и мочи, микроскопическое изучение ткани, а также использование методов изображения: компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ), сканирования и пр.
Такое дополнительное обследование необходимо, так как многие симптомы нейробластомы могут быть вызваны другими опухолями и неопухолевыми заболеваниями.
Признаки и симптомы нейробластомы зависят от локализации первичной опухоли и степени распространения процесса в близлежащие или отдаленные органы и части тела.
Наиболее частым признаком нейробластомы является обнаружение опухоли в животе, что приводит к увеличению его размеров. Ребенок может жаловаться на чувство распирания живота, дискомфорт или боль, как результат наличия опухоли. Однако пальпация опухоли не вызывает болевых ощущений. Опухоль может располагаться и в других областях, например, на шее, распространяясь за глазное яблоко и вызывая его выпячивание.
Нейробластома часто поражает кости. При этом ребенок может жаловаться на боли в костях, хромать, отказываться ходить. В случае распространения опухоли в спинномозговой канал может возникнуть сдавление спинного мозга, что приводит к слабости, онемению и параличу нижних конечностей.
У каждого четвертого больного возможно повышение температуры.
Реже могут отмечаться:
- Постоянный жидкий стул (диарея)
- Высокое артериальное давление, приводящее к раздражительности
- Учащенное сердцебиение
- Покраснение кожи
- Потливость
Эти признаки и симптомы являются результатом выброса гормонов клетками нейробластомы.
Иногда у больных возникает отек нижних конечностей и мошонки за счет сдавления кровеносных и лимфатических сосудов в области малого таза. В ряде случаев растущая опухоль может привести к нарушению функции мочевого пузыря и толстой кишки. Давление нейробластомы на верхнюю полую вену, которая несет кровь от головы и шеи к сердцу, может вызвать отек лица или глотки. Эти явления, в свою очередь, могут привести к нарушению дыхания или глотания.
В результате сдавления нервов в грудной полости и на шее могут возникнуть такие симптомы, как опущение век и сужение зрачка. Сдавление нервов около позвоночника может привести к тому, что ребенок потеряет способность двигать руками или ногами.
Появление голубоватых или красноватых пятен, напоминающих небольшие кровоподтеки, может указывать на поражение кожи опухолевым процессом.
Из-за вовлечения в процесс костного мозга, производящего клетки крови, у ребенка могут снизиться все показатели крови, что может вызвать слабость, частые инфекции и повышенную кровоточивость при незначительных травмах (порезах или царапинах).
Нормальные нервные клетки поддерживают между собой связь за счет высвобождения определенных химических веществ, основными из которых являются катехоламины. В организме катехоламины разлагаются на метаболиты, которые затем выводятся с мочой.
В 90% случаев клетки нейробластомы вырабатывают такое количество катехоламинов, которое можно обнаружить в моче с помощью специальных методов. Обычно определяют два основных метаболита катехоламинов: гомованилиновую кислоту (ГВК) и ванилилминдальную кислоту (ВМК).
Некоторые симптомы, связанные с нейробластомой, например, высокое артериальное давление, учащенное сердцебиение и жидкий стул, непосредственно объясняются повышением уровня катехоламинов.
Биохимический анализ крови позволяет судить о функции печени и почек.
Для выявления опухоли и ее метастазов применяют компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ), сканирование костей и ультразвуковое исследование (УЗИ).
Хотя ряд методов обследования позволяет предположить наличие нейробластомы, тем не менее, окончательный диагноз устанавливается только при обнаружении клеток нейробластомы при микроскопическом исследовании.
Иногда клетки нейробластомы можно спутать с клетками других опухолей детского возраста. В этом случае используется иммуногистохимическое исследование опухоли после специальной обработки антителами. Эти антитела связываются с клетками нейробластомы в отличии от клеток других опухолей у детей.
Если уровни катехоламинов или их метаболитов повышены, то обнаружения клеток нейробластомы в костном мозге достаточно для установления окончательного диагноза. Костный мозг может быть поражен у 25% больных нейробластомой.
В некоторых клиниках применяют новый метод сканирования с использованием радиоактивного метайодобензилгуанидина (МЙБГ). Метод позволяет обнаружить клетки нейробластомы в костном мозге и в других частях тела.
Клинические проявления
Как и другие виды злокачественных опухолей, на ранних стадиях нейробластома протекает бессимптомно. Выявить новообразование можно случайно, когда пациент проходит обследование по другому поводу. Клинические проявления появляются тогда, когда опухоль достигает относительно больших размеров и начинает сдавливать рядом расположенные структуры. При этом симптомы неспецифичны и заподозрить онкологический процесс очень сложно. В зависимости от расположения опухоли, это могут быть:
- Запор, вздутие живота, рвота, диарея при локализации нейробластомы в брюшной полости.
- Нарушение глотания или дыхания при расположении опухоли в области грудной клетки.
- Неврологические нарушения при локализации первичного новообразования в позвоночном канале.
Также опухоль может располагаться в области таза, шеи, вдоль позвоночного столба. В некоторых случаях определить первичную локализацию новообразования не удается.
Среди других неспецифических симптомов могут отмечаться слабость, быстрая утомляемость, увеличение лимфатических узлов, плохой аппетит, боли в костях. Эти проявления характерны для более поздних стадий нейробластомы, когда уже имеются метастазы в другие органы и ткани. Чаще всего опухоль метастазирует в костный мозг, кости, лимфатические узлы, печень, легкие и различные отделы центральной нервной системы.
Лечение нейробластомы у детей
Каждый ребенок с нейробластомой должен получать лечение. Метод лечения зависит от стадии опухоли, возраста ребенка, а также прогностических факторов. Лечение включает операцию, применение химиотерапии и/или лучевой терапии. У некоторых детей могут применяться два или все три метода терапии.
Обычно при выборе метода лечения нейробластомы учитывают не столько стадию заболевания, сколько группу риска.
Группа низкого риска. Как правило, детям из группы низкого риска требуется только оперативное вмешательство, за исключением некоторых больных.. Для этой небольшой группы детей может быть использована химиотерапия.
Группа промежуточного риска. Больным с этой группой риска назначают 4-8 циклов химиотерапии до или после операции. В отдельных случаях проводится повторная операция для удаления оставшейся опухоли или лучевая терапия.
Группа высокого риска. Для этой группы пациентов применяют очень интенсивную химиотерапию наряду с трансплантацией костного мозга или периферических стволовых клеток.
Операция и/или лучевая терапия могут быть составной частью общей лечебной программы. Биологические вещества, например, 13-цисретиноидная кислота, назначаются в течение 6 месяцев после прекращения терапии.
К сожалению, у некоторых больных после лечения нейробластомы может возникнуть рецидив (возврат) болезни после первичного лечения. Лечение в этом случае зависит от многих факторов, включая группу риска и место рецидива, и может включать операцию и химиотерапию.
Нейробластома
Несмотря на то, что нейробластома интенсивно изучается клиницистами и экспериментаторами уже более 100 лет, лечение этого заболевания остается важной проблемой детской онкологии. Выбор стратегии лечения, по крайней мере, зависит от двух факторов: — прогностических признаков, выявленных у детей во время установления диагноза заболевания; — реакции опухоли на лечение. Отвечая на эти вопросы, химиотерапевт, хирург и радиолог могут определить рациональную тактику лечения ребенка с нейробластомой, которая должна быть интенсивной в случае наличия отрицательных прогностических признаков у больного, и менее агрессивной — при хорошем прогнозе. К сожалению, нейробластома до настоящего времени остается плохопредсказуемой опухолью.
Химиотерапия Ninane (1990) приводит следующие схемы противоопухолевого лекарственного лечения детей с нейробластомой.
При монохимиотерапии больных нейробластомой, проводившейся обычными дозами, значимо эффективными оказались 7 препаратов — винкристин, циклофосфамид, цисплатин, доксорубицин, вепезид (VP -16), тенипозид (VM -26) и мелфалан. Позднее была показана противоопухолевая активность ифосфамида и карбоплатина при нейробластоме.
До 1980 года ряд химиотерапевтических режимов состоял из винкристина и циклофосфамида с или без адриамицина. Результаты лечения с использованием этих схем оказались разочаровывающими для детей старше 1 года с местнораспространенной опухолью, так как 2 года переживало только 10% детей. Добавление цисплатины, вепезида и тенипозида привело к повышению начального противоопухолевого эффекта, но мало сказалось на отдаленных результатах.
В последние годы для повышения результатов химиотерапии были предложены высокодозные схемы лечения с пересадкой костного мозга).
Отметим следующее: 1. Использование высоких доз мелфалана в виде единственного Препарата позволяло получить результаты, по своему эффекту мало отличающиеся от результатов, которые наблюдались после интенсивной полихимиотерапии или комбинации ее с тотальным облучением. 2. Смертность из-за токсичности проводимого лечения была наименьшей в группе больных, которым проводилось только введение высоких доз мелфалана.
Необходимо отметить, что указанное лечение проводилось в виде консолидирующей терапии у детей с распространенными формами заболевания. Было показано, что больные с полной или значительной регрессией опухоли после начальной химиотерапии имели лучшие показатели 2 летней продолжительности жизни по сравнению с теми, у которых опухоль мало реагировала на начальное лечение.
Интересные данные о многолетнем наблюдении за больными с нейробластомой, подвергшимися интенсивной химиотерапии были представлены Philip et al. (1990) и Dini et al. (1990).
Первые исследователи наблюдали, в среднем, 55 месяцев 62 больных нейробластомой в IV стадии, возраст которых был более 1 года. Дети всей группы получали интенсивную консолидирующую химиотерапию с пересадкой костного мозга. Два года без прогрессирования заболевания прожило 40% детей, 5 лет — 25% и 13% — 7 лет. Однако в группе больных с полной регрессией метастазов 2 и 7 лет прожило 37% детей. Dini et al. (1990) привели данные о 34 больных с IV стадией и рецидивами нейробластомы в возрасте более 1 года. После интенсивной консолидирующей химиотерапии с пересадкой костного мозга 4 года без прогрессирования заболевания прожило 29% больных.
Оперативное лечение Оперативное лечение широко используется для радикального удаления ограниченной первичной опухоли. Кроме того, в последние годы оперативному вмешательству подвергаются больные с местнораспространенными или метастатическими нейробластомами. После начальной химиотерапии нередко возникает возможность радикального удаления первичной опухоли и метастазов вследствие их значительной регрессии. В ряде случаев прибегают и к повторным оперативным вмешательствам, если первичная операция оказалась нерадикальной, но затем опухоль уменьшилась после проведения дополнительной химиотерапии.
Лучевая терапия В настоящее время, в связи с прогрессивным развитием противоопухолевой лекарственной терапии, роль традиционного лучевого лечения больных нейробластомой уменьшилась. Это связано еще и с тем, что эта опухоль в основном поражает маленьких детей, облучение которых несет опасность отдаленных лучевых повреждений.
Все же в некоторых клинических ситуациях имеются показания к ее применению. Во-первых, лучевое лечение может быть проведено при нерадикальном оперативном удалении первичной опухоли и ма¬лой эффективности химиотерапии, во-вторых, при наличии местнораспространенной неоперабельной первичной или метастатической опухоли, не реагирующей на современные курсы химиотерапии.
Величина дозы излучения, прежде всего, зависит от возраста ребенка и величины остаточной опухоли. По мнению Tereb, Tent, при облучении ребенка до года адекватной дозой могут быть 10 Гр, подведенных в течение двух недель (по 1 Гр за фракцию). Jacobson (1984), поддерживая эту точку зрения, рекомендует дозу в 12 Гр за две недели.
У детей более старшего возраста суммарная доза ионизирующего излучения на опухоль должна быть увеличена. Например, у детей от 1 до 2-х лет — до 15 Гр за две недели (по 1,5 Гр ежедневно 5 раз в неделю). В возрасте старше 3-х лет доза может достигать 30-45 Гр, подводимых разовой очаговой дозой от 1,5 до 2 Гр 5 раз в неделю (Jacobson, 1984; Scognamillo, 1987 и др.).
Нередко после подведения указанных доз опухоль либо полностью регрессирует, либо значительно уменьшается в размерах. В последнем случае становится возможным оперативное удаление остатков нейробластомы. Симптоматический эффект может быть достигнут после однократного облучения в дозе 5 Гр, но в случаях относительно удовлетворительного состояния ребенка лучше использовать курс облучения с разовой дозой 3 Гр, подводимых за 5 фракций.
При лучевом лечении необходимо захватывать всю опухоль или ее ложе с 2 см прилежащих тканей.
Полагаем, что вопрос о применении лучевой терапии больных нейробластомой должен решаться в каждом случае индивидуально. При этом необходимо учитывать возможный непосредственный эффект на растущую опухоль. Например, даже при больших нерезектабельных опухолях бывает достаточно подвести дозу излучения в 10-15 Гр за 2-3 недели (1 Гр ежедневно), чтобы добиться эффекта за счет спонтанного их созревания.
Методика мегавольтного облучения больных нейробластомой определяется прежде всего локализацией опухолевого процесса, размерами и распространенностью новообразования. Практически большинство нейробластом находится в брюшной и грудной полостях. Это диктует необходимость использования, в основном, двухпольного облучения — двух встречных противолежащих полей.
При опухолях заднего средостения с использованием фотонов или электронов в зону облучения необходимо включать всю опухолевую массу и грудные позвонки на всю их ширину, для предупреждения деформации позвоночника. По достижении верхнего предела лучевой толерантности спинного мозга, необходима его защита. При этом необходимо помнить, что толерантность его меняется с возрастом. Также необходима тщательная защита плечевых суставов. При нейробластомах в настоящее время облучения всей брюшной полости используется редко, так как у больных с III стадией заболевания обычно применяют агрессивную полихимиотерапию.
При облучении тазовой области пристальное внимание уделяется защите тазобедренных суставов. У девочек необходимо, по возможности, выводить из зоны действия прямого пучка ионизирующего излучения яичники путем оперативного их перемещения. Последнее предохраняет ребенка от стерилизации и сохраняет его гормональную функцию.
В последние годы для лечения детей с нейробластомой предлагается использовать внутреннее облучение с помощью метайодобензилгванидина (mJBG), меченого радиоактивным йодом-131, который избирательно накапливается в нейробластоме. Опубликованы первые результаты такого вида лучевой терапии. Было показано, что 50% больных с IV стадией заболевания с химиорезистентной формой опухоли положительно отреагировали на введение mJBG (J -131). Mastrangelo et al.привели данные о 10-месячном ребенке с нейробластомой III стадии, который жив без признаков болезни 18 месяцев после установления диагноза и лечился только с помощью внутреннего облучения.
Некоторые схемы лечения детей с нейробластомой в зависимости от стадии заболевания Стадия I. Выполнение радикального оперативного удаления опухоли бывает достаточным для излечения больного. Тем не менее, эти дети нуждаются в динамическом наблюдении, так как возможны рецидивы заболевания или отдаленные метастазы.
Стадия IIА. При этой стадии нейробластомы излечения больного, так же как и при I стадии, можно достичь с помощью оперативного удаления опухоли.
Два исследования показали, что без признаков рецидива прошло 100% детей как получавших послеоперационное лечение, так и не получавших его (Ninane et al., 1982; Hayes et al., 1983). Исключение составила «гантелеподобная» форма паравертебральной нейробластомы, при которой необходимо проведение адекватного химиолучевого лечения.
Стадия IIВ. При этой стадии заболевания лечение должно начинаться с химиотерапии с последующим оперативным вмешательством. Трудно однозначно сказать, есть ли необходимость ее применения у детей до 6 месяцев, так как течение заболевания в этом возрасте достоверно благоприятно.
Стадия III (опухоль нерезектабельна) и стадия IV. Лечение детей с этими стадиями заболевания весьма трудная задача и решается, в основном, исходя из опыта конкретного специализированного отделения детской онкологии. Однако можно указать на два основных принципа к подходу терапии: 1. Необходима агрессивная тактика хирургического лечения при III стадии заболевания. 2. Дети с IV стадией в возрасте старше 1 года нуждаются в интенсивной высокодозной химиотерапии с пересадкой костного мозга.
Стадия IVa. В основном, при этой стадии заболевания проводится химиотерапия (несколько курсов циклофосфамида и винкристина), до и после оперативного вмешательства, выполняемого для удаления первичной опухоли.
Пример блоков полихимиотерапии, используемых в современных протоколах
PFV/VDIA (GPO, Германия, NB-90) PEV — Цисплатин по 40 мг/м2 в 1 — 4-й день VP-16 по 125 мг/м2 в 1 — 4-й день Виндезин по 3 мг/м2 в 1-й день. VDIA — Винкристин по 1,5 мг/м2 в 1-й и 8-й день DTIC — по 200 мг/м2 в 1 — 5-й день Ифосфамид по 1,5 г/м2 в 1 — 5-й день Доксорубицин по 30 мг/м2 в 6-й, 7-й день. Интервал 3 недели.
OPEC/OJEC (UKCCSG, Великобритания) ОРЕС — Винкристин по 1,5 мг/м2 в 1-й день Цисплатин по 80 мг/м2 в 1-й день (инфузия 24 ч) Циклофосфан по 600 мг/м2 в 1-й день VP-16 по 200 мг/м2 во 2-й день (инфузия 4 ч) В OJEC цисплатин заменяется на карбоплатин по 500 мг/м2
CAV-Pt (протокол N 3891, CCG, США) Цисплатин по 60 мг/м2 в 1-й день, VP-16 по 100 мг/м2 в 3-й, 6-й день. Циклофосфан по 900 мг/м2 в 4-й, 5-й день Доксорубицин по 30 мг/м2 в 3-й день. Интервал 3 нед
Прогностичекие факторы Эти факторы получены в результате выявления достоверной связи между продолжительностью жизни больных после лечения с возрастом, стадией и биологическими параметрами опухоли. Используя многофакторный анализ, Evans et al. (1987) определили, что комбинация таких признаков, как возраст, стадия, уровень сывороточного ферритина и морфологического строения нейробластом, позволяет выделить три группы детей с различным прогнозом: — благоприятную, в которой более 80% больных живут более 2-х лет; — промежуточную; — неблагоприятную, в которой только около 20% детей наблюдаются 2 года.
Возраст при установлении заболевания является единственным важным прогностическим фактором. Так, у детей до 1 года течение заболевания всегда благоприятно. Далее, значимыми признаками, влияющими на прогноз, являются стадия и первичная локализация нейробластомы.
Прогноз у больных со стадией I и IVS, определенной согласно международной классификации INSS, значительно более благоприятный по сравнению с детьми, имеющими другие стадии заболевания. Так, при I и IVS стадиях нейробластомы более 5 лет живут, соответственно, 90% и более 80% детей после лечения, в то время как при стадиях IIA и В, III и IV этот показатель равняется 70-80%, 40-70% и 60% — в возрасте до 1 года, 20% — в возрасте более 1 года и 10% — в возрасте 2 и более лет.
При этом хотелось бы отметить, что 80% детей поступают в специализированную клинику на III-IV стадиях заболевания.
Ретроперитонеальная и, в частности, нейробластома надпочечника имеет худший прогноз, а опухоль, локализующаяся в средостении — наилучший по сравнению с другими локализациями новообразования. Морфологические признаки дифференциации в первичной опухоли являются прогностически благоприятным фактором, так же как и бластомы гипердиплоидного типа.