Автор: Созинова А.В., акушер-гинеколог, ведет непрерывную практику с 2001 года.
Водянкой плода называется его патологическое состояние, при котором во всех полостях организма скапливается жидкость и присутствует генерализованный отек (отеки всего тела — анасарка).
В большинстве случаев водянка плода наблюдается при резус-конфликтной беременности и гемолитической болезни новорожденного. Распространенность данного состояния составляет 1 случай на 1000-14000 родов. Различают иммунную и неиммунную водянку плода.
Причины
Основной причиной развития иммунной водянки плода служит его гемолитическая болезнь.
Причина, которая привела к развитию неиммунной водянки плода зачастую остается нераспознанной, но выделяют следующие факторы:
- хромосомная патология плода (синдром Дауна, мозаицизм, трисомии, синдром Шерешевского-Тернера и прочие);
- генные заболевания: недостаток глюкозо-6-фосфатдегидрогеназы, А-талассемия, синдром Нунан, ахондрогенез, танатофорная карликовость, синдром Пена-Шокея, синдром множественных птеригиумов, ахондроплазия;
- пороки развития грудной полости (дисплазия грудной клетки, диафрагмальная грыжа, порок легкого кистозный аденоматозный);
- пороки развития мочевыделительной системы (врожденный нефротический синдром, пороки уретры и почек);
- сердечно-сосудистая патология (кардиомиопатия, врожденные пороки сердца, анатомические дефекты, артериально-венозные шунты)
- хориоангиома плаценты;
- при многоплодной беременности (фето-фетальная трансфузия, акардиальная двойня);
- инфекционные заболевания матери во время беременности (цитомегаловирусная инфекция, сифилис, парвовирусная инфекция, токсоплазмоз, вирусный панкардит Коксаки);
- осложнения беременности (преэклампсия, тяжелая анемия, нескоррегированный сахарный диабет, гипопротеинемия);
- врожденные обменные нарушения (мукополисахаридоз 4 типа, болезнь Гоше, дефицит нейраминидазы, болезнь Моркио);
- врожденные опухоли головного и спинного мозга, мочевыделительной системы и пищеварительного тракта, печени, крестцово-копчиковая тератома, нейробластома.
Диагностика
Диагностика водянки плода направлена на установление причины, его вызвавшей. В первую очередь определяется группа крови и резус-фактор для подтверждения/исключения резус-конфликта и иммунной водянки плода.
Проводится анализ анамнеза жизни (инфекционные болезни в прошлом, операции, хроническая патология), акушерско-гинекологического анамнеза (наличие гинекологических патологий, течение и исходы предшествующих беременностей), анализируется течение настоящей беременности, ее осложнения, общая прибавка веса и прочее.
Главным диагностическим методом служит УЗИ плода. К УЗИ-признакам относятся:
- отечность плаценты («толстая плацента»);
- избыток амниотической жидкости (многоводие);
- размеры плода больше нормы из-за отека (в частности увеличенные размеры живота вследствие асцита по сравнению с размерами головки);
- скопление жидкости во всех полостях плодового организма (гидроперикард, асцит, гидроторакс)
- отек подкожно-жирового слоя в виде двойного контура;
- отек кожи головы, рук и ног;
- кардиомегалия (увеличение размеров сердца);
- утолщение кишечника (отек стенок);
- увеличение печени и селезенки (гепатоспленомегалия)
- «поза Будды» — раздутый живот с отведенными от него конечностями и позвоночником;
- низкая двигательная активность в сочетании с другими признаками.
После проведения УЗИ назначается амнио- или кордоцентез для определения кариотипа плода, получения крови плода (оценка гемоглобина, белка) и возможного внутриутробного лечения. С целью исключения внутриутробной инфекции назначается ПЦР на предполагаемые инфекции.
УЗ-диагностика гидроцефалии
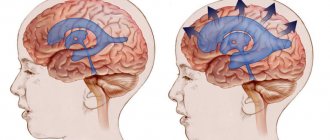
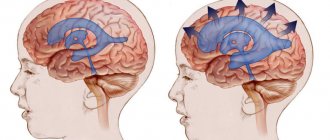
Основной симптом болезни – увеличение размеров головы, вызванное увеличением давления жидкости на мягкие кости младенца. На первом и последующих скринингах видно, что голова плода слишком крупная.
При постановке диагноза врач сравнивает размеры головы плода с нормальными. Для этого измеряются размеры головки:
- Бипариетальный (БПР) – расстояние между висками по линии надбровных дуг;
- Лобно-затылочный (ЛЗР) — расстояние между лбом и затылком.
Увеличение обоих показателей свидетельствует о возможной гидроцефалии. Чем больше они отклоняются от нормы, тем тяжелее патология. Данные таблиц считаются приблизительными, поскольку зависят от размера плода
| Срок в неделях | БПР, мм | ЛЗР, мм |
| 10-11 | 13-17 | – |
| 12-13 | 21-24 | – |
| 14-15 | 27-31 | – |
| 16-17 | 34-38 | 45-50 |
| 18-19 | 42-45 | 54-58 |
| 20-21 | 48-51 | 62-66 |
| 22-23 | 54-58 | 70-74 |
| 24-25 | 61-64 | 78-81 |
| 26-27 | 67-70 | 85-88 |
| 28-29 | 73-76 | 91-94 |
| 30-31 | 78-80 | 97-101 |
| 32-33 | 82-84 | 104-107 |
| 34-35 | 86-88 | 110-112 |
| 36-37 | 90-92 | 114-116 |
| 38-40 | 94-96 | 118-120 |
Поэтому для выявления гидроцефалии гинеколог одновременно измеряет все остальные размеры ребенка. Если они тоже больше нормы, то малыш просто крупный. При водянке мозга развитие плода часто страдает, поэтому его тело и конечности бывают даже меньше, чем нужно.
Замеры позволяют дифференцировать гидроцефалию от врожденного увеличения размера мозговых желудочков. Поскольку повышенного мозгового давления у таких детей нет, размер головы может быть нормальным. Иногда он даже меньше нормы.
При гидроцефалии желудочки переполнены ликвором, поэтому деформированы и увеличены. Размер их боковых стенок, составляющий в норме 7,5 мм, увеличивается до 1 см. Высота желудочков возрастает на 0,2-0,3 мм. Нередко наблюдается неправильное развитие других отделов спинного и головного мозга – большой цистерны и межполушарной щели. На более поздних сроках заметно, что мозговые извилины малыша уплощены, борозды сглажены, неправильно сформированы сосуды и оболочки.
Лечение водянки плода
При выявлении врожденных пороков развития плода, несовместимых с жизнью (1-2 триместр беременности) женщине предлагают прерывание беременности. В случае отказа от прерывания продолжают наблюдать за течением беременности и развитием болезни до сроков, позволяющих проводить пренатальную (дородовую) терапию.
Лечение водянки плода заключается в проведении кордоцентеза и переливания крови в пуповину (в случае выраженной анемии и снижения гематокрита до 30 и ниже). При необходимости заменное переливание крови повторяют через 2-3 недели.
В случае выявления фето-фетальной трансфузии близнецов проводится лазерная коагуляция сосудов, соединяющих плоды. Если нет возможности провести пренатальное лечение, оценивается степень риска преждевременных родов по отношению к антенатальной гибели плода и родоразрешение проводят досрочно с предварительным назначением препаратов для ускорения созревания легких плода. В некоторых случаях показано введение матери сердечных гликозидов для нормализации сердечной деятельности плода.
Перед родоразрешением (оно, как правило, происходит планово) готовятся к рождению ребенка с водянкой. Родильный зал должен быть оснащен аппаратурой для сердечно-легочной реанимации, формируется реанимационная бригада из 2-3 реаниматологов и 2-3 неонатологов (после рождения ребенка сразу интубируют и осуществляют искусственную вентиляцию легких 100% кислородом).
Сразу после рождения и проведения реанимационных мероприятий выполняется перикардиоцентез (удаление путем пункции околосердечной сумки накопившейся жидкости), плевральную пункцию (удаление жидкости из плевральной полости) и лапароцентез (высасывание жидкости из брюшной полости). В пупочную артерию устанавливается катетер для последующих инфузий эритроцитарной массы или крови.
Парвовирусная инфекция В19
В 1975 г. Yvonne Cossart, при исследовании сыворотки доноров в образце № 19 линии В, выявила парвовирус-подобные частицы, получившие название «Parvovirus В19» [1]. Парвовирус В19 (эритровирус В19) — содержит одноцепочечную ДНК, безоболочечный термостабильный вирус, имеющий форму двадцатигранника, диаметр 20–25 нм, принадлежит к роду Erythrovirus, семейству Parvoviridae (рис. 1). Выделяют три генотипа: генотип 1 распространен повсеместно; генотип 2 встречается довольно редко в Европе, Бразилии, Вьетнаме, Северной Америке; генотип 3 преимущественно регистрируется в западной Африке, спорадические случаи зарегистрированы во Франции, Великобритании, Бразилии и Азии; в Южной Африке регистрируются все три генотипа [2–4].
Геном парвовируса В19 кодирует: два капсидных протеина VP1 и VP2; неструктурный протеин NS-1; малые неструктурные протеины 11-Da, 9-Da и 7,5-kDa. Протеин NS-1 является трансактиватором вирусного Р6 промотора экспрессии WAF1/CIP1 гена, продукт которого р21WAF ингибирует циклин-Cdk комплексы, блокируя клеточный цикл в G1-фазу, также NS-1 нарушает функцию E2 F-семейства транскрипциональных факторов, блокируя клеточный цикл в G2/M-фазы, что обеспечивает репликацию вирусной ДНК [5–7]. Протеин VP2 обладает способностью к самосборке вирусного капсида в отсутствии вирусной ДНК, с образованием частиц, сходных по антигенным и иммуногенным свойствам с вирионом [8]. Протеин VP1 содержит подобную фосфолипазе А2 область (VP1 u), отвечающую за инвазию вируса в ядро инфицированной клетки [9]. 11-Da протеин играет важную роль в репликации вирусной ДНК и апоптозе инфицированных клеток [10].
Клеточным рецептором для парвовируса В19 является Р-антиген, расположенный на клетках трофобласта, костного мозга, печени, почек, легких, синовиальной оболочки, эпителии, эндотелии, миоцитах, лимфоидной ткани [11, 12]. Люди, у которых отсутствует Р-антиген (1 на 200 000 человек), не восприимчивы к парвовирусной инфекции [13]. Жизненный цикл парвовируса B19 состоит из следующих этапов: связывание с Р-антигеном; интернализация — проникновение внутрь клетки с помощью a5b1-интегринов; переход в ядро клетки, репликация ДНК; транскрипция, сборка капсида; упаковка генома в капсид, лизис клетки-хозяина и выход вирионов [14]. Основные компоненты клеточного и гуморального иммунного ответа на парвовирус В19 представлены на рис. 2 [15].
Парвовирус В19 широко распространен в популяции людей, более чем 80% взрослого населения являются серопозитивными, частота выявления IgG к парвовирусу у детей первых десяти лет жизни составляет от 2% до 21% (рис. 3). В 25–68% случаев парвовирусная инфекция В19 протекает бессимптомно [16]. Во время беременности к парвовирусной инфекции восприимчивы 1–5% женщин, в период подъема заболеваемости до 3–34%, у 50% женщин парвовирусная инфекция протекает бессимптомно [17, 18]. Максимальный уровень Р-антигена на ворсинах трофобласта регистрируется в первом и втором триместре беременности, что определяет трансплацентарную передачу вируса с развитием спонтанных абортов, неиммунной водянки, внутриутробной гибели плода [19, 20].
Основной путь передачи парвовирусной инфекции В19 — воздушно-капельный, также возможны трансплацентарный, трансфузионный, трансплантационный пути заражения [21–23]. Характерна зимне-весенняя сезонность, с максимальным подъемом заболеваемости в весенние месяцы. Эпидемические подъемы заболеваемости парвовирусной инфекцией наблюдаются каждые 3–6 лет. Инкубационный период в среднем составляет от 4 до 14 дней (максимальный до 21 дня), вирусемия развивается приблизительно через 7 дней после инокуляции вируса и продолжается в течение 4–7 суток [24]. Патофизиологические компоненты парвовирусной инфекции В19 представлены на рис. 4.
Парвовирус В19 ассоциируется с разнообразными заболеваниями, развитие которых сопряжено с особенностями иммунологического и гематологического статуса человека (таблица).
Инфекционная эритема
Инфекционная эритема — наиболее распространенная клиническая форма парвовирусной инфекции В19 у детей. Начинается с неспецифических симптомов — лихорадка, недомогание, озноб, миалгии, которые продолжаются в течение 2–5 суток. Затем присоединяется патогномоничный симптом «отшлепанных» щек — яркая эритема кожи в области щек, а также пятнисто-папулезная сыпь на туловище и конечностях, быстро трансформирующаяся в «кружевную» сыпь, зуд не беспокоит (рис. 5). Экзантема при парвовирусной инфекции может сохраняться до 2–3 недель, разрешается самостоятельно, иногда отмечается усиление сыпи после «горячей» ванны или воздействия УФ-лучей [25].
Пятнисто-папулезная эритема с синдромом «перчаток и носков»
Данная форма парвовирусной инфекции В19 характеризуется: острым началом заболевания с повышения температуры, недомогания, головной боли, снижения аппетита, артралгий; отеком кистей и стоп с одновременным появлением на коже пятнисто-папулезной эритемы, в ряде случаев с геморрагическим компонентом, в виде «перчаток и носков» (рис. 6); в полости рта на слизистой твердого и мягкого неба, языке, губах могут формироваться эрозии [26–28]. Продолжительность заболевания составляет 1–2 недели, разрешаются симптомы самостоятельно.
Синдром полиартропатии
Синдром полиартропатии наблюдается у 75% взрослых с инфекционной эритемой, чаще у женщин средних лет. В процесс вовлекаются пястно-фаланговые, лучезапястные, локтевые, коленные, голеностопные суставы. Обычно наблюдается симметричное поражение суставов. Синдром полиартропатии клинически напоминает ревматоидный артрит, может персистировать в течение 3 месяцев, повторяться несколько раз в течение года [29].
Транзиторный апластический криз
Транзиторный апластический криз развивается при парвовирусной инфекции В19 у пациентов с наследственным микросфероцитозом, серповидно-клеточной и железодефицитной анемией, талассемией. Характеризуется не только парциальной гипоплазией эритроидного ростка, но и развитием тромбоцитопении, нейтропении и даже панцитопении [30, 31].
Поражение ЦНС
Неврологическая манифестация парвовирусной инфекции В19 сопровождается развитием: энцефалита, менингоэнцефалита, судорожного синдрома, периферических невропатий, синдрома запястного канала [32].
Поражение печени
Парвовирус В19 может вызывать острый гепатит, фульминантную печеночную недостаточностью, хронический гепатит, гепатит-ассоциированную апластическую анемию, гепатит с гемофагоцитарным лимфогистиоцитозом [33]. При биопсии печени выявляется гепатоцеллюлярный и каналикулярный холестаз, апоптоз и некроз гепатоцитов [34, 35].
Кардит
Энтеровирусы и аденовирусы до недавнего времени считались основными причинами вирусных кардитов, однако с внедрением метода полимеразной цепной реакции с гибридизационно-флюоресцентной детекцией, при проведении эндомиокардиальной биопсии все чаще стали регистрироваться парвовирус В19 и вирус герпеса 6-го типа [36]. Многочисленные копии вирусного генома парвовируса В19 определяются в эндотелии интрамиокардиальных артериол, капилляров и посткапилярных венул, инициируя синтез фактора некроза опухоли альфа (ФНО-a), интерлейкинов (ИЛ): ИЛ-6, ИЛ-8, ИЛ-2, интерферона гамма (ИФН-g), рецепторов ИЛ-2 [37]. Прямое цитопатическое действие парвовируса, апоптоз, активация врожденного и адаптивного иммунного ответа приводят к эндотелиальной дисфункции с последующим вентрикулярным ремоделированием и развитием дилатационной кардиомиопатии [38–40].
Неиммунная водянка плода
Неиммунная водянка плода может развиваться при поражении парвовирусом В19 плода с гестационным возрастом 13–20 недель. Сопровождается анемией, гипоксией, гепатитом (непосредственное повреждение гепатоцитов вирусом и опосредованное — за счет отложения гемосидерина), кардитом, с формированием печеночной и сердечной недостаточности. При проведении ультразвукового исследования плода выявляется: кардиомегалия, отек грудной клетки, асцит, выпот жидкости в плевральные полости и перикард, отек плаценты [41]. При своевременной диагностике и проведении гемотрансфузии плоду внутриутробно, благоприятный исход возможен в 83% случаев [42].
Врожденная парвовирусная инфекция В19
В первые месяцы жизни ребенка врожденная парвовирусная инфекция манифестирует развитием анемии Даймонда–Блекфена, гидроцефалии, полимикрогирии, кардита, гепатита [43, 44].
Диагностика парвовирусной инфекции В19
Гематологические изменения чаще носят преходящий характер в виде анемии, ретикулоцитопении или полного отсутствия ретикулоцитов, нейтропении, эозинофилии, моноцитоза, тромбоцитопении. Возможно повышение печеночных трансаминаз (аланинаминотрансферазы и аспартатаминотрансферазы), С-реактивного белка, скорости оседания эритроцитов.
Методы диагностики парвовирусной инфекции В19:
- Полимеразная цепная реакция (ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс® Parvovirus B19-FL» (сыворотка, ликвор, пунктат костного мозга, биоптат кожи и т. д.) — определение ДНК парвовируса.
- Иммуноферментный анализ (ИФА) «Parvovirus B19 IgM/Parvovirus B19 IgG» (сыворотка крови) — IgM в сыворотке крови пациента обнаруживаются одновременно с появлением симптомов заболевания (на 12–14 день после заражения), их уровень достигает максимума на 30-й день, затем снижается в течение 2–3 месяцев. Через 5–7 дней от момента клинических проявлений парвовирусной инфекции появляются IgG, которые сохраняются в течение нескольких лет.
- Парвовирус В19 иммуноблот IgM/IgG «RIDA® Blot Parvovirus B19» (сыворотка крови).
- Учитывая способность парвовируса В19 к изоляции в тропных структурах (костный мозг, трофобласты) отрицательный результат ПЦР крови на парвовирус B19 еще не означает отсутствие инфицирования, а должен рассматриваться как возможно ложноотрицательный. Для большей диагностической информативности следует проводить ПЦР различных материалов и в сочетании с иммуноблотом IgM/IgG.
В случае, если у беременной женщины регистрируются симптомы парвовирусной инфекции В19 (инфекционная эритема, артропатии) или она была в контакте с больным данной инфекцией, рекомендовано проведение ПЦР и/или ИФА сыворотки крови. При выявлении IgM к парвовирусу или положительном результате ПЦР необходимо УЗИ плода каждые 2 недели. При наличии УЗ-признаков неиммунной водянки плода показано проведение кордоцентеза или амниоцентеза (ПЦР крови плода или амниотической жидкости на парвовирус В19) [45]. При положительных данных на парвовирус B19 и ультразвуковых признаках поражения плода ставится вопрос о прерывании беременности.
Терапия парвовирусной инфекции В19
В настоящее время специфической этиотропной терапии парвовирусной инфекции не существует. В зависимости от клинической формы парвовирусной инфекции В19 проводится посиндромная терапия (нестероидные противовоспалительные препараты, глюкокортикостероидные препараты, трансфузия эритромассы и т. д.). При поражении нервной системы, кардите, гепатите — внутривенный человеческий иммуноглобулин. Наиболее эффективны препараты иммуноглобулина, полученные от большого числа доноров: Октагам, Интраглобин, Пентаглобин.
Профилактика парвовирусной инфекции В19
Эффективной профилактики парвовирусной инфекции в настоящее время не существует. Ведется разработка безопасной и иммуногенной вакцины против парвовирусной инфекции В19 [46].
Основные меры профилактики направлены на предотвращение внутриутробного инфицирования плода: введение скрининга до планируемой беременности и во время беременности на наличие IgG к парвовирусу В19; информирование серонегативной беременной женщины о существовании парвовирусной инфекции В19, а также о необходимости ограничения контакта с детьми, особенно с типичными проявлениями парвовирусной инфекции [47].
В заключение необходимо отметить, что в нашей стране не ведется статистика заболеваемости парвовирусной инфекцией В19, а также нет точных данных о случаях врожденной парвовирусной инфекции. Наш опыт свидетельствует, что в ряде случаев, при клинических проявлениях врожденной инфекции, парвовирус B19 может ассоциироваться в частности с герпесвирусами, что существенно затрудняет как диагностику, так и лечение данных пациентов. Учитывая это, следует признать рациональным включение обследования на парвовирус В19 новорожденных детей при подозрении на врожденную инфекцию.
Литература
- Cossart Y. E., Field A. M., Cant B. et al. Parvovirus-like particles in human sera // Lancet. 1975; 1: 72–73.
- Servant A., Laperche S., Lallemand F. et al. Genetic diversity within human erythroviruses: identiication of three genotypes // Journal of Virology. 2002; 76 (18): 9124–9134.
- Candotti D., Etiz N., Parsyan A., Allain J.-P. Identification and characterization of persistent human erythrovirus infection in blood donor samples // J Virol. 2004; 78: 12169–12178.
- Corcoran C., Hardie D., Yeats J., Smuts H. Genetic variants of human parvovirus B19 in South Africa: cocirculation of three genotypes and identification of a novel subtype of genotype 1 // J Clin Microbiol. 2010; 48: 137–142.
- Zhi N., Mills I. P., Lu J. et al. Molecular and functional analyses of a human parvovirus B19 infectious clone demonstrates essential roles for NS1, VP1, and the 11-kilodalton protein in virus replication and infectivity // J. Virol. 2006; 80: 5941–5950.
- Nakashima A., Morita E., Saito S., Sugamura K. Human Parvovirus B19 nonstructural protein transactivates the p21/WAF1 through Sp1 // Virology. 2004; 329 (2): 493–504.
- Wan Z., Zhi N., Wong S. et al. Human parvovirus B19 causes cell cycle arrest of human erythroid progenitors via deregulation of the E2 F family of transcription factors // J. Clin. Invest. 2010; 120: 3530–3544.
- Kaufmann B., Chipman P. R., Kostyuchenko V. A. et al. Visualization of the externalized VP2 N termini of infectious human parvovirus B19 // J. Virol. 2008; 82: 7306–7312.
- Zadori Z., Szelei J., Lacoste M. C. et al. A viral phospholipase A2 is required for parvovirus infectivity // Dev. Cell. 2001; 1: 291–302.
- Chen A. Y. et al. The small 11 kDa non-structural protein of human parvovirus B19 plays a key role in inducing apoptosis during B19 virus infection of primary erythroid progenitor cells // Blood. 2010; 115: 1070–1080.
- Brown K. E., Anderson S. M., Young N. S. Erythrocyte P antigen: cellular receptor for B19 parvovirus // Science. 1993; 262: 114–117.
- Cooling L. L., Koerner T. A., Naides S. J. Multiple glycosphingolipids determine the tissue tropism of parvovirus B19 // J Infect Dis. 1995; 172: 1198–1205.
- Brown K. E., Hibbs J. R., Gallinella G. et al. Resistance to parvovirus B19 infection due to lack of virus receptor (erythrocyte P antigen) // NEJM. 1994; 330: 1192–1196.
- Servant-Delmas A., Lefrere J. J., Morinet F. et al. Advances in human B19 erythrovirus biology // J Virol. 2010; 84: 9658–9665.
- Corcoran A., Doyle S. Advances in the biology, diagnosis and host–pathogen interactions of parvovirus B19 // Journal of Medical Microbiology. 2004; 53: 459–475.
- Noyola D. E., Lourdes Padilla-Ruiz M., Guadalupe Obregón-Ramos M. et al. Parvovirus B19 infection in medical students during a hospital outbreak // J Med Microbiol. 2004; 53: 141–146.
- Feldman D. M., Timms D., Borgida A. F. Toxoplasmosis, parvovirus, and cytomegalovirus in pregnancy // Clin Lab Med. 2010; 30 (3): 709–720.
- Tolfvenstam T., Broliden K. Parvovirus B19 infection // Semin Fetal Neonatal Med. 2009; 14 (4): 218–221.
- Jordan J. A., DeLoia J. A. Globoside expression within the human placenta // Placenta. 1999; 20: 103–108.
- Public Health Laboratory Service Working Party on Fifth Disease. Prospective study of human parvovirus infection in pregnancy // Br Med J. 1990; 300: 1166–1170.
- Jordan J., Tiangco B., Kiss J., Koch W. Human parvovirus B19: prevalence of viral DNA in volunteer blood donors and clinical outcomes of transfusion recipients // Vox Sang. 1998; 75: 97–102.
- Cohen B. J., Beard S., Knowles W. A. et al. Chronic anemia due to parvovirus B19 infection in a bone marrow transplant patient after platelet transfusion // Transfusion. 1997; 37: 947–952.
- Lamont R. F., Sobel J., Vaisbuch E. et al. Parvovirus B19 infection in human pregnancy // BJOG. 2011; 118 (2): 175–186.
- Van Beers-Tas M. H., Heidema J. Review: Pathogenesis of parvovirus infections in children // Virol Mycol. 2013; 2 (1): 110.
- Anderson L. J. Role of parvovirus B19 in human disease // Pediatr. Infect. Dis. 1987: 6: 711–718.
- Valentin M. N., Cohen P. J. Pediatric Parvovirus B19: spectrum of clinical manifestations // Cutis. 2013; 92: 179–184.
- Pavlovic M. D. Papular-purpuric «gloves and socks» syndrome caused by parvovirus B19 // Vojnosanit Pregl. 2003; 60 (2): 223–225.
- Heckler G. T., Dal Ri N. M. K., Almeida H. L. Jr. Case for diagnosis // An Bras Dermatol. 2012; 87 (5): 793–794.
- Kumano K. Various clinical symptoms in human parvovirus B19 infection // Japanese Journal of Clinical Immunology. 2008; 31 (6): 448–453.
- Muir K., Todd W. T., Watson W. H., Fitzsimons E. Viral-associated haemophagocytosis with parvovirus-B19-related pancytopenia // Lancet. 1992; 339: 1139–1140.
- Saarinen U. M., Chorba T. L., Tattersall P. et al. Human parvovirus B19-induced epidemic acute red cell aplasia in patients with hereditary hemolytic anemia // Blood. 1986; 67: 1411–1417.
- Douvoyiannis M., Litman N., Goldman D. L. Neurologic manifestations associated with Parvovirus B19 Infection // CID. 2009; 48 (15): 1713–1723.
- Bihari Ch., Rastogi A., Saxena P. et al. Parvovirus B19 associated hepatitis // Hindawi Publishing Corporation // Hepatitis Research and Treatment. 2013; Article ID 472027: 1–9.
- Poole B. D., Karetnyi Y. V., Naides S. J. Parvovirus B19-induced apoptosis of hepatocytes // Journal of virology. 2004; 78 (14): 7775–7783.
- Hatakka A., Klein J., He R. et al. Acute hepatitis as a manifestation of parvovirus B19 infection // Journal of Clinical Microbiology. 2011; 49 (9): 3422–3424.
- Kindermann I., Barth C., Mahfoud F. et al. Update on Myocarditis // Journal of the American College of Cardiology. 2012; 59 (9): 779–792.
- Klingel K., Selinka H.-C., Sauter M. et al. Molecular mechanisms in enterovirus and parvovirus B19 associated myocarditis and inflammatory cardiomyopathy // European Heart Journal. 2002; 4 (1): 108–112.
- Schultheiss H.-P., Kuhl U., Cooper L. T. The management of myocarditis // European Heart Journal. 2011; doi: 10.1093: 1–13.
- Caforio A. L. P., Bottaro S., Iliceto S. Dilated cardiomyopathy (DCM) and myocarditis: classification, clinical and autoimmune features // Applied Cardiopulmonary Pathophysiology. 2012; 16: 82–95.
- Santos Tavares P., Rocon-Albuquerque R., Leite-Moreira A. F. Innate immune receptor activation in viral myocarditis: pathophysiologic implications // Rev Port Cardiol. 2010; 29 (01): 57–78.
- Smith J. Human parvovirus B19: a literature review and case study // Infant. 2008; 4 (5): 101–104.
- Ergaz Z., Ornoy A. Parvovirus B19 in pregnancy // Reproductive Toxicology. 2006; 21: 421–435.
- Giorgio E., Antonietta De Oronzo M., Iozza I. Parvovirus B19 during pregnancy: a review // Journal of Prenatal Medicine. 2010; 4 (4): 63–66.
- Schulert G. S., Walsh W. F., Weitkamp J. H. Polymicrogyria and congenital Parvovirus B19 infection // Am J Perinatol Rep. 2011; 1: 105–110.
- Dieck D., Schild R. L., Hansmann M., Eis-Hubinger A. M. Prenatal diagnosis of congenital parvovirus B19 infections: value of serological and PCR techniques in maternal and fetal serum // Prenatal Diagnosis. 1999; 19: 1119–1123.
- Bernstein D. I., Sahly H., Keitel W. A. et al. Safety and immunogenicity of a candidate Parvovirus B19 vaccine // Vaccine. 2011; 29 (43): 7357–7363.
- Pickering L. K., Baker C. J., Kimberlin D. W. et al. Parvovirus B19. Report of the Committee on Infectious Diseases // American Academy of Pediatrics. 2009: 491–494.
Ю. Б. Белан1, доктор медицинских наук, профессор М. В. Старикович, кандидат медицинских наук
ГБОУ ВПО ОмГМА МЗ РФ, Омск
1 Контактная информация
Прогнозы
Прогноз при неиммунной водянке плода неблагоприятный и процент выживших детей составляет 20-33%. При развитии водянки в первом триместре беременность, как правило, заканчивается спонтанным абортом, во втором и третьем триместрах высок риск антенатальной гибели плода.
При иммунной водянке прогноз более утешительный, эффект от пренатального и постнатального лечения достигает 80-90%.
Некоторые исследования при беременности
- Мазки при беременности
- Анализы при беременности по триместрам
- УЗИ при беременности
- Общий анализ мочи при беременности
- Коагулограмма
- Установка пессария
- Глюкозотолерантный тест
- Гомоцистеин при беременности
- Амниоцентез
- Анестезия в родах
- КТГ плода (кардиотокография)
- Кордоцентез
- Эпидуральная анестезия в родах