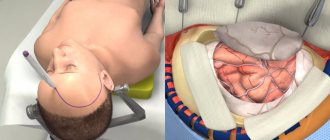
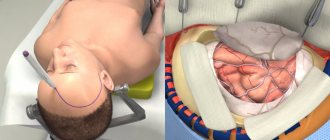
Способы пластики костного дефекта черепа
Костный дефект черепа – это отверстие в нем, которое образуется после нейрохирургического вмешательства на органах центральной нервной системы или вследствие травмы. Поговорим подробнее о дефектах черепа в медицинской практике.
После удаления участка кости и образования отверстия в черепе пациенты переживают не только психологический дискомфорт, но и так называемый «синдром трепанированного черепа». И в том и в другом случае, отверстие нужно закрывать имплантатом. А теперь обо всем подробнее.
Медикаментозный режим
После хирургического лечения на прооперированный глаз накладывают стерильную повязку и специальный пластырь. На следующий день их снимают и приступают к медикаментозной терапии. Сначала смачивают ватный диск в левомицетиновых каплях (0,25%) и протирают им закрытое веко. Открывают глаз и закапывают Левомицетин согласно инструкции и рекомендации офтальмолога.
Классическая терапевтическая схема в послеоперационный период после удаления катаракты включает следующую комбинацию препаратов:
- Антибактериальные капли в комбинации с глюкокортикоидом Дексаметазоном.
Врачи прописывают эти средства для предотвращения возможного инфицирования в послеоперационный период. Они помогают снять воспаление, отечность, красноту, успокоить глаз. Их закапывают по 6 раз в день, через равные временные промежутки. Затем еще 3 недели по 4 раза. Если трудно запомнить схему приема лекарств, можно составить себе памятку.
- Нестероидные противовоспалительные капли.
Эта группа препаратов применяется для снятия болезненных ощущений, для предотвращения развития осложнений после удаления катаракты, например, отечности макулы, устранения воспалительных процессов. Назначаемый курс – месяц. Закапывают их по разным схемам. Диклофенак используют по 4-6 раз в день, а современное фармакологическое средство Броксинак всего 1 раз. НПВС применяют до тех пор, пока иммунная система не справится с так называемым стерильным асептическим воспалением.
- Гели и увлажняющие капли.
Гели необходимы для ускорения заживления роговицы. При неприятных ощущениях в глазу (чувство инородного тела) рекомендуются увлажняющие капли.
Восстановительный период у разных людей длится по-разному. Это зависит от возраста, состояния иммунитета, наличия хронических заболеваний, ослабляющих организм и затормаживающих выздоровление.
РЕКОМЕНДАЦИЯ! Главное, что нельзя делать после удаления катаракты глаз, – пренебрегать рекомендациями лечащего врача. Самостоятельно менять схему использования лечебных капель и количество закапываемых препаратов менять запрещается. Между первой и следующей инстилляцией должно пройти не менее 15 минут.
Последствия дефектов черепа
Кости черепа не только защищают головной мозг от механического повреждения. Отсутствие одного участка может вызывать у пациента массу неприятных симптомов или осложнений. Именно их наличие служит прямым показанием к хирургической пластике.
Это может быть:
- Головная боль. Она возникает не только в месте дефекта, но захватывать другие участки. Чаще всего симптом усиливается или возникает при смене показателей атмосферного давления и температуры воздуха. Появляется, так называемая, метеочувствительность.
- «Астено-невротический синдром». Сюда входят жалобы на рассеянность, снижение концентрации внимания, трудности в решении интеллектуальных задач, частая смена настроения, снижение способности противостоять стрессам и толерантности к алкоголю.
- Выпячивание содержимого черепа наружу. При кашле или чиханьи, физическом напряжении или нагрузках, часть вещества мозга может выпячиваться через отверстие в черепе, под кожу. Это приводит к травматизации внутренних тканей о края костного дефекта.
- Симптоматическая эпилепсия.
- Расстройства психики.
NSICU.RU neurosurgical intensive care unit сайт отделения реанимации НИИ им Н.Н. Бурденко
После удаления опухолей головного мозга может развиваться отек-набухание мозга иувеличиваться внутричерепное давление (ВЧД). Одной из вероятных и наименее изученныхпричин этого является нарушение венозного оттока. Тяжесть клинических проявлений иисходы венозной дисциркуляции значительно варьируют от головной боли и тошноты докоматозного состояния и летального исхода [14,17,22,26]. Вариабельность клиническойкартины определяется количеством сегментов венозной системы, в которых происходитнарушение оттока. Это было показано в эксперименте Fries G с соавторами [14], когдасвиньям последовательно производили окклюзию верхнего сагиттального синуса, мостиковыхи корковых вен, оценивая при этом клиническое состояние животных, измеряя ВЧД исодержание воды в ткани мозга. Было установлено, что выраженный отек мозга,внутричерепная гипертензия (ВЧГ), разрушение гематоэнцефалического барьера, а затем иартериальная гипоперфузия, приводящая к инфаркту мозга, развивалась только приодновременной окклюзии синуса, мостиковых и корковых вен, когда прекращался иретроградный, и коллатеральный венозный кровоток [1,14]. В то же время установлено, чтонаиболее выраженный неврологический дефицит возникает при нарушении оттока крови поглубоким и парасагиттальным венам или при заинтересованности большого количества венсильвиевой группы [24].
Общепринятых протоколов коррекции ВЧГ, развившейся вследствие нарушения венозногооттока, на сегодня нет. Мы приводим клиническое наблюдение пациентки с менингиомойкрыла основной кости, у которой в раннем послеоперационном периоде остро развилосьнарушение венозного оттока и устойчивая ВЧГ.
Клиническое наблюдение.
Больная Ч., 47 лет, поступила в Институт с диагнозом «Опухольоснования средней черепной ямки слева». При поступлении выявлялось снижение остротызрения слева — счет пальцев в носовой части поля зрения, левосторонний экзофтальм ипризнаки воздействия на левый глазодвигательный нерв. При МРТ исследовании головногомозга выявлена менингиома основания средней черепной ямки слева (Рисунок 1).
Была выполнена операция – субтотальное удаление менингиомы медиальных отделов основаниясредней черепной ямки слева птериональным доступом. Кавернозный синус былинфильтрирован опухолью. Эта часть опухоли не удалялась. Интраоперационно быликоагулированы две враставшие в капсулу опухоли крупные вены сильвиевой группы.
Кровопотеря не превысила 700 мл и была адекватно восполнена.
Пробуждение из наркозного сна было в обычные сроки. Нарастания общемозговой и очаговойневрологической симптоматики по сравнению с дооперационным уровнем не отмечалось.
Пациентка экстубирована через 2 часа после операции. Гемодинамика была стабильной.
Гомеостатические показатели были в пределах нормы.
Состояние резко ухудшилось через 12 часов после операции. Развилось коматозноесостояние и правосторонний гемипарез (3 – 4 балла). В связи с дыхательнойнедостаточностью больная была интубирована, начата ИВЛ в режиме SIMV+PS. ПриКТ-исследовании головного мозга был выявлен преимущественно левополушарный отек,массивный очаг пониженной плотности, располагавшийся в лобно-теменно-височной областислева, отмечено смещение срединных структур слева направо на 9 мм. Базальные цистерныне визуализировались, желудочковая система была компремирована (Рис. 2). Притранскраниальной допплерографии линейная скорость кровотока была в пределах нормы. Установлен субдуральный/паренхиматозный датчик ВЧД (Codman, USA). Выявлена выраженнаяВЧГ (ВЧД 35 – 45 мм.рт.ст.).
Для коррекции ВЧГ использовались опции протокола лечения пациентов с черепно-мозговойтравмой, поскольку общепринятых протоколов коррекции ВЧГ при нарушении венозного оттоканет. Головной конец кровати был приподнят на 30º. Начата умеренная гипервентиляция,седация пропофолом (45 мкг/кг/мин), аналгезия фентанилом (0,02 мкг/кг/мин) имиорелаксация пипекуронием (0,5 мкг/кг/мин). Эти мероприятия были неэффективны – ВЧД оставалось на уровне 30 – 35 мм.рт.ст. через 20 минут после начала терапии. После этогобыла использована осмотерапия маннитолом (до 1,5 г/кг). ВЧД через 10 минут снизилось до20 – 25 мм.рт.ст., однако, через 30 мин вновь развилась выраженная ВЧГ (до 40мм.рт.ст.). Повторная инфузия маннитола оказалась неэффективной.
Было принято решение о проведении умеренной гипотермии. Индукция гипотермии началасьспустя час после ухудшения состояния. Использовалось наружное охлаждение и внутривенноевведение охлажденного физиологического раствора в дозе 20 мл/кг. Температура 33º С быладостигнута через два часа после индукции. ВЧД эффективно стабилизировалось на уровне 10– 12 мм.рт.ст. При гипотермии развились гипокалиемия (3,1 – 3,3 ммоль/л) игипомагниемия (0,39 – 0,41 ммоль/л), которые были эффективно корригированы применениемпрепаратов калия и магния. В качестве профилактики развития гипокоагуляции, учитываяранний послеоперационный период и эффекты гипотермии, проводилась плазмотрансфузия вдозе 15 мл/кг. При этом протромбиновый индекс был в пределах 75 – 85%, активированноечастично тромбопластиновое время – 28 – 33 секунды, фибриноген – 3,4 – 3,9 г/л.
Температура тела 33ºС поддерживалась в течение 24 часов. Перед началом согревания быловыполнено контрольное КТ-исследование головного мозга, выявившее положительную динамикув виде появления базальных цистерн и уменьшения смещения срединных структур вправо до 5мм. Однако сохранялся отек мозга и очаг пониженной плотности в левом полушарии (Рис 3).
При достижении 35ºС (через 10 часов после начала согревания) появилась отчетливаятенденция к ВЧГ, поэтому темп согревания был снижен до ≈ 0,05 градуса в час. Внеседации больная выполняла простые инструкции, правосторонний гемипарез регрессировал.
Таким образом, уже на этом этапе были выявлены положительные эффекты гипотермии в видерегресса общемозговой и очаговой неврологической симптоматики.
Температура 36ºС была достигнута через 20 часов. При этой температуре развилась ВЧГ до30 мм.рт.ст., резистентная к седации и осмотерапии маннитолом. Это явилось показаниемдля выполнения наружной декомпрессивной трепанации с пластикой твердой мозговойоболочки. Из протокола операции следует, что, несмотря на напряжение твердой мозговойоболочки, выявленное после удаления костного лоскута, мозг пульсировал, а при егокасании не был раним. Вероятно, это было связано с предшествующим лечением, вчастности, — с церебропротективными эффектами гипотермии. После рассечения твердоймозговой оболочки и расширения костного дефекта напряжение мозгового веществазначительно уменьшилось, что позволило выполнить пластику твердой мозговой оболочки безтехнических затруднений. Декомпрессия и пластика твердой мозговой оболочки позволилиэффективно стабилизировать ВЧД на уровне 10 – 15 мм.рт.ст.
Седация продолжалась еще в течение 2 суток после выполнения наружной декомпрессии, амониторинг ВЧД – в течение 5 суток. В течение этого периода эпизодов внутричерепнойгипертензии не было. При КТ-исследовании была выявлена положительная динамика (Рисунок4). Больная была в сознании, но дезориентирована в месте, времени, личной ситуации.
Движения выявлялись во всех конечностях, без отчетливой ассиметрии. ИВЛ прекращеначерез 6 суток после декомпрессивной трепанации, а еще через 5 суток больная переведенаиз реанимации в нейрохирургическое отделение.
Спустя 1,5 месяца состояние пациентки было стабильным. Выявлялся корсаковский синдром.
Речевых и двигательных нарушений не было. Было выполнено МРТ-исследование головногомозга с венографией, и в режиме диффузии (Рис 5), при котором выявлено отсутствиекровотока по поперечному и сигмовидному синуса слева. Кроме этого, диагностированобширный очаг церебромаляции лобно-височной области базальной локализации слева,который визуализировался и при КТ-исследовании в остром периоде, как очаг пониженнойплотности.
Анализ клинической симптоматики, данных КТ и МРТ-исследований головного мозга позволяетпредположить, что причиной формирования этого очага является остро возникшее нарушениевенозного оттока. Кроме этого, был визуализирован ишемический очаг в затылочной областислева, который имеет конусовидную форму и располагается в проекции бассейна заднеймозговой артерии. Наиболее вероятная причина формирования этого очага — компрессиязадней мозговой артерии о намет мозжечка при отеке и дислокации мозга в остром периодезаболевания.
Через 2,5 месяца у больной развилась гидроцефалия, которая явилась показанием длявыполнения люмбоперитонеального шунтирования. Через 4 месяца больная выписана изИнститута в стабильном состоянии. Больная могла обслуживать себя самостоятельно.
Выраженность корсаковского синдрома уменьшилась. Через 6 месяцев после выпискипланируется повторная госпитализация пациентки для выполнения пластики костногодефекта. Дифференциальный диагноз при ухудшении состояния пациентки проводился междуартериальной ишемией и нарушением венозного оттока. Для нарушения венозного характерно:- отсутствие пробуждения из наркозного сна или ухудшение состояния через несколькочасов после операции [17];- при КТ-исследовании возможна визуализация очага пониженной плотности в первые суткипосле операции вследствие гидростатического отека [2];- интраоперационные данные о повреждении вен или синусов;- скорость кровотока при транскраниальной допплерографии остается нормальной илиснижается [4,29,30,33].- при МРТ-венографии выявляются измененные параметры [2]. Однако выполнение МРТ-исследования в остром периоде при наличии выраженной ВЧГ чревато развитием жизненноугрожающих осложнений.
Итак, дифференциальная диагностика позволила заподозрить у пациентки наличие нарушениявенозного оттока. Патогенез развившегося состояния можно представить следующим образом.
Интраоперационная окклюзия вен сильвиевой группы, включенных в опухоль, привела клокальной венозной дисциркуляции. Отсутствие кровотока по поперечному, сигмовидномусинусу (возможно, врожденное) и кавернозному синусу (инфильтрация опухолью)ограничивало компенсаторные возможности коллатерального перераспределения венозногооттока. Это привело к постепенному, в течение 10 – 12 часов после операции, наростаниюотека мозга, что, в свою очередь, вызвало дисциркуляцию в системе глубоких вен мозга.
Это явилось причиной острого ухудшения через 12 часов после операции с развитиемкоматозного состояния, вследствие выраженного отека мозга и его дислокации.
В настоящий момент отсутствует протокол коррекции ВЧГ при нарушении венозного оттока.
Применение рекомендаций интенсивной терапии для коррекции ВЧГ у больных с опухолямимозга, ЧМТ и ОНМК, в нашем наблюдении было неэффективным. Глюкокортикостероидныегормоны для интенсивной терапии отека мозга, вызванной нарушением венозного оттока неиспользуются [17,26]. Приподнимание головного конца кровати, седация, аналгезия,миорелаксация, умеренная гипервентиляция и осмотерапия были неэффективны — сохраняласьВЧГ.
При неэффективности перечисленных опций для снижения ВЧД показано применениеагрессивных методов: барбитуровая кома, наружная декомпрессия или умеренная гипотермия.
Барбитураты не использовались, поскольку, из отчетов организации «Кохрановскоесотрудничество», специализирующейся на систематизации и анализе результатовисследований с использованием принципов доказательной медицины, следует, что: «нетдоказательств того, что терапия барбитуратами у пациентов с тяжелой черепно-мозговойтравмой улучшает исходы. Барбитураты вызывают артериальную гипотензию у каждогочетвертого пациента. Гипотензивный эффект барбитуратов будет нивелировать положительноевлияние снижения ВЧД на церебральное перфузионное давление…» [28].
Наружная декомпрессивная трепанация не была использована на этом этапе, поскольку, поданным Greenberg M.S, при нарушении венозного оттока вследствие венозных тромбозов онаприводит к снижению ВЧД, но не улучшает исходов заболевания [17]. При наружнойдекомпрессии изменяются интракраниальные соотношения, меняется ликвородинамика,повышается риск кровоизлияния в остатки опухоли или очаг ишемии при его наличии.
Известно, что при выраженном отеке мозга после декомпрессии может развиваться ущемлениеткани мозга в костном дефекте с развитием ишемии и вторичным нарушением венозногооттока на этом участке [11,27].
Умеренная гипотермия (32 — 34ºС) является эффективным методом контроля над ВЧД[5,7,18], и обладает церебропротективным эффектом. Механизм церебропротекциизаключается в снижении уровня метаболизма [6,9], уменьшении проницаемостигематоэнцефалического барьера [13], уменьшении концентрации возбуждающих аминокислот ипровоспалительных интерлейкинов в поврежденных тканях мозга [3,15], уменьшенииперекисного окисления липидов [19]. Известно, что в экспериментальных и клиническихусловиях умеренная гипотермия достоверно снижает ВЧД, уменьшает зону ишемическогоповреждения мозга и может улучшить исходы при большом спектре патологии центральнойнервной системы: ЧМТ, ОНМК, отек мозга после остановки сердечной деятельности[10,16,20,23,25,31,32].
В приведенном наблюдении гипотермия во время ее проведения, во-первых, эффективностабилизировала ВЧД, во-вторых, позволила защитить мозг от ишемии. В отличие отартериальной ишемии, развивающейся, например, вследствие клипирования артерии, принарушении венозного оттока ишемия развивается позднее. Вначале появляется выраженныйгидростатический отек мозга. Именно этим манифестировало ухудшение состояния вприведенном наблюдении. Если коллатеральный или ретроградный венозный кровотокневозможен, то остро развивается несовместимый с жизнью отек мозга. При сохранностиколлатерального или ретроградного венозного кровотока, когда возможно егокомпенсаторное перераспределение, выраженность отека будет значительно варьировать[14]. При сохраняющемся нарушении оттока будут формироваться участки мозга, к которымне будет поступать адекватный объем артериальной крови. Вследствие этого разовьетсяишемия. Итак, при венозном инфаркте вначале развивается гидростатический отек, а затем– ишемия и ишемический отек. При артериальном инфаркте вначале развивается ишемия, азатем – отек. Поскольку в приведенном наблюдении при достижении нормотермии был регрессправостороннего гемипареза и восстановление сознания, а в дальнейшем не былодвигательных нарушений, то гипотермия, вероятно, имела церебропротективный эффект. Кроме этого, проведенная гипотермия обеспечила адекватные условия для выполнения впоследующем наружной декомпрессии.
Гипотермия является агрессивным методом коррекции ВЧГ. Наиболее часто описываемыми влитературе осложнениями являются гипокоагуляция [8,35], водно-электролитные нарушения[21], гемодинамические расстройства [12,34] и инфекционно-воспалительные осложнения[8,34]. Наиболее грозными проявлениями гипокоагуляции являются интракраниальныекровоизлияния. Это обусловило профилактическое использование свежезамороженной плазмы вприведенном наблюдении. Водно-электролитные нарушения при гипотермии проявляютсягипокалиемией и гипомагниемией [21]. Гемодинамические расстройства проявляются обычносинусовой брадикардией. Описаны более опасные нарушения ритма – асистолия и фибрилляцияжелудочков, однако, они развиваются или при температуре менее 28ºС или при длительностигипотермии более 48 часов [8,12,34]. Развившиеся в приведенном наблюдении гипокалиемия,гипомагниемия и гемодинамически незначимая брадикардия не угрожали витальным функциям ибыли корригированы незамедлительно при их развитии. Таким образом, умеренная гипотермияпоказала себя относительно безопасным методом контроля над ВЧД.
Период согревания является важным этапом в проведении гипотермии. В нашем наблюдениипри согревании появилась тенденция к повышению ВЧД. Это согласуется с данными рядаавторов. Так, Schwab S с соавторами показали, что согревание – это период высокогориска развития повторной и устойчивой ВЧГ, которая может приводить к летальному исходу[31,32]. Авторы доказали, что продолжительность согревания, превышающая 16 часов,достоверно уменьшает летальность. Поэтому скорость согревания в нашем наблюдениисоставила ≈ 0,05º в час. Не смотря на это, постепенно развилась устойчивая ВЧГ, чтостало показанием к выполнению наружной декомпрессивной трепанации с пластикой твердоймозговой оболочки. Выбранная тактика позволила не допустить усиления дислокации мозга исохранить структурность паренхимы мозга к моменту декомпрессии.
Данные литературы и наше наблюдение свидетельствуют о том, что гипотермия за счетсвоего церебропротективного эффекта, позволяет уменьшить зону уже сформировавшегосяишемического очага и не допустить дальнейшего ишемического повреждения. Однако в периодсогревания сохраняется риск развития повторной резистентной ВЧГ. В этих условияхнеобходимо выполнять наружную декомпрессию с пластикой твердой мозговой оболочки.
Гипотермия в этом случае будет создавать более благоприятные условия для выполненияоперации.
В заключение необходимо сказать, что у пациентов с опухолями базальной локализации враннем послеоперационном периоде возможно развитие отека мозга вследствие нарушениявенозного оттока. При этом стремительно развивается устойчивая ВЧГ. Дифференцироватьнарушение венозного оттока от других возможных причин развития отека мозга в остромпериоде достаточно сложно. Однако это состояние всегда необходимо рассматривать вкачестве возможной причины развития устойчивой ВЧГ. Умеренная гипотермия являетсяэффективным и безопасным методом коррекции отека мозга и ВЧГ при нарушении венозногооттока. Внутричерепная гипертензия, развившаяся на этапе согревания, являетсяпоказанием к выполнению наружной декомпрессии. И, конечно, необходимы дальнейшиеисследования в этом интересном и перспективном направлении.
Литература
- Беков Д.Б., Михайлов С.С. «Атлас артерий и вен головного мозга человека», М. Медицина, 1979, стр. 95-96.
- Корниенко В.Н., Пронин И.Н. Диагностическая нейрорадиалогия. М. Издательство Андреева Т.М., 1368 стр. 2007.
- Aibiki M, Maekawa S, Ogura S, et al: Effects of moderate hypothermia on systemic and internal jugular plasma IL-6 levels after traumatic brain injury in humans. J Neurotrauma 1999; 16:225-232.
- Alexandrov A, Joseph M: Transcranial Doppler: An Overview of its Clinical Applications. The Internet Journal of Emergency and Intensive Care Medicine 2000; Vol. 4, №1 (ISSN: 1092–4051).
- Bayir H, Clark RSB, Kochanek PM Promising strategies to minimize secondary brain injury after head trauma. Crit Care Med 2003; 31:S112-S117.
- Berntman L, Welsh FA, Harp JR: Cerebral protective effect of low-grate hypothermia. Anesthesiology 1981; 55:495-498.
- Bernard SA, Buist M Induced hypothermia in critical care medicine: A review. Crit Care Med 2003; 31:2041-2051.
- Bernard SA. Therapeutic hypothermia after cardiac arrest: Now a standard of care. Crit Care Med 2006; Vol. 34 P 923-924.
- Chopp M, Knight R, Tidwell CD, et al: The metabolic effects of mild hypothermia on global cerebral ischemia and recalculation in the cat: Comparison to normothermia and hyperthermia. J Cereb Blood Flow Metab 1989; 9:141-148.
- Colbourne F, Sutherland G, Gorbett D: Postischemic hypothermia: A critical appraisal with implications for clinical treatment. Mol Neurobiol 1997; 14:171-201.
- Csokay A, Pataki G, Nagy L, Belan K. Vascular tunnel construction in the treatment of severe brain swelling caused by trauma and SAH. (Evidence based on intra-operative blood flow measure). Neurological research 2002; 24:157-160.
- Danzl DF, Pozos RS: Accidental hypothermia. N Engl J Med 1994; 331:1756-1760.
- Dietrich WD, Busto R, Halley M, et al: The importance of brain temperature in alterations of the blood-brain barrier following cerebral ischemia. J Neuropathol Exp Neurol 1990; 49:486-497.
- Fries G, Wallenfang T, Hennen J, et al Occlusion of pig superior sagittal sinus, bridging and cortical veins: multistep evolution of sinus-vein thrombosis. J. Neurosurg. 1992; 77:127-133.
- Globus MY, Alonso O, Dietrich WD, et al: Glutamate release and free radical production following brain injury: Effects of posttraumatic hypothermia. J Neurochem 1995; 65:1704-1711.
- Goto Y, Kassell NF, Hiramatsu K, et al: Effects of intraischemic hypothermia on cerebral damage in a model of reversible focal ischemia. Neurosurgery 1993; 32:980-984.
- Greenberg MS. Handbook of neurosurgery. pp 609,611,891. Thieme, 2001.
- Hofmeijer J, van der Worp H, Kappelle LJ Treatment of space-occuring cerebral infarction. Crit Care Med 2003; 31:617-625.
- Karibe H, Chen SF, Zarow GJ, et al: Mild intraischemic hypothermia suppress consumption of endogenous antioxidants after temporary focal ischemia in rats. Brain Res 1994; 649:12-18.
- Kawai N, Okauchi M, Morisaki K, et al: Effects of delayed intraischemic and postischemic on a focal model of transient cerebral ischemia in rats. Strake 2000; 31:232-239.
- Koht A, Cane R, Cerullo LJ: Serum potassium levels during prolonged hypothermia. Int Care Med 1983; 9:275 – 277.
- Kurita H, Shin M, Ueki K, Kawamoto S, Kirino T. Congestive brain oedema associated with a pial arteriovenous malformation with impaired venous drainage. Acta Neurochir. 2001; 143:339-342.
- Maier CM, Sun GH, Kunis D, et al: Delayed induction and long-term effects of mild hypothermia in a focal model of transient cerebral ischemia: Neurological outcome and infarct size. J Neurosurg. 2001; 94:90-96.
- McElveen WA, Gonzales RF, Keegan A.P: Cerebral venous thrombosis. E-medicine (https://www.emedicine.com/neuro/topic642.htm), 2006.
- Nolan JP, Morley PT, Hoek TL, et al: Therapeutic hypothermia after cardiac arrest. An advisory statement by the Advancement Life support Task Force of the International Liaison Committee on Resuscitation. Resuscitation 2003; 57:231-235.
- Park JH, Yoon SH New concept of cerebrospinal fluid dynamics in cerebral venous sinus thombosis. Medical Hypotheses 2007, article in press.
- Polin RS, Shaffrey ME, Bogaev CA. Decompressive bifrontal craniectomy in the treatment of severe post-traumatic cerebral edema. Neurosurgery 1997; 41:84-92.
- Roberts I. Barbiturates for acute traumatic brain injury. Cochrane Database of Systematic Reviews 2005(2):CD000033.
- Saqqur M, Zygun D, Demchuk A: Role of transcranial Doppler in neurocritical care. Crit Care Med 2007; 35(5) Suppl May: S216-S223.
- Schreiber SJ, Stolz E, Valdueza JM: Transcranial ultrasonography of cerebral veins and sinuses. Eur J Ultrasound 2002 Nov; 16(1-2): 59-72.
- Schwab S, Georgiadis D, Berrouschot J, et al: Feasibility and safety of moderate hypothermia after massive hemispheric infarction. Stroke 2001; 32:2033-2035.
- Schwab S, Schwarz S, Spranger M, et al: Moderate hypothermia in the treatment of patients with severe middle cerebral artery infarction. Stroke 1998; 29:2461-2466.
- Stolz E, Kaps M, Kern A, et al.: Transcranial color-coded duplex sonography ofintracranial veins and sinuses in adults. Reference data from 130 volunteers. Stroke 1999 May;30(5): 1070 – 1075.
- The hypothermia after cardiac arrest study group: mild therapeutic hypothermia to improve the neurological outcome after cardiac arrest. New Engl J Med 2002; 346:549-556.
- Valeri CR, MacGregor H, Cassidy G, et al: Effects of temperature on bleeding time and clotting time in normal male and female volunteers. Crit Care Med 1995; 23:698-704.
Краниопластика
Именно так называется операция по восстановлению герметичности черепа. Она призвана восстановить защиту головного мозга от внешних воздействий, нормализовать кровоток и лимфоток, устранить вышеперечисленные симптомы, косметический дефект и снять психологический дискомфорт.
Суть процедуры – закрыть отверстие в черепе имплантатом. Разобраться в великом множестве предлагаемых сегодня медициной имплантатов и выбрать лучший поможет грамотный нейрохирург. Заполните заявку на сайте или позвоните нам для получения консультации ведущего специалиста для правильного выбора имплантата и обсуждения особенностей предстоящей операции.
Мы же расскажем, какие бывают имплантаты для краниопластики и как проводится операция по их установке.
Осложнения после операции
Хирургические манипуляции на головном мозге всегда сопряжены с высоким риском послеоперационных осложнений. Осложнения могут возникнуть как во время, так и после проведения операции.
Инфекционные
При соблюдении правил асептики во время манипуляций инфекционные осложнения сведены к минимуму. Их риск повышается при черепно-мозговых травмах с загрязнением раневой поверхности. Риск развития воспалительных процессов во внутренних органах увеличивается при нарушении подвижности после операции, в случае застойных процессов. Для снижения риска инфицирования после трепанации проводят антибиотикотерапию, назначают лечебную гимнастику.
Кровотечения
Головной мозг имеет обширное кровоснабжение. При повреждении сосудов послеоперационная рана может кровоточить в течение 2-3 дней. Кровь может скапливаться в черепной коробке, пропитывая структуры головного мозга, сдавливая нервы. Это может привести к нарушению сосудодвигательного, дыхательного центров, судорогам. В целях предупреждения этих осложнений в рану ставят дренажи для отведения жидкости из раны. При прогрессирующем кровотечении может потребоваться повторная операция.
Имплантаты
Есть перечень обязательных качеств, которыми они должны обладать:
- достаточная прочность;
- биосовместимость;
- легкость;
- пластичность;
- не давать инфекционных осложнений;
- не обладать канцерогенным эффектом.
Имплантаты могут быть изготовлены из собственной кости пациента (аутотрансплантаты) и быть искусственными (ксенотранстплантаты).
Аутотрансплантаты
Это кость, которая была временно удалена для доступа к мозговым тканям пациента. Если кость нужно сохранить для закрытия дефекта черепа позже, ее помещают под кожу живота либо передненаружной поверхности бедра пациента. Если такое сохранение невозможно, используют другие техники использования собственной костной ткани человека. А при невозможности замещения дефекта аутотрансплантатами, прибегают к замещающим их материалам.
Ксенотрансплантанты
Так называемые «искусственные кости» изготавливают из металла (алюминия или титана), используют метилметакрилат или гидроксиапатит.
Каждый из упомянутых имплантатов имеет свои выгодные стороны и недостатки. Например, гидроксиапатит можно использовать при дефектах до 30 квадратных сантиметров. Этот материал обладает полной биосовместимостью. И способен превратиться в собственную костную ткань уже через 18 месяцев при небольших дефектах. А риск инфекционных осложнений у этого вида имплантатов самый низкий среди подобных.
Титан реже всех вызывает местные воспалительные реакции. И из него можно воссоздать утраченные фрагменты лицевого скелета, основания черепа, свод и стенки глазницы. Это делается при помощи моделирования и нейронавигации в предоперационном периоде.
Разобраться во всем многообразии имплантатов, а также узнать какие есть самые современные разработки медицины в области имплантологии, поможет доктор на очном приеме. Заполните заявку на нашем сайте, и мы запишем Вас на прием к ведущему специалисту в области нейрохирургии.
В каждом конкретном случае важно учитывать не только прямую пользу для человека, но и эстетическую и психологическую стороны. А также ограничения, накладываемые на пациента в связи с выбором (например, металлический имплантат не позволяет пациенту в дальнейшем прибегать к МРТ обследованию).
Ранний послеоперационный период
Для исключения гематомы под лоскуты подводятся выпускники в виде резиновых трубок, концы которых остаются под защитной повязкой. По трубкам вытекает кровяная масса, пропитывающая бинт. При значительном промокании повязки, она не меняется, а новый бинт наматывается дополнительно сверху. Если по окончании операции мозговая оболочка зашита не совсем герметично, то в просачивающейся кровяной массе могут появиться следы спинномозговой жидкости.
Выпускные трубки, как правило, снимаются через сутки после завершения хирургического вмешательства. Для предотвращения просачивания спинномозговой жидкости и устранения риска попадания инфекции через участки, где размещались выпускники, накладываются и завязываются провизорные или дополнительные швы.
В первый день после операции необходимо контролировать состояние повязки в области трепанации. Значительное набухание бинтов над прооперированным участком обусловлено послеоперационной гематомой, которая может вызвать быстрое нарастание отека мягких тканей лба и век, кровотечения в области глазниц. Очень опасным последствием, проявляющимся на ранней стадии после трепанации черепа, может стать вторичная ликворея, которая способна спровоцировать инфицирование черепного содержимого, вызвав менингит и энцефалит. В связи с этим, чрезвычайно важно своевременно выявить наличие светлой жидкости в кровяной массе, пропитывающей повязку и принять срочные меры.