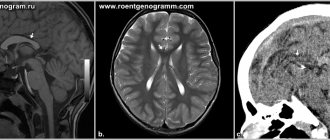
Патологии формирования и развития нервной трубки закладываются на сроке 2-4 недели, когда женщина даже не знает, что беременна. Среди причин, приводящих к нарушению формирования нервной трубки отмечают внешние факторы: алкогольное отравление, курение, болезни матери, приём лекарственных препаратов, неправильное питание.
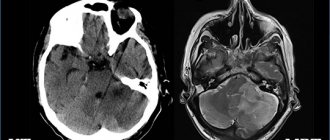
Пороки этого органа настолько тяжелы, что часто несовместимы с жизнью. И невооружённым глазом определить аномалию невозможно. Выявить патологию формирования нервной трубки можно только на скрининговом УЗИ плода, поэтому это исследование нельзя игнорировать.
| Цена скринингового УЗИ в нашей клинике | |
| Запись исследования на видеоноситель DVD + ФОТО — В ПОДАРОК ! | |
| 1 триместр: УЗИ при беременности с ранней диагностикой ВПР и расчетом риска болезни Дауна (11 недель 6 дней – 13 недель и 6 дней), один плод, c использованием 3D/4D реконструкции | 2000 |
| 1 триместр: комбинированный тест с расчетом риска болезни Дауна + взятие крови на биохимический скрининг (РАРР-А и свободн. бета-ХГ) и УЗИ плода (11 недель 6 дней – 13 недель и 6 дней), один плод c использованием 3D/4D реконструкции | 3300 |
| 2 триместр: УЗИ при беременности (18 недель 0 дней – 21 неделя и 6 дней), один плод, c использованием 3D/4D реконструкции | 3100 |
| 3 триместр: УЗИ при беременности (30 недель 0 дней – 34 неделя и 6 дней), один плод, c использованием 3D/4D реконструкции + доплерометрия | 3600 |
Анэнцефалия
Содержание статьи
Анэнцефалия — это полное или частичное отсутствие больших полушарий головного мозга, а в некоторых случаях костей черепа и мягких тканей. Встречается в 1 случае из 10 000, аномалия сопровождается другими нарушениями — незаращением верхней губы или твёрдого нёба, отсутствием гипофиза, спинномозговой грыжей.
Такое происходит, если по каким-то причинам на 3-4 неделе беременности не закрывается передний нейропор. Из-за этого не развиваются фронтальные расширения нервной трубки, из которых позже начали бы развиваться большие полушария.
Вместо богатого нейронами «серого вещества» формируется фиброзная ткань, в которой присутствуют единичные нервные клетки, кистозные образования и кровеносные сосуды. В 71% случаев у плода отсутствует лобно-затылочная зона и позвоночный столб, в 24% — затылочная доля с позвоночным столбом и в 5% — височно-теменная зона. Тело малыша при этом не имеет никаких отклонений.
На УЗИ анэнцефалия диагностируется на 11-12 неделях беременности, достоверность составляет 96%.
Для патологии характерны следующие эхопризнаки:
- не визуализируются кости черепа;
- мягкие ткани головного мозга анэхогенные;
- в сосудистой системе головного мозга наблюдается мальформация – неправильное соединение сосудов, вен и артерий;
- многоводие у матери (переизбыток амниотической жидкости).
Одним только ультразвуковым обследованием диагностика анэнцефалии не ограничивается. При дефекте нервной трубки в крови женщины повышается гормон альфа-фетопротеин. При подтверждении диагноза ей рекомендуется остановить беременность, потому что при отсутствии головного мозга у новорождённого через некоторое время откажут лёгкие, сердце, почки.
УЗИ-диагностика является первичным, но не основным методом постановки диагноза. Если патология нервной трубки будет обнаружена на УЗИ-обследовании, женщине назначают амниоцентез — взятие под контролем трансабдоминального датчика амниотической жидкости из околоплодного пузыря с целью лабораторного исследования.
При обнаружении высокой концентрации альфа-фетопротеина и фермента ацетилхолинэстеразы беременную отправляют на МРТ (магнитно-резонансную томографию). В отличие от УЗИ, этот метод позволяет увидеть головной мозг плода в 4D проекции, увеличив изображение в несколько раз.
Чем раньше будет поставлен диагноз, тем быстрее женщина сможет прервать беременность. Сохранять её при таком диагнозе не имеет смысла, потому что малыш проживёт максимум неделю.
Последствия повреждений
Дефекты нервной трубки (днт) носят название «спинальные дизрафии». Их разделяют на несколько групп:
- незаращение позвоночника, не обнаруживаемое визуально;
- очевидное незаращение позвоночника в сочетании со спинномозговой грыжей;
- расщепление позвоночного столба и окружающих мягких тканей, приводящее к уплощению спинного мозга.
Первый вариант патологии чаще локализован в поясничном или крестцовом отделе. Клинически этот дефект нервной трубки у плода никак не проявляется, поэтому если и обнаруживается, то случайно, при лучевых методах исследования. Внешне кожа над областью незаращения выглядит здоровой, может наблюдаться повышенное количество пигментных пятен, образуются жировики.
При обширном незаращении могут со временем проявляться следующие симптомы:
- патология трофики и чувствительности кожи;
- патология осанки и неправильное формирование стопы;
- формирование хронических болей;
- нарушение функции тазовых органов.
При открытых незаращениях формируются спинномозговые кисты и грыжи. В зависимости от уровня повреждения спинного мозга их разделяют на группы.
- Поражение оболочек, или менингоцеле. При этом происходит выпячивание в дефект твердой мозговой оболочки. На выходе из отверстия грыжи твердая мозговая оболочка атрофируется. Покрытие грыжи представляет собой тонкую пленку. Кожа над ним истончена. Внутри грыжи находятся мозговые оболочки и ликвор. Клинических симптомов обычно не наблюдается.
- Поражение корешков, или менингорадикулоцеле. Кроме мозговых оболочек в отверстие дефекта выходят корешки спинномозговых нервов. Часть корешков слепо заканчивается в грыжевом мешке. В зависимости от количества таких корешков проявления будут варьировать от нарушений чувствительности до тяжёлых парезов и параличей.
- Поражение мозга, или менингомиелоцеле. В грыжевой дефект выходит спинной мозг вместе с оболочками и корешками. Грыжа обширная, занимает несколько позвонков. Состояние ребёнка в таких случаях тяжёлое, отсутствует двигательная и чувствительная функция ниже места поражения, страдает функция тазовых органов.
- Образование кист, или миелоцистоцеле. При этом спинной мозг в конечном отделе расширяется, образуя кисту. В грыжевом мешке слепо заканчиваются корешки, вследствие чего наблюдаются те же симптомы, что и при мозговой форме.
- Осложненные формы — любая из вышеперечисленных форм в сочетании с доброкачественными опухолями грыжевого мешка.
Полное незаращение, или рахишизис — в большинстве случаев это несовместимое с жизнью состояние. Выжить новорожденный может в том случае, если этот дефект распространяется не более чем на 5 позвонков. Выглядит такое незаращение как зияние позвоночного и спинномозгового канала. Кожа и мышцы атрофированы, в глубине дефекта можно увидеть нервную ткань с мелкими недоразвитыми кровеносными сосудами.
Подавляющее большинство случаев этой патологии имеют локализацию в пояснично-крестцовом отделе позвоночника. Это имеет биологическое значение. Группа японских исследователей в течение определенного времени изучала материал, полученный в результате самопроизвольных абортов. Среди эмбрионов ученые выбирали тех, у кого имелись незаращения позвоночника. Было обнаружено, что практически у всех эмбрионов эта патология была локализована в шейном и грудном отделе. На основании этих данных было установлено, что тяжелые патологии развития, не совместимые с жизнью ребёнка после рождения, приводят к его гибели ещё в эмбриональном периоде.
Гидроцефалия
Гидроцефалия — это аномалия развития плода, при которой увеличивается количество желудочков головного мозга. В норме их должно быть четыре, и через них происходит циркуляция ликвора — спинномозговой жидкости. При нарушении выработки или всасывания ликвора в кровеносную систему жидкость скапливается в желудочках, расширяя их.
Причиной патологии служит неправильное развитие нервной трубки эмбриона. Это случается на ранних сроках до 4 недель, и в 20% случаев причиной служат внутриутробные инфекции.
При гидроцефалии, скапливающаяся спинномозговая жидкость растягивает желудочки, они давят на головной мозг. Вследствие этого черепная коробка расширяется, голова обретает неправильную форму.
На ранних сроках порок сложно заметить, он выявляется, начиная с 10 недели беременности. На УЗИ заметно расширение лобных долей, родничок становится более выпуклым, а голова непропорционально большой.
Гинеколог, проводя скрининговое УЗИ, делает замеры между висками по надбровной линии (БПР) и, начиная с 16 недели, измеряет расстояние между лбом и затылком (ЛЗР). Сравнивая результаты с нормальными показателями, характерными для данного срока беременности, врач делает и другие замеры.
Увеличение показателей БПР и ЛЗР не всегда указывает на патологии. Вполне возможно, что малыш сам по себе крупный, если остальные замеры его тела также превышают норму. Только если параметры головы значительно увеличены при нормальных параметрах тела, врач диагностирует «гидроцефалию».
Именно замеры головы позволяют отличать гидроцефалию от врождённого увеличения размеров мозговых желудочков. При этом заболевании внутричерепного давления нет, поэтому размеры черепа соответствуют норме.
Часто гидроцефалия сопровождается другими пороками развития. На УЗИ заметно сглаживание извилин головного мозга, неправильное формирование сосудов, аномалия различных отделов спинного мозга, увеличение полушарной щели.
Ещё один признак гидроцефалии у плода — гипертонус матки на протяжении всей беременности. Если причиной развития патологии является инфекция, то женщину будет беспокоить плохое самочувствие.
Специалист оценивает степень развития гидроцефалии и даёт рекомендации и прогнозы относительно будущего малыша. В некоторых случаях аномалия нервной трубки у плода настолько выражена, что лечение ребёнка окажется малоэффективным. В этом случае женщине предлагается аборт. Однако бывает противоположная ситуация, и после лечения малыш будет вести полноценный образ жизни.
Несмотря на значительные успехи современной пренатальной диагностики, дефекты нервной трубки (ДНТ) плода по-прежнему остаются одним из самых распространенных врожденных пороков развития. Ежегодно в США регистрируется 1 случай ДНТ на 1000 беременностей, при этом 4000 беременностей в год прерываются, включая самопроизвольный выкидыш и искусственный аборт, из-за нарушений развития ЦНС плода. Ежегодно частота выявления ДНТ в России составляет 0,45 %; смертность вследствие ДНТ – 300 новорожденных (2 % общей детской смертности).
ДНТ, или spina bifida, являются существенным фактором инвалидизации, хотя в настоящее время некоторые формы этой патологии поддаются хирургической коррекции.
В большинстве случаев ДНТ возникают в результате нарушения закрытия концов нервной трубки или их повторного открытия. У человека нервная трубка формируется из эктодермы, ее замыкание происходит на 21–28-й день после зачатия. При нарушении процессов формирования нервной трубки в зависимости от места появления дефекта образуется либо анэнцефалия, либо spina bifida. Клинически spina bifida может проявляться параличом нижних конечностей, мочевого пузыря, прямой кишки и т. д.
Возникновение ДНТ обусловлено как наследственными факторами, так и воздействием факторов внешней среды. Среди наследственных особенностей можно выделить половые и этнические различия, повышенную степень конкордантности у монозиготных близнецов, мутации генов и хромосомные нарушения (незначительное количество ДНТ). Необходимо учитывать факт рождения детей с ДНТ в анамнезе и наследственном анамнезе. Повышать риск появления ДНТ могут лекарственные средства, нарушающие обмен фолатов (триметоприм, сульфасалазин, карбамазепин, фенитоин, вальпроевая кислота и другие противосудорожные средства и т. д.), злоупотребление алкоголем, метанол. К приобретенным факторам, способным приводить к возникновению ДНТ, относят сахарный диабет, гипертермию, курение и т. д. Определенную роль в развитии патологии могут, кроме того, играть такие факторы, как место проживания, время года, в которое произошло зачатие, возраст матери, социально-экономические условия, а также алиментарный фактор.
Частота возникновения ДНТ варьируется от 2 на 1000 новорожденных в Мексике и Ирландии до 0,2 на 1000 таковых в Финляндии и Японии, а частота рецидивов при последующих беременностях составляет 2 %. Несмотря на невысокую распространенность, spina bifida является наиболее частым врожденным дефектом и приводит к потере трудоспособности.
ДНТ были описаны еще древними египтянами, а в 1641 г. Tulp N. впервые изобразил spina bifida. Алиментарный фактор одним из первых был признан фактором риска развития spina bifida. Stein и соавт. отметили высокую частоту spina bifida у 18-летних юношей, поступающих на военную службу, которые были рождены во время голода в конце Второй мировой войны. В дальнейшем Hibbard и Smithells показали, что женщины, родившие детей с ДНТ, во время беременности испытывали дефицит витаминов. По их наблюдениям, в результате приема мультивитаминных комплексов частота рецидивов этой патологии в последующие беременности резко сократилась.
Steegers-Theunissen R.P. и соавт. впервые предположили наличие связи между нарушением фолатзависимых процессов обмена гомоцистеина (ГЦ) и развитием ДНТ (коэффициент несогласия – 6,8; 95 % доверительный интервал). В дальнейшем они показали, что риск формирования spina bifida возрастает при повышении концентрации ГЦ в крови, а прием фолиевой кислоты в свою очередь снижает содержание ГЦ в плазме крови беременных. Концентрация ГЦ в амниотической жидкости у новорожденных, родившихся с ДНТ, была выше, чем у таковых контрольной группы. При изучении обмена метионина в экстраэмбриональной и амниотической жидкостях было показано, что концентрация общего ГЦ в эмбриональной жидкости значительно ниже, чем в плазме крови матери, а концентрация метионина в четыре раза выше в экстраэмбриональной целомической жидкости и в два раза – в амниотической жидкости по сравнению с плазмой крови матери.
В Дании van der Put N.M. и соавт. выявили повышенную частоту полиморфизма С677Т гена фермента метилентетрагидрофолат редуктазы (МTHFR) у членов семей, в которых имелись дети с ДНТ. Мутация гена выявлена у 16 % матерей, 10 % отцов и 13 % новорожденных со spina bifida по сравнению с 5 % в контрольной группе. Подобные результаты были получены и в других странах. В данном исследовании показано, что риск развития spina bifida повышается в семь раз при сочетании гомозиготной мутации у матери и у плода. Это доказывает влияние нарушений обмена ГЦ у плода на развитие ДНТ.
Степень тяжести spina bifida может быть различной – от стертых форм до грубых дефектов с расщеплением позвоночника в сочетании с миелошизисом.
По степени тяжести spina bifida различают:
- позвоночный дермальный синус
- скрытое незаращение дужки позвонка
- пузырное незаращение дужки
- расщепление позвоночника в сочетании с миелошизисом
- реметилирование с участием метионин-синтетазы при нормальном содержании витамина В12 и фолатов
- переход ГЦ под действием фермента цистатионин-бета-синтетазы в цистатионин, который является менее токсичным продуктом для мозга и в дальнейшем используется для синтеза цистеина
- экспорт ГЦ в кровь (см. рисунок)
Несмотря на то что ДНТ известны человеку с древних времен, все механизмы развития этого дефекта до сих пор неясны, хотя не вызывает сомнений, что большое значение имеют генетические факторы, несбалансированное питание (дефицит фолатов и витаминов группы В), гипергомоцистеинемия (ГГЦ), факторы окружающей среды (радиоактивное излучение и др.).
Большинство исследований последних лет демонстрируют влияние нарушений в обмене фолатов и метиониновом цикле на патогенез ДНТ. Поскольку эти процессы неразрывно связаны друг с другом, дефицит или дефекты любого кофактора (витаминов группы В, фолатов) и ферментов, которые могут быть как приобретенными, так и генетически обусловленными, ведут либо к ГГЦ, либо к стертым или выраженным формам фолатдефицитных состояний.
Многие патологические эффекты дефицита фолатов связаны с повышением в плазме крови уровня ГЦ. Роль фолатов в развитии ДНТ известна уже более 40 лет, а роль витаминов В12 и В6 установлена значительно позже. Внутриклеточный витамин В12 действует как фактор реметилирования ГЦ в метионин при участии фермента метионин-синтетазы (MS). Дефицит витамина В12, таким образом, может стать причиной ГГЦ, хотя концентрация фолатов в крови может быть нормальной или даже повышенной. Такой феномен известен как “ловушка метил-фолатов”.
Следует подчеркнуть, что сочетание ГГЦ и дефицита фолатов, в т. ч. при нехватке витаминов группы В, особенно витамина В6, – мощный фактор риска развития не только ДНТ, но и сосудистых осложнений: венозных и артериальных тромбозов, гестоза, преждевременной отслойки нормально расположенной плаценты, фетоплацентарной недостаточности и синдрома задержки развития плода, антенатальной гибели плода, ранних и поздних выкидышей. Витамин В6 в форме пиридоксоль-5-фосфата участвует в транссульфации ГЦ в цистеин с помощью фермента цистатионин-бета-синтетазы (СВS).
Метаболизм ГЦ неразрывно связан с метиониновым циклом. Синтез ГЦ (в больших концентрациях цитотоксичной аминокислоты) является результатом образования лабильных метильных групп в результате химических процессов метионинового цикла. Образование ГЦ происходит во всех клетках, однако пути его утилизации различаются. Большинство клеток и тканей способно реметилировать ГЦ (с участием фолатов, витамина В12), и только некоторые клетки могут осуществлять процессы транссульфации. Этим, по-видимому, можно объяснить высокую эффективность фолиевой кислоты и витаминов группы В в снижении уровня ГЦ в плазме крови.
Нервная ткань использует следующие механизмы для поддержания концентрации ГЦ на должном уровне:
В нервной системе, как и в других органах, нарушение обмена ГЦ может возникать в результате генетических нарушений, после приема различных лекарственных средств и под влиянием других приобретенных факторов.
Концентрация ГЦ в крови беременных на 50–60 % ниже, чем вне беременности. Беременность характеризуется изменением гормонального профиля, повышением объема циркулирующей крови, сердечного выброса, периферической вазодилатацией, изменением функции почек и увеличением массы тела. Возможными причинами снижения концентрации ГЦ являются гемодилюция, повышение синтеза стероидов, а также потребление метионина и ГЦ растущим плодом.
Ряд исследований показал, что оральные контрацептивы (ОК), содержащие даже менее 50 мкг эстрогенов (все современные препараты содержат их не больше 35 мкг), нарушают кинетику фолатов и в крови женщин, использующих ОК, повышено содержание витамина А, а также снижены концентрации витамина В и фолиевой кислоты. Таким образом, риск развития ДНТ выше у пациенток, которые забеременели сразу после длительного приема ОК, особенно при наличии генетических мутаций ферментов (MTHFR, МТS и пр.), и дополнительно не принимали фолиевую кислоту и витамины группы В.
Исследования, посвященные роли витамина В12 в процессе реметилирования ГЦ и в генезе развития ДНТ, стали проводиться в последние 5–10 лет. Доказано, что участие витамина В12 как кофактора обеспечивает более полную и быструю абсорбцию фолиевой кислоты клетками. Исследование Paskal M. и соавт., изучавших содержание витамина В12 в плазме крови матерей, родивших детей со spina bifida, продемонстрировало, что снижение концентрации витамина В12 в материнской сыворотке крови ниже уровня 185 пмоль/л коррелирует с 3,5-кратным повышением риска рождения ребенка со spina bifida. Средние концентрации витамина В12 у матерей группы spina bifida были на 21 % меньше по сравнению с контрольной группой, в то время как различий между концентрациями фолатов, витамина В6 и ГЦ в сыворотке крови и эритроцитах не наблюдалось. Эти данные подтверждают многофакторность происхождения ДНТ и необходимость включения витамина В12 наряду с фолатами в профилактику ДНТ плода.
Особую группу риска по дефициту фолатов и витаминов группы В составляют пациентки, длительное время получавшие гормональную контрацепцию, а также курящие, злоупотребляющие кофе (более 5 чашек в день) и, безусловно, пациентки с генетическими факторами (мутацией MTHFR, СВS, транскобаламина), мальабсорбцией, несбалансированным питанием, диагностированной ГГЦ и ДНТ плода в анамнезе. Следует также учитывать, что до 80 % женщин в возрасте от 18 до 40 лет имеют субоптимальные концентрации фолатов в крови.
Профилактическое назначение фолатов и витаминов группы В, а также коррекция диеты значительно снижают частоту развития пороков нервной трубки у плода. Так, в Дублине было проведено обогащение круп (фортификация зерновых), являющихся важной составной частью ирландской диеты, витамином В12 в 1981 г. и фолиевой кислотой в 1987 г., что привело к снижению частоты рождения детей с ДНТ с 4,7 до 1,3 на 1000 новорожденных. Профилактика ДНТ приобрела масштабы Национальных программ здоровья во многих развитых странах. Например, в США и Канаде ввели в действие программу по обогащению зерновых фолатами, прежде всего для снижения риска рождения детей с ДНТ, на фоне которой число новорожденных с ДНТ уменьшилось на 19 % (Honein М.А. и соавт., 2001). В ряде стран предпочитают проводить программы, направленные на профилактическое использование фолатсодержащих препаратов женщинами детородного возраста. Так, по данным многоцентрового исследования, проведенного в 33 клинических центрах Англии (обследованы 1817 женщин), более 75 % случаев ДНТ можно предотвращать с помощью назначения фолиевой кислоты и витамина В12.
Актуальными вопросами оптимальной профилактики ДНТ плода являются длительность применения и дозы фолиевой кислоты. Согласно рекомендациям различных международных организаций (включая Food and Drug Administration, США; March of Dimes CDC-Alanta – Spina Bifida Assotiation Public Health Service; Reino Unido Junta de Sanidad y Consumo de Espana, 2001, и др.), женщины с неотягощенным по ДНТ анамнезом должны получать 400 мкг фолиевой кислоты в сутки в сочетании с витамином В12 в дозе 2 мкг/сут как минимум за месяц до зачатия и на протяжении первого триместра беременности. В Италии с 2005 г. законодательно утверждена необходимость ежедневного приема 400 мкг фолиевой кислоты женщинами, планирующими беременность.
С учетом последних научных данных важно, чтобы помимо фолиевой кислоты лекарственные средства, предназначенные для профилактики ДНТ плода, включали витамин В12. На сегодняшний день таким препаратом является Фолибер (Италфармако, Италия), содержащий в 1 таблетке 400 мкг фолиевой кислоты и 2 мкг витамина В12 – дозу, рекомендуемую для эффективной профилактики ДНТ плода. Механизм действия Фолибера заключается в нормализации процессов деления клетки и преодолении метаболической блокады синтеза метионина.
Таким образом, с целью профилактики ДНТ (spina bifida) плода каждой беременной (на протяжении первого триместра) и женщинам, планирующим беременность, показан прием одной таблетки Фолибера в сутки.
Микроцефалия
Микроцефалия — это сложнейшая патология головного мозга, выраженная в уменьшении размеров органа у плода. Причиной недоразвития головного мозга служит нарушение деления нервных клеток на стадии формирования нервной трубки эмбриона.
Патология провоцируется несколькими факторами: в 40% она развивается на фоне цитомегаловируса у матери, также существует наследственная форма болезни Джакомини-Пенроуза-Бека.
Микроцефалия встречается редко: 1 случай на 5 000, и часто сопровождается другими нарушениями ЦНС Ч лисэнцефалией (нарушением формирования коры головного мозга), микрогирией (малыми размерами мозговых извилин), аномалией мозжечка, недоразвитостью спинного мозга.
В плане диагностики микроцефалия — самый сложный порок. За основу УЗИ-исследования взят критерий соотношения длины бедренной кости и окружности головы плода, который не должен быть меньше 2,5. Однако интерпретация затрудняется тем, что не всегда известен точный срок беременности. Ложноположительный и ложноотрицательный результат может быть из-за небольших размеров плода или нарушения роста костей при других патологиях.
Точность УЗИ-диагностики при микроцефалии составляет 67,4%, причём в 85% случаев диагноз ставится позже 22 недель беременности. Начиная с 2 недели на УЗИ легко прослеживается строение черепа. При микроцефалии он имеет неправильную форму, лоб скошен, ушные раковины расположены низко, челюсти недоразвиты. Также имеется расширение мозговых желудочков.
Дополнительно в 60% у плода диагностируются другие нарушения ЦНС, болезни почек, сердца и других внутренних органов.
Диагностика микроцефалии всегда комплексная. При подозрении на патологию у женщины берут анализ амниотической жидкости, проводят кариотипирование плода. Только после тщательного обследования женщине говорят о диагнозе, и она сама решает, что делать дальше.
Как формируется
ПРЕДУПРЕЖДЕНИЕ! Информация сайта предоставлена в ознакомительных целях, и не может использоваться для постановки диагноза, и принятия решения о лечении.
Нервная трубка плода что это? Это основа будущей нервной системы, развивается из зародышевого листка и эпидермиса.
Закладка нервной трубки начинается непосредственно после зачатия, процесс происходит в течение первых недель беременности. В норме закрывается на 25 день. Если этого не происходит, развиваются тяжелые болезни у ребенка.
Этапы формирования:
- На 18 сутки у эмбриона увеличивается количество эктодермы, формируется нервная пластина.
- Края пластины преобразуются в валики с желобком между ними. Он немного расширен в передней части – это зачатки головного мозга.
- За несколько дней происходит сближение валиков, они соединяются, образуется трубка, полая внутри.
- В дальнейшем из этой полости образуются мозговые желудочки и спинномозговой канал.
Некоторые участки пластины преобразуются в гребни. Из них образуются периферические узлы, мозговые оболочки, волокна нейронов, мозговая ткань надпочечников, пигментные клетки эпидермиса.
Области
| Зона | Описание |
| Вентрикулярная | Состоит из клеточных цилиндров – родоначальники основных клеток и макроглии. |
| Субвентрикулярная | Зона активного роста, исчезает к окончанию эмбрионального периода. |
| Промежуточная | Образует серое вещество. |
| Краевая | Основа белого вещества. |
Энцефалоцеле
Энцефалоцеле — это разновидность мозговой грыжи, при которой мозговые оболочки выходят за пределы черепа через черепные дефекты. Патология возникает из-за неразделения конца нервной трубки на 4-й неделе беременности. В результате у плода образуется полиповидная масса: в 75% случаев она локализуется на затылке или своде черепа, а в 25% выступает через лицевую область.
На УЗИ энцефалоцеле диагностируется на 11-12-й неделе беременности, когда происходит окостенение костей черепа. На экране монитора видно низкоэхогенное образование за пределами свода черепа. Оно состоит из мозгового вещества, а при менингоцеле виден ещё и ликвор.
В некоторых случаях (при энцефалоцистоменингоцеле) внутри грыжи визуализируется часть мозгового желудочка. Помимо этого, у плода имеются микроцефалия, гидроцефалия и другие внутриутробные пороки. Обычно при энцефалоцеле у женщины наблюдается маловодие, затрудняющее диагностику.
К другим признакам энцефалоцеле у плода относятся:
- широкая переносица;
- ассиметрично расположенные глазницы;
- деформация черепа.
На ранних сроках беременности наблюдается повышение альфа- фетопротеина.
Ультразвуковая диагностика на сроке до 24-х недели беременности имеет эффективность 87%, однако при базальной форме патологии постановка диагноза будет затруднена. В большинстве случаев женщине рекомендуют прервать беременность в связи с тяжёлыми пороками у ребёнка и невозможностью его реабилитации в будущем.
Среди причин, вызывающих мозговую грыжу, можно выделить:
- токсическое воздействие на плод (курение, алкоголь, наркотики);
- приём сильнодействующих лекарственных препаратов;
- инфекции, в основном скрытые;
- вирусы (грипп, краснуха, гепатит) у матери;
- работа на тяжёлом производстве;
- генетический фактор.
В некоторых случаях при небольшом размере грыжи малышу в течение первых 3-х лет жизни делают операцию. Но даже при благоприятном исходе он будет несколько отставать в психо-эмоциональном развитии от своих сверстников. Если полипообразный нарост не удалять, он будет притягивать инфекции и вызывать дискомфорт. Малыш в таком случае погибает в течении 1 года жизни.
Причины формирования патологий
Что такое дефект? Этим понятием обозначается любое неправильное строение тканей и органов. Дефект нервной трубки — это аномалия её строения, сформировавшаяся в эмбриональном периоде. При нормальном протекании беременности валики нервной пластинки соединяются к 23 дню. Если же этого не произошло в установленный срок, у плода формируются дефекты.
Причины появления дефектов нервной трубки плода достаточно разнообразны:
- повышение ликворного давления в уже сформировавшейся трубке;
- вирусная инфекция, особенно краснуха;
- генетическая предрасположенность — подобный дефект в анамнезе у родителей, случаи рождения в семье детей с такими патологиями;
- загрязненность окружающей среды — радиация, пестициды, отходы химического производства;
- приём противоэпилептических препаратов непосредственно перед беременностью и в её начале;
- длительная лихорадка у женщины на ранних сроках;
- ожирение при диабете;
- неправильное питание с дефицитом витаминов.
При выявлении хотя бы одного из этих состояний женщина попадает в группу повышенного риска появления ребёнка с дефектом нервной трубки.