Статья на конкурс «био/мол/текст»: Клеточные процессы, обеспечивающие обмен информацией между нейронами, требуют много энергии. Высокое энергопотребление способствовало в ходе эволюции отбору наиболее эффективных механизмов кодирования и передачи информации. В этой статье вы узнаете о теоретическом подходе к изучению энергетики мозга, о его роли в исследованиях патологий, о том, какие нейроны более продвинуты, почему синапсам иногда выгодно не «срабатывать», а также, как они отбирают только нужную нейрону информацию.
Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (~10 имп./с) и быстрые (~40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (~4—9 имп./с) в несколько раз больше, чем быстрых ингибиторных интернейронов (>100 имп./с) [8], [9]. Так, видимо, мозг «предпочитает» использовать поменьше быстрых и энергозатратных нейронов, чтобы те не израсходовали все ресурсы [6], [9–11].
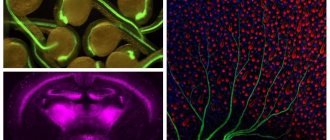
Рисунок 1. Представлены два нейрона. В одном из них фиолетовым цветом окрашен пресинаптический белок синаптофизин. Другой нейрон полностью окрашен зеленым флуоресцентным белком. Мелкие светлые крапинки — синаптические контакты между нейронами [12]. Во вставке одна «крапинка» представлена ближе. Группы нейронов, связанных между собой синапсами, называются нейронными сетями [13], [14]. Например, в коре больших полушарий пирамидальные нейроны и интернейроны образуют обширные сети. Слаженная «концертная» работа этих клеток обусловливает наши высшие когнитивные и другие способности. Аналогичные сети, только из других типов нейронов, распределены по всему мозгу, определенным образом связаны между собой и организуют работу всего органа.
сайт embryologie.uni-goettingen.de
Что такое интернейроны?
Нейроны центральной нервной системы разделяются на активирующие (образуют активирующие синапсы) и тормозящие (образуют тормозящие синапсы). Последние в значительной степени представлены интернейронами, или промежуточными нейронами. В коре больших полушарий и гиппокампе они ответственны за формирование гамма-ритмов мозга [15], которые обеспечивают слаженную, синхронную работу других нейронов. Это крайне важно для моторных функций, восприятия сенсорной информации, формирования памяти [9], [11].
Интернейроны отличаются способностью генерировать значительно более высокочастотные сигналы, чем другие нейроны. Они также содержат больше митохондрий, главных органелл энергетического метаболизма, «фабрик» по производству АТФ. Последние к тому же содержат большое количество белков цитохром-с оксидазы и цитохрома-с, являющихся ключевыми для метаболизма. Так, интернейроны являются крайне важными и, в то же время, энергозатратными клетками [8], [9], [11], [16].
Работа Леви и Бакстера [6] развивает концепцию «экономии импульсов» Горация Барлоу из Университета Калифорнии (США), который, кстати, является потомком Чарльза Дарвина [17]. Согласно ей, при развитии организма нейроны стремятся работать только с наиболее полезной информацией, фильтруя «лишние» импульсы, ненужную и избыточную информацию. Однако эта концепция не дает удовлетворительных результатов, так как не учитывает метаболические затраты, связанные с нейрональной активностью [6]. Расширенный подход Леви и Бакстера, в котором внимание уделено обоим факторам, оказался более плодотворным [6], [18–20]. И энергозатраты нейронов, и потребность в кодировании только полезной информации являются важными факторами, направляющими эволюцию мозга [6], [21–24]. Поэтому, чтобы лучше разобраться в том, как устроен мозг, стоит рассматривать обе эти характеристики: сколько нейрон передает полезной информации и сколько энергии при этом тратит.
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Как же работает этот подход?
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Поиск оптимума
Фактически, речь идет о задаче оптимизации: поиска максимума функции и определения параметров, при которых он достигается. В нашем случае, функция — это отношение количества полезной информации к энергозатратам. Количество полезной информации можно примерно вычислить с помощью формулы Шеннона, широко используемой в теории информации [6], [18], [19]. Для расчета энергозатрат существуют два метода, и оба дают правдоподобные результаты [10], [27]. Один из них — «метод счета ионов» — основан на подсчете количества ионов Na+, попавших внутрь нейрона при том или ином сигнальном событии (ПД или ПСП, см. врезку «Что такое потенциал действия») с последующим переводом в число молекул аденозинтрифосфата (АТФ), главной энергетической «валюты» клеток [10]. Второй базируется на описании ионных токов через мембрану по законам электроники и позволяет вычислить мощность эквивалентной электрической цепи нейрона, которая затем переводится в затраты АТФ [17].
Эти «оптимальные» значения параметров затем нужно сравнить с измеренными экспериментально и определить, насколько они отличаются. Общая картина отличий укажет на степень оптимизации данного нейрона в целом: насколько реальные, измеренные экспериментально, значения параметров совпадают с рассчитанными. Чем слабее выражены отличия, тем нейрон более близок к оптимуму и работает энергетически более эффективно, оптимально. С другой стороны, сопоставление конкретных параметров покажет, в каком конкретно качестве этот нейрон близок к «идеалу».
Далее, в контексте энергетической эффективности нейронов рассмотрены два процесса, на которых основано кодирование и передача информации в мозге. Это нервный импульс, или потенциал действия, благодаря которому информация может быть отправлена «адресату» на определенное расстояние (от микрометров до полутора метров) и синаптическая передача, лежащая в основе собственно передачи сигнала от одного нейрона на другой.
Скорость распространения нервных импульсов
В 1830 г. один из крупнейших физиологов XIX века Иоганн Мюллер заявил, что скорость распространения ПД измерить невозможно. По его мнению, поскольку ПД – это электрический импульс, он должен проводиться со скоростью, примерно равной скорости света (3–1010 см/с); учитывая небольшие размеры биологических объектов, даже с помощью лучших инструментов того времени измерить такую скорость было невозможно.
Спустя 15 лет один из студентов Мюллера Герман фон Гельмгольц с помощью простого и изящного эксперимента, который легко воспроизвести на студенческом лабораторном практикуме (рис. 6–8), измерил скорость распространения импульсов в нерве лягушки. В своих опытах Гельмгольц раздражал нерв в двух участках, отстоящих друг от друга на 3 см, и измерял время от момента подачи стимула до максимума мышечного сокращения. Предположим, что при раздражении дистального (расположенного ближе к мышцам) участка это время уменьшается на 1 мс. Тогда скорость распространения импульсов V
равна
| V | = | d | / | t | = | 3 см | / | 1 мс | = | · | 103 | см/с |
| Рис. 6.8. Экспериментальная установка, аналогичная той, с помощью которой Гельмгольц измерил скорость распространения импульсов в нерве лягушки. Стимулирующие электроды сначала подводились к точке Ст1, а затем к точке Ст2. К мышце был подсоединен рычаг, заостренный конец которого вычерчивал кривую на закопченном листе бумаги, быстро передвигаемом в продольном направлении. |
Эта величина оказалась на семь порядков меньше, чем скорость распространения электрического тока в медном проводнике или в растворе электролита. Отсюда Гельмгольц сделал совершенно правильный вывод, что проведение нервного импульса –это более сложный процесс, чем простое продольное распространение тока в нервном волокне.
Скорость распространения импульсов в различных аксонах варьирует от 120 м/с (в некоторых крупных волокнах) до нескольких сантиметров в секунду (в очень тонких аксонах). Эти различия между скоростью проведения в разных волокнах иллюстрируют табл. 6–1 и рис. 6–9.
Скорость распространения импульса в значительной степени зависит от того, как быстро участок мембраны, расположенный на определенном расстоянии от места подачи стимула, деполяризуется местными токами до порогового уровня. Чем выше постоянная длины волокна, тем дальше могут распространяться эти токи, тем быстрее происходит деполяризация мембраны впереди от места возбуждения и, следовательно, тем выше скорость распространения импульса. Влияние постоянной длины на эту скорость можно продемонстрировать, если поместить аксон в масло или в воздух. При этом на поверхности аксона остается лишь тонкая пленка солевого раствора, и постоянная длины уменьшается из–за увеличения наружного продольного сопротивления [в уравнении (6–2) –r
0]. В этих условиях скорость проведения возбуждения будет ниже чем при погружении аксона в солевой раствор.
Таблица 6–1. Классификация нервных волокон лягушки по их диаметру и скорости проведения возбуждения (Erlanger, Gasser, 1937)
| Группа волокон | Диаметр, мкм | Скорость, м/с |
| A α | 18,5 | |
| β | 14,0 | |
| γ | 11,0 | |
| B | — | 4,2 |
| C | 2,5 | 0,4 –0,5 |
| Рис. 6.9. Скорость распространения возбуждения в различных группах волокон нерва лягушки. А. Экспериментальная установка для стимуляции пучка нервных волокон и регистрации возникающих при этом потенциалов. Б. Составной потенциал действия, записанный с помощью внеклеточных электродов и представляющий собой сумму потенциалов во всех возбужденных волокнах пучка. Волокна группы α имеют наибольший диаметр и характеризуются самой высокой скоростью проведения. Напротив, у волокон группы γ как диаметр, так и скорость проведения наиболее низки (см табл. 6–1). Стимуляция осуществлялась до момента начала регистрации. |
В процессе эволюции живые организмы выработали два способа увеличения постоянной длины аксона и тем самым–скорости распространения импульса. Один из них (типичным примером могут быть гигантские аксоны кальмаров, членистоногих кольчатых червей, костистых рыб) – это увеличение диаметра аксона, т. е. уменьшение внутреннего продольного сопротивления [в уравнении (6–2) – r
i] Подробнее этот вопрос рассмотрен в дополнении 6–2. Гигантские аксоны развились в процессе эволюции у некоторых видов животных для того, чтобы обеспечивать быструю синхронную активацию двигательных рефлексов, например движений мантии у кальмара и рефлекса отдергивания либо избегания у некоторых членистоногих (раков, тараканов) и кольчатых червей (например, земляных).
Потенциал действия
Потенциал действия (ПД) — сигнал, которые отправляют друг другу нейроны. ПД бывают разные: быстрые и медленные, малые и большие [28]. Зачастую они организованы в длинные последовательности (как буквы в слова), либо в короткие высокочастотные «пачки» (рис. 2).
Рисунок 2. Разные типы нейронов генерируют различные сигналы. В центре — продольный срез мозга млекопитающего. Во вставках представлены разные типы сигналов, зарегистрированные методами электрофизиологии [15], [38]. а — Кортикальные (Cerebral cortex) пирамидальные нейроны могут передавать как низкочастотные сигналы (Regular firing), так и короткие взрывные, или пачечные, сигналы (Burst firing). б — Для клеток Пуркинье мозжечка (Cerebellum) характерна только пачечная активность на очень высокой частоте. в — Релейные нейроны таламуса (Thalamus) имеют два режима активности: пачечный и тонический (Tonic firing). г — Нейроны средней части поводка (MHb, Medial habenula) эпиталамуса генерируют тонические сигналы низкой частоты.
[14], рисунок адаптирован
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
Что такое потенциал действия?
- Мембрана и ионы. Плазматическая мембрана нейрона поддерживает неравномерное распределение веществ между клеткой и внеклеточной средой (рис. 3б) [31–33]. В числе этих веществ есть и маленькие ионы, из которых для описания ПД важны К+ и Nа+. Ионов Na+ внутри клетки мало, снаружи — много. Из-за этого они постоянно стремятся попасть в клетку. Напротив, ионов К+ много внутри клетки, и они норовят из нее выйти. Самостоятельно ионы этого сделать не могут, потому что мембрана для них непроницаема. Для прохождения ионов через мембрану необходимо открывание специальных белков — ионных каналов мембраны.
- Ионные каналы. Разнообразие каналов огромно [14], [36], [38], [39]. Одни открываются в ответ на изменение мембранного потенциала, другие — при связывании лиганда (нейромедиатора в синапсе, например), третьи — в результате механических изменений мембраны и т.д. Открывание канала заключается в изменении его структуры, в результате которого через него могут проходить ионы. Некоторые каналы пропускают только определенный тип ионов, а для других характерна смешанная проводимость. В генерации ПД ключевую роль играют каналы, «чувствующие» мембранный потенциал, — потенциал-зависимые ионные каналы . Они открываются в ответ на изменение мембранного потенциала. Среди них нас интересуют потенциал-зависимые натриевые каналы (Na-каналы), пропускающие только ионы Na+, и потенциал-зависимые калиевые каналы (K-каналы), пропускающие только ионы К+.
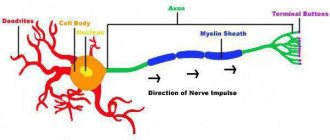
- Ионный ток и ПД. Основой ПД является ионный ток — движение ионов через ионные каналы мембраны [38]. Так как ионы заряжены, их ток приводит к изменению суммарного заряда внутри и вне нейрона, что немедленно влечет за собой изменение мембранного потенциала. Генерация ПД, как правило, происходит в начальном сегменте аксона — в той его части, что примыкает к телу нейрона [40], [14]. Тут сконцентрировано много Na-каналов. Если они откроются, внутрь аксона хлынет мощный ток ионов Na+, и произойдет деполяризация мембраны — уменьшение мембранного потенциала по абсолютной величине (рис. 3в). Далее необходимо возвращение к его исходному значению — реполяризация. За это отвечают ионы К+. Когда К-каналы откроются (незадолго до максимума ПД), ионы К+ начнут выходить из клетки и реполяризовать мембрану. Деполяризация и реполяризация — две основные фазы ПД. Помимо них выделяют еще несколько, которые из-за отсутствия необходимости здесь не рассматриваются. Детальное описание генерации ПД можно найти в [14], [29], [38], [41]. Краткое описание ПД есть также в статьях на «Биомолекуле» [15], [42].
- Начальный сегмент аксона и инициация ПД. Что приводит к открыванию Na-каналов в начальном сегменте аксона? Опять же, изменение мембранного потенциала, «приходящее» по дендритам нейрона (рис. 3а). Это — постсинаптические потенциалы (ПСП), возникающие в результате синаптической передачи. Подробнее этот процесс объясняется в основном тексте.
- Проведение ПД. К ПД в начальном сегменте аксона будут неравнодушны Na-каналы, находящиеся неподалеку. Они тоже откроются в ответ на это изменение мембранного потенциала, что также вызовет ПД. Последний, в свою очередь, вызовет аналогичную «реакцию» на следующем участке аксона, все дальше от тела нейрона, и так далее. Таким образом происходит проведение ПД вдоль аксона [14], [15], [38]. В конце концов он достигнет его пресинаптических окончаний (малиновые стрелки на рис. 3а), где сможет вызвать синаптическую передачу.
- Энергозатраты на генерацию ПД меньше, чем на работу синапсов. Скольких молекул аденозинтрифосфата (АТФ), главной энергетической «валюты», стоит ПД? По одной из оценок, для пирамидальных нейронов коры мозга крысы энергозатраты на генерацию 4 ПД в секунду составляют около ⅕ от общего энергопотребления нейрона. Если учесть другие сигнальные процессы, в частности, синаптическую передачу, доля составит ⅘. Для коры мозжечка, отвечающего за двигательные функции, ситуация похожа: энергозатраты на генерацию выходного сигнала составляют 15% от всех, а около половины приходится на обработку входной информации [25]. Так, ПД является далеко не самым энергозатратным процессом. В разы больше энергии требует работа синапса [5], [19], [25]. Однако это не означает, что процесс генерации ПД не проявляет черт энергетической эффективности.
Рисунок 3. Нейрон, ионные каналы и потенциал действия. а — Реконструкция клетки-канделябра коры головного мозга крысы. Синим окрашены дендриты и тело нейрона (синее пятно в центре), красным — аксон (у многих типов нейронов аксон разветвлен намного больше, чем дендриты [8], [11], [35]). Зеленые и малиновые стрелки указывают направление потока информации: дендриты и тело нейрона принимают ее, аксон — отправляет ее к другим нейронам. б — Мембрана нейрона, как и любой другой клетки, содержит ионные каналы. Зеленые кружки — ионы Na+, синие — ионы К+. в — Изменение мембранного потенциала при генерации потенциала действия (ПД) нейроном Пуркинье. Зеленая область: Na-каналы открыты, в нейрон входят ионы Na+, происходит деполяризация. Синяя область: открыты К-каналы, К+ выходит, происходит реполяризация. Перекрывание зеленой и синей областей соответствует периоду, когда происходит одновременный вход Na+ и выход К+.
[34], [36], [37], рисунки адаптированы
ПД — это относительно сильное по амплитуде скачкообразное изменение мембранного потенциала.
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
[20], рисунок адаптирован
Почему они более эффективны? Потому что у них малó перекрывание Na- и К-токов. Во время генерации ПД всегда есть промежуток времени, когда эти токи присутствуют одновременно (рис. 3в). При этом переноса заряда практически не происходит, и изменение мембранного потенциала минимально. Но «платить» за эти токи в любом случае приходится, несмотря на их «бесполезность» в этот период. Поэтому его продолжительность определяет, сколько энергетических ресурсов растрачивается впустую. Чем он короче, тем более эффективно использование энергии [20], [26], [30], [43]. Чем длиннее — тем менее эффективно. Как раз в двух вышеупомянутых типах нейронов, благодаря быстрым ионным каналам, этот период очень короткий, а ПД — самые эффективные [20].
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Сальтаторное проведение
Второй способ увеличить скорость проведения нервных импульсов, реализовавшийся только у позвоночных животных, состоит в изоляции участков аксона с помощью миелиновой оболочки.
При этом постоянная длины соответствующих участков значительно увеличивается, и тем самым существенно облегчается проведение тока в продольном направлении. По мере развития животного миелин откладывается вокруг периферических и центральных аксонов глиальными клетками, расположенными вблизи этих аксонов. В результате вокруг волокон образуется плотная многослойная оболочка из клеточных мембран.
К клеткам, синтезирующим миелин, относятся шванновские клетки
(в области периферических нервов) и
олигодендроциты
(рис. 6–10) (в ЦНС). На поперечных срезах миелиновой оболочки видны периодически повторяющиеся промежутки в 12 нм, образующиеся в результате наслоения мембран глиальных клеток. С образованием каждого нового слоя поперечное сопротивление оболочки увеличивается. Поскольку слоев в этой оболочке много, ее емкость гораздо ниже, чем у одиночной мембраны. Многослойная миелиновая оболочка периодически прерывается (так называемые
перехваты Ранвье},
и на этих небольших участках возбудимая мембрана аксона контактирует с внеклеточной средой. Между перехватами Ранвье миелиновая оболочка тесно прилегает к мембране аксона, практически вытесняя внеклеточную среду. Кроме того, участки мембраны аксона между перехватами Ранвье, по–видимому, не содержат натриевых каналов.
| Рис. 6.10. Перехват Ранвье. Показан короткий «голый» участок аксона, расположенный между двумя миелинизированными участками. Именно этот участок возбуждается при сальтаторном проведении. На рис. 4–12 приведена электронная микрофотография, на которой видна многослойная миелиновая оболочка, образуемая мембранами глиальных клеток. (Bunge et al., 1961.) |
Благодаря изолирующим свойствам миелиновой оболочки постоянная длины аксона резко возрастает: наличие этой оболочки оказывает такой же эффект, как и увеличение r
м [уравнение (6–2)]. Из–за высокого сопротивления миелиновой оболочки местные токи, текущие впереди от волны возбуждения, выходят из аксона почти исключительно в области перехватов Ранвье. Кроме того, поскольку емкость толстой миелиновой оболочки мала, на перезарядку этой емкости в участках между перехватами расходуется лишь очень небольшой ток.
Благодаря этим особенностям ПД, возникающий в каком–либо перехвате, электротонически деполяризует лишь мембрану, расположенную в области следующего перехвата, и поэтому импульсы в таких аксонах не распространяются по всей их длине, как в немиелинизированных нервных волокнах (например, в аксоне кальмара). Они возникают лишь в небольших участках мембраны –перехватах Ранвье. Все это обусловливает сальтаторное
(скачкообразное)
проведение,
при котором импульсы распространяются прерывисто от перехвата к перехвату (рис. 6–11). Скорость распространения. ПД при этом резко увеличивается, поскольку электротоническое проведение местных токов между перехватами осуществляется очень быстро. Таким образом, у позвоночных животных Природа решила проблему быстрого распространения нервных импульсов, не прибегая к созданию таких громоздких структур, как гигантские аксоны.
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Чаще всего, химический синапс образован между окончанием аксона одного нейрона и дендритом другого. Его работа напоминает… «переброс» эстафетной палочки, роль которой и играет нейромедиатор — химический посредник передачи сигнала [12], [42], [44–48].
На пресинаптическом окончании аксона ПД вызывает выброс нейромедиатора во внеклеточную среду — к принимающему нейрону. Последний только этого и ждет с нетерпением: в мембране дендритов рецепторы — ионные каналы определенного типа — связывают нейромедиатор, открываются и пропускают через себя разные ионы. Это приводит к генерации маленького постсинаптического потенциала (ПСП) на мембране дендрита. Он напоминает ПД, но значительно меньше по амплитуде и происходит за счет открывания других каналов. Множество этих маленьких ПСП, каждый от своего синапса, «сбегаются» по мембране дендритов к телу нейрона (зеленые стрелки на рис. 3а) и достигают начального сегмента аксона, где вызывают открывание Na-каналов и «провоцируют» его на генерацию ПД.
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Как это ни странно, выброс нейромедиатора в синапсе может и не произойти вовсе — это процесс вероятностный [18], [19]. Нейроны так экономят энергию: синаптическая передача и так обусловливает около половины всех энергозатрат нейронов [25]. Если бы синапсы всегда срабатывали, вся энергия пошла бы на обеспечение их работы, и не осталось бы ресурсов для других процессов. Более того, именно низкая вероятность (20–40%) выброса нейромедиатора соответствует наибольшей энергетической эффективности синапсов. Отношение количества полезной информации к затрачиваемой энергии в этом случае максимально [18], [19]. Так, выходит, что «неудачи» играют важную роль в работе синапсов и, соответственно, всего мозга. А за передачу сигнала при иногда «не срабатывающих» синапсах можно не беспокоиться, так как между нейронами обычно много синапсов, и хоть один из них да сработает.
Еще одна особенность синаптической передачи состоит в разделении общего потока информации на отдельные компоненты по частоте модуляции приходящего сигнала (грубо говоря, частоте приходящих ПД) [50]. Это происходит благодаря комбинированию разных рецепторов на постсинаптической мембране [38], [50]. Некоторые рецепторы активируются очень быстро: например, AMPA-рецепторы (AMPA происходит от α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid). Если на постсинаптическом нейроне представлены только такие рецепторы, он может четко воспринимать высокочастотный сигнал (такой, как, например, на рис. 2в). Ярчайший пример — нейроны слуховой системы, участвующие в определении местоположения источника звука и точном распознавании коротких звуков типа щелчка, широко представленных в речи [12], [38], [51]. NMDA-рецепторы (NMDA — от N—methyl-D—aspartate) более медлительны. Они позволяют нейронам отбирать сигналы более низкой частоты (рис. 2г), а также воспринимать высокочастотную серию ПД как нечто единое — так называемое интегрирование синаптических сигналов [14]. Есть еще более медленные метаботропные рецепторы, которые при связывании нейромедиатора, передают сигнал на цепочку внутриклеточных «вторичных посредников» для подстройки самых разных клеточных процессов. К примеру, широко распространены рецепторы, ассоциированные с G-белками. В зависимости от типа они, например, регулируют количество каналов в мембране или напрямую модулируют их работу [14].
Различные комбинации быстрых AMPA-, более медленных NMDA- и метаботропных рецепторов позволяют нейронам отбирать и использовать наиболее полезную для них информацию, важную для их функционирования [50]. А «бесполезная» информация отсеивается, она не «воспринимается» нейроном. В таком случае не приходится тратить энергию на обработку ненужной информации. В этом и состоит еще одна сторона оптимизации синаптической передачи между нейронами.
Скорость передачи нервного импульса
Не́рвный и́мпульс, распространение по нервным волокнам возбуждения (биоэлектрического импульса) в ответ на раздражение нейронов.
Во второй половине 19 века в работах Г. Гельмгольца и Э. Геринга на нерве лягушки было показано, что биоэлектрический сигнал (ток, или потенциал действия), в отличие от электрического тока в обычном проводнике, распространяется по нервному волокну с конечной скоростью (3-120 м/сек).
Возможность распространения нервных импульсов по нервным волокнам определяется их строением, напоминающим строение электрического кабеля, где роль проводника играют аксоны, а роль изолятора — миелиновая оболочка аксона, представляющая собой мембрану шванновской клетки, намотанную на аксон в несколько слоев.
Основной компонент миелиновой оболочки — липопротеид миелин, обладающий свойствами диэлектрика. Скорость распространения нервных импульсов зависит как от диаметра нервных волокон (чем толще волокно, тем выше скорость), так и от степени их электрической изоляции, так как покрытые миелином волокна при прочих равных условиях быстрее проводят нервные импульсы. Миелиновая оболочка покрывает волокно не непрерывно по всей его длине, а образует подобие изолирующих керамических «муфт», плотно нанизанных на аксон, как на стержень электрического кабеля.
Между соседними «муфтами» из миелина остаются лишь небольшие электрически неизолированные участки, через которые ионный ток может легко вытекать из аксона в наружную среду и обратно, раздражая мембрану и вызывая генерацию потенциала действия исключительно в неизолированных участках аксона, получивших название перехватов Ранвье. Нервный импульс распространяется по миелинизированному нервному волокну скачками — от одного перехвата Ранвье до следующего, что значительно повышает скорость распространения возбуждения от клетки к клетке.
Скорость распространения нервного импульса по толстым миелинизированным волокнам (диаметром 10-20 микрон) у человека достигает 70-120 м/сек, а по самым тонким немиелинизированным нервным волокнам — на два порядка ниже (менее 2 м/сек).
Способность вырабатывать нервные импульсы — одно из основополагающих свойств нейронов.
Нервные импульсы обеспечивают быстрое проведение однотипных сигналов (потенциалов действия) по аксонам на большие расстояния и поэтому являются важнейшим средством обмена информацией как между нервными клетками, так и между нервными и другими типами клеток. Информация о силе раздражения нервной клетки кодируется и передается другим клеткам путем изменения частоты следования нервных импульсов.
Частота следования может варьировать от единиц до сотни нервных импульсов в секунду. Частотный код предполагает сложную периодику следования нервных импульсов, в том числе группирование их в «пачки» с разным числом и характером следования сигналов. Сложная пространственная и временная суммация нервных импульсов составляет основу ритмической электрической активности мозга, регистрируемой с помощью электроэнцефалограммы.
Скорость распространения нервных импульсов может быть различной: меньше 1 метра в секунду в очень тонких аксонах и около 100 метров в секунду в толстых аксонах {например, в аксонах, иннервирующих мышцы).
Распространяющийся по аксону электрический импульс, доходя до окончаний аксона на другой нервной клетке, внезапно исчезает. Чарлз Шеррингтон, заложивший основы так называемой синаптологии, назвал точки контакта окончаний аксона с другой нервной клеткой «синапсами».
Для того чтобы «перейти» через синапс, нервный импульс должен быть заново генерирован по другую сторону синапса. Еще 15 лет назад некоторые физиологи считали, что передача импульса через синапс — явление в основном (если не полностью) электрического порядка. Теперь, однако, имеются многочисленные доказательства того, что при такой передаче происходит выделение особых веществ, вызывающих регенерацию импульса. Первое убедительное доказательство того, что в синапсе действует вещество-передатчик, было получено более 40 лет назад Г. Дейлом и О. Лёви.
Как известно, центральная нервная система человека (включая, конечно, не только головной мозг, но и спинной) состоит примерно из 10 миллиардов (1010) нервных клеток. Почти все нервные клетки, за редким исключением, получают информацию непосредственно в форме импульсов (смотрите рисунок ниже) сразу от нескольких нервных клеток (нередко от сотен их) и передают ее столь же большому числу клеток.
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
При изучении патологий внимание уделяют и синаптической передаче как наиболее энергозатратному процессу [19]. Например, при болезнях Паркинсона [56], Хантингтона [57], Альцгеймера [58–61] происходит нарушение работы или транспорта к синапсам митохондрий, играющих основную роль в синтезе АТФ [62], [63]. В случае болезни Паркинсона, это может быть связано с нарушением работы и гибелью высоко энергозатратных нейронов черной субстанции, важной для регуляции моторных функций, тонуса мышц. При болезни Хантингтона, мутантный белок хангтингтин нарушает механизмы доставки новых митохондрий к синапсам, что приводит к «энергетическому голоданию» последних, повышенной уязвимости нейронов и избыточной активации. Все это может вызвать дальнейшие нарушения работы нейронов с последующей атрофией полосатого тела и коры головного мозга. При болезни Альцгеймера нарушение работы митохондрий (параллельно со снижением количества синапсов) происходит из-за отложения амилоидных бляшек. Действие последних на митохондрии приводит к окислительному стрессу, а также к апоптозу — клеточной гибели нейронов.
Возбуждение и торможение нервной клетки
Возбуждение и торможение нервной клетки осуществляют нервные волокна, образующие синапсы на ее поверхности.
Вверху (1) двигательный нейрон в состоянии покоя. Импульсы, приходящие по одному возбуждающему волокну (2), еще не в состоянии вызвать разряд двигательного нейрона. Разряд возникает только тогда, когда импульсы приходят и по второму возбуждающему волокну (3) (пороговое состояние нейрона). Если нейрон получает еще и импульсы по тормозному волокну, то он возвращается в подпороговое состояние (4).
Внизу (б) — импульсы приходят только по тормозному волокну. Электрические импульсы, распространяющиеся по возбуждающим и тормозным нервным волокнам, не отличаются друг от друга. Их противоположное действие объясняется выделением в синаптических окончаниях разных химических передатчиков.
В данной нервной клетке в зависимости от ее порога возбуждения может возникнуть разряд импульсов при раздражении всего лишь нескольких приходящих к ней волокон; в других же случаях разряд импульсов не возникает даже при раздражении многих таких волокон.
Давно известно, что различные факторы способны повышать или понижать порог возбуждения нервной клетки.
Более того, примерно 60 лет назад было высказано предположение, что некоторые волокна должны тормозить разряд импульсов в клетке, к которой они подходят, а не возбуждать ее. Предположение это впоследствии подтвердилось, и в настоящее время механизм торможения выяснен. Двум равноценным процессам — торможению и его антиподу — возбуждению нервной клетки — и посвящена данная статья.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Содержание:
- 1 Мембранный потенциал
- 2 Импульс
- 3 Синаптическая передача
- 4 Типичный нейронный путь
Описание
Значительную часть нейробиологии
составляют разделы о том, как работают отдельные нейроны и как информация передается от клетки к клетке через синапсы. Должно быть очевидным, что без этих сведений мы окажемся в положении человека, желающего понять работу радиоприемника или телевизора, но ничего не знающего о резисторах, конденсаторах и транзисторах. За последние десятилетия благодаря изобретательности ряда нейрофизиологов, из которых наиболее известны Эндрю Хаксли, Алан Ходжкин, Бернард Катц, Джон Экклз и Стивен Куффлер, были хорошо изучены физико-химические механизмы проведения нервных импульсов и синаптической передачи. Однако столь же очевидно, что сведения такого рода сами по себе еще не могут привести к пониманию работы мозга, подобно тому как одни лишь сведения о резисторах, конденсаторах и транзисторах не позволят понять работу радиоприемника или телевизора, а знание химии чернил — прочитать пьесу Шекспира.
Эту статью я начинаю с суммирования части того, что нам известно о нервном проведении и синаптической передаче.
Большой подмогой в верном понимании существа дела будет знание основ физической химии и электричества, но я думаю, что и без этого читатель сможет получить о предмете достаточное представление. В любом случае для того, чтобы следить за изложением в последующих главах, вам понадобится лишь элементарное понимание этих вопросов.
Задача нервной клетки
состоит в том, чтобы принимать информацию от клеток, которые ее передают, суммировать, или интегрировать, эту информацию и доставлять интегрированную информацию другим клеткам. Информация обычно передается в форме кратковременных процессов, называемых нервными импульсами. Во всякой клетке каждый импульс бывает точно таким же, как и любой другой, т. е. импульс — это стереотипный процесс. В любой момент частота импульсов, посылаемых нейроном, определяется сигналами, только что полученными им от передающих клеток, и передает информацию клеткам, по отношению к которым этот нейрон является передающим. Частота импульсов варьирует от одного в каждые несколько секунд или еще ниже до максимума около тысячи в секунду.
↑ Мембранный потенциал
Что происходит, когда информация передается от одной клетки к другой через синапс?
В первой — пресинаптической — клетке около основания аксона возникает электрический сигнал, или импульс. Импульс перемещается по аксону к его окончаниям. Из каждого окончания в результате этого импульса в узкий (0,02 мкм) заполненный жидкостью промежуток, отделяющий одну клетку от другой, — синаптическую щель — высвобождается химическое вещество, которое диффундирует ко второй — постсинаптической — клетке. Оно влияет на мембрану этой второй клетки таким образом, что вероятность возникновения в ней импульсов либо уменьшается, либо возрастает. После этого краткого описания вернемся назад и рассмотрим весь процесс подробно.
Рис. 8.
Схема расположения нервных клеток на поперечом срезе сетчатки, нарисованная Сантьяго Рамон-и-Кахалом, величайшим нейроанатомом всех времен. От верхнего слоя, где показаны более тонкие палочки и более толстые колбочки, до нижнего, где направо выходят волокна зрительного нерва, толщина сетчатки составляет четверть миллиметра.
Нервная клетка омывается солевым раствором и содержит его внутри. В число солей входит не только хлористый натрий, но также хлористый калий, хлористый кальций и ряд других, менее обычных солей. Поскольку большинство молекул соли диссоциировано, жидкости как внутри, так и снаружи клетки содержат ионы хлора, калия, натрия и кальция (Cl-, К+, Na+ и Са2+).
В состоянии покоя электрические потенциалы внутри и снаружи клетки различаются примерно на одну десятую долю вольта, причем плюс находится снаружи. Точное значение ближе к величине 0,07 вольта, или 70 милливольт. Передаваемые нервами сигналы представляют собой быстрые изменения потенциала, перемещающиеся по волокну от тела клетки к окончаниям аксона. Я начну с описания того, как на клеточной мембране возникает разность потенциалов.
Рис. 9.
На этой электронной микрофотографии (срез коры мозжечка крысы) синапс выглядит как узкая темная полоска в нижней части рисунка посередине. Слева от синапса можно видеть поперечное сечение аксона, заполненного мельчайшими круглыми синаптическими пузырьками, в которых хранится нейромедиатор. Справа от синапса виден выступ дендрита (называемый шипиком); он отходит от крупной дендритной ветви, расположенной горизонтально в верхней части рисунка (два темных колбасовидных образования в этом дендрите — митохондрии). В синапсе сближены две мембраны — мембраны аксона и дендрита; здесь они утолщены и выглядят более плотными. Их разделяет щель шириной 20 нанометров.
Мембрана нервной клетки, покрывающая весь нейрон
, — структура чрезвычайно сложная. Она не сплошная, как надувной шарик или шланг, а содержит миллионы «пор», через которые вещества могут переходить с одной стороны на другую. Некоторые из них — это действительно поры различной величины; как сейчас выяснилось, они представляют собой белки в форме трубок, насквозь пронизывающих жировое вещество мембраны. В других случаях это не просто поры, а миниатюрные белковые механизмы, называемые насосами; они способны улавливать ионы одного типа и выбрасывать их из клетки, одновременно захватывая другие ионы внутрь из наружного пространства. Такая перекачка требует затраты энергии, которую клетка в конечном счете получает в процессе окисления глюкозы. Существуют также поры, называемые каналами, — это «клапаны», которые могут открываться и закрываться. Какие воздействия приводят к их открытию или закрытию, зависит от типа пор. На некоторые из них влияет мембранный потенциал, другие открываются или закрываются при наличии определенных веществ во внутренней и наружной жидкости.
Разность потенциалов на мембране в любой момент определяется концентрацией ионов внутри и снаружи, а также тем, открыты или закрыты различные поры. (Выше я говорил, что потенциал влияет на поры, а теперь утверждаю, что поры влияют на потенциал. Давайте пока просто скажем, что эти две вещи могут быть взаимозависимы. Несколько позже будет дано более детальное объяснение.) Так как имеется несколько видов пор и несколько видов ионов, легко понять, что вся система довольно сложна. Когда Ходжкин и Хаксли в 1952 году сумели разобраться в ней, это было огромным достижением. Зададимся прежде всего вопросом: как создается разность потенциалов?
Предположим, что вначале никакой разности нет и концентрации ионов внутри и снаружи одинаковы. Пусть далее включается насос, который выводит из клетки ионы одного вида, например натрия, и вместо каждого выведенного иона переносит внутрь ион другого вида, например калия. Сам по себе насос не создает какого-либо потенциала, так как сколько положительно заряженных ионов накачивается внутрь, столько же и откачивается (ионы натрия и калия несут одинаковые положительные заряды). Но представим теперь, что по какой-то причине открылось большое число пор одного типа, например калиевых. Ионы калия начнут перетекать по ним, причем скорость потока через каждую открытую пору будет зависеть от концентрации калия: чем больше ионов возле отверстия поры, тем больше будет их утечка через мембрану; а так как внутри ионов калия больше, чем снаружи, то выходить их будет больше, чем входить внутрь. Но если выходит больше зарядов, чем входит, наружное пространство быстро станет электроположительным по отношению к внутреннему. Это накопление положительного заряда снаружи вскоре начнет противодействовать дальнейшему выходу ионов калия из клетки, так как одноименные заряды отталкивают друг друга.
Очень быстро — прежде чем выход ионов К4 приведет к заметному изменению их концентрации — положительный заряд снаружи достигнет величины, при которой он в точности скомпенсирует тенденцию ионов К+ выходить из клетки (с внутренней стороны поры ионов калия больше, но они отталкиваются наружным зарядом). Начиная с этого момента перемещение заряда прекращается, и мы говорим, что система приходит в равновесие. Таким образом, открытие калиевых пор приводит к возникновению на мембране разности потенциалов с положительным полюсом снаружи.
Но предположим, что вместо этого открылись натриевые поры. Повторяя все рассуждения с заменой слов «внутренний» на «наружный», вы можете легко убедиться, что результат будет прямо противоположным: снаружи возникнет отрицательный заряд. При одновременном открытии пор того и другого типа езультат был бы «компромиссным». Для оценки величины мембранного потенциала мы должны знать относительные концентрации двух ионов и отношение числа открытых и закрытых пор для каждого иона, а затем произвести соответствующие расчеты.