Болезнь мотонейрона — это прогрессирующее неврологическое заболевание, которое разрушает моторные нейроны, клетки, контролирующие мышечную активность человека, а именно, такие действия как ходьба, дыхание и глотание. Обычно сигналы от нервных клеток в головном мозге (называемые верхними двигательными нейронами) передаются нервным клеткам в стволе мозга и спинном мозге (называемом более низкими двигательными нейронами) и от них к конкретным мышцам. Верхние нейроны направляют нижние двигательные нейроны для выполнения движений, таких как ходьба или жевание. Нижние двигательные нейроны контролируют движение в руках, ногах, туловище, лице, горле и языке. Спинные двигательные нейроны также называют передними роговыми клетками. Верхние моторные нейроны также называются кортикоспаническими нейронами.
Когда возникают сбои при передаче сигналов между нижними двигательными нейронами и конкретной мышцей, мышца не работает должным образом; мышцы постепенно ослабевают, могут развиться неконтролируемые подергивания (так называемые фасцикуляции). При нарушениях передачи сигналов между верхними двигательными нейронами и нижними моторными нейронами в мышцах конечностей развивается спастичность (жесткость), движения становятся медленными и напряженными, а сухожильные рефлексы, в коленных и голеностопных суставах, становятся сверхактивными. Со временем способность контролировать произвольные движения может быть утрачена.
Формы болезни мотонейронов
Болезни моторных нейронов классифицируются в зависимости от того, являются ли они наследуемыми или спорадическими, и зависит ли патология от верхних моторных нейронов или нижних моторных нейронов.
У взрослых наиболее распространенной формой болезни является боковой амиотрофический склероз (БАС), который поражает как верхние, так и нижние моторные нейроны. Болезнь имеет наследственные и спорадические формы и может затрагивать руки, ноги или мышцы лица.
Первичный боковой склероз является заболеванием верхних моторных нейронов, тогда как прогрессирующая мышечная атрофия затрагивает только более нижние двигательные нейроны в спинном мозге.
При прогрессирующем бульбарном параличе наиболее поражаются самые нижние двигательные нейроны ствола мозга, вызывающие такие симптомы, как невнятная речь, трудности при жевании и глотания.
Что такое болезнь двигательного нейрона
Болезнь двигательного нейрона (БДН) — это прогрессирующее нейродегенеративное заболевание, которое поражает двигательные нейроны в головном и спинном мозге. Постепенная гибель клеток нервной системы приводит к неуклонно нарастающей мышечной слабости, охватывающей все группы мышц.
Двигательные нейроны
Нейроны головного мозга, которые отвечают за движения (верхние двигательные нейроны), находятся в коре полушарий. Их отростки (аксоны) спускаются в спинной мозг, где происходит контакт с нейроном спинного мозга. Этот контакт называется синапс. В области синапса нейрон головного мозга выделяет из своего отростка химическое вещество (медиатор), которое передает сигнал нейрону спинного мозга.
Нейроны спинного мозга (нижние двигательные нейроны) располагаются в нижних отделах головного мозга (бульбарный отдел), а также шейном, грудном или поясничном отделах спинного мозга в зависимости от того, к каким мышцам они направляют свои сигналы. Эти сигналы по отросткам нейронов спинного мозга (аксонам) доходят до мышц и управляют их сокращениями. Нейроны бульбарного отдела отвечают за сокращение мышц, связанных с речью, жеванием и глотанием; шейного отдела — за сокращение диафрагмы, движения рук; грудного отдела — за движения туловища; поясничного отдела — за движения ног.
Проявления поражения двигательных нейронов
- При поражении нейронов спинного мозга нарастает мышечная слабость, мышцы худеют (атрофия), в них появляются непроизвольные подергивания (фасцикуляции). Фасцикуляции не просто ощущаются как подергивания, их также можно увидеть. Это похоже на подкожное трепетание мышц.
- Если затронуты нейроны головного мозга, мышцы становятся слабыми, но при этом появляется скованность (спастичность), то есть повышается тонус мышц, их становится трудно расслабить.
- При поражении одновременно нейронов головного и спинного мозга эти признаки могут встречаться в разных сочетаниях. То есть мышечная слабость может сопровождаться как фасцикуляциями и похудением мышц, так и скованностью.
- Смотря какие отделы головного и спинного мозга оказываются пораженными, данные признаки могут появляться в мышцах, ответственных за движения рук, ног, дыхание или глотание.
Симптомы болезней мотонейронов
Ниже приводится краткое описание симптомов некоторых из наиболее распространенных форм болезней двигательных нейронов.
Боковой амиотрофический склероз (БАС), также называемый болезнью Лу Герига или классической болезнью моторных нейронов, является прогрессирующим, в конечном счете имеющим смертельный исход заболеванием, которое нарушает передачу сигналов во всех мышцах организма. Многие врачи используют термины «болезнь моторных нейронов» и БАС как взаимозаменяемые. Причиной болезни являются нарушения как верхних, так и нижних двигательных нейронов. Первые симптомы обычно отмечаются в руках и ногах или в мышцах, отвечающих за глотание. Примерно у 75 процентов больных классическим БАС развиваются слабость бульбарных мышц (мышцы, которые контролируют речь, глотание и жевание). Мышечная слабость и атрофия происходят по обе стороны тела. Больные теряют силу и способность двигать руками и ногами и удерживать тело в вертикальном положении. Другие симптомы включают в себя спастичность мышц, спазмы, мышечные судороги. Речь может стать невнятной или гортанной. Когда мышцы диафрагмы и грудной стенки не функционируют должным образом, больные теряют способность дышать без механической поддержки. Хотя болезнь как правило не нарушает интеллектуальные способности человека или личности, отдельные недавние научные исследования показывают, что у некоторые больных БАС могут развиваться когнитивные (умственные) нарушения. Большинство людей, страдающих боковым амиотрофическим склерозом, умирают от респираторной недостаточности, обычно через 3 — 5 лет с момента появления симптомов. Однако около 10 процентов больных выживают в течение 10 или более лет.
Прогрессивный бульбарный паралич, также называемый прогрессирующей атрофией бульбарной группы черепно-мозговых нервов, воздействует на нижние двигательные нейроны, отвечающие за такие действия, как глотание, речь, жевание и другие. Симптомы включают в себя слабость языкоглоточной мышцы, челюстной и лицевых мышц, прогрессирующую потерю функции речи и атрофию мышц языка. Слабость конечностей при заболевании с признаками повреждения двигательного нейрона почти всегда очевидна, но менее заметна. Люди подвержены повышенному риску удушья и аспирационной пневмонии, вызванной прохождением жидкостей и пищи через нижние дыхательные пути и легкие. У пострадавших присутствуют эмоциональные вспышки смеха или плача (называемые эмоциональной лабильностью). Инсульт и миастения могут иметь определенные симптомы, сходные с симптомами прогрессирующего бульбарного паралича и должны быть исключены при диагностике этого заболевания. Примерно у 25 процентов людей с БАС ранние симптомы начинаются с сопутствующим участием бульбарных нарушений. Многие клинические врачи считают, что прогрессирующий бульбарный паралич сам по себе, без признаков патологий в конечностях (руках или ногах), встречается крайне редко.
Псевдобульбарный паралич, имеющие многие симптомы, аналогичные прогрессирующему бульбарному параличу, характеризуется дегенерацией верхних моторных нейронов, которые передают сигналы нижним моторным нейронам в стволе мозга. У больных развивается прогрессирующая потеря способности говорить, жевать и глотать, а также прогрессивная слабость лицевых мышц. У больных могут развиться голосовые нарушения и повышенный рефлекс кляпа. Язык может стать неподвижным и потерять способность выступать из рта.
Первичный боковой склероз (ПБС) повреждает верхние двигательные нейроны рук, ног и лица. Это происходит, когда специфические нервные клетки в моторных областях коры головного мозга (тонкий слой клеток, покрывающих мозг, который отвечает за большинство функций мозга на высоком уровне) постепенно вырождаются, заставляя движения быть медленными. Болезнь часто затрагивает сначала ноги, а затем туловище, руки и, наконец, бульбарные мускулы. Речь может становится замедленной и вызывать сложности. При поражении нервных клеток движения ног и рук становятся неуклюжими, медленными и слабыми, возникает спастичность, что приводит к невозможности ходить или выполнять задачи, требующие точной координации рук. Проблемы с равновесием могут привести к падению. Речь может стать медленной и невнятной. Больные обычно испытывают псевдобульбарный аффект и чрезмерно активный ответ. Первичный боковой склероз чаще встречается у мужчин, чем у женщин, начало болезни обычно происходит между 40 и 60 годами. Причина заболевания неизвестна. Симптомы прогрессируют постепенно в течение многих лет, что приводит к прогрессивной жесткости (спастичности) и неуклюжести пораженных мышц. ПБС иногда считается формой бокового амиотрофического склероза, но основное отличие заключается в сохранении более низких моторных нейронов, медленной скорости прогрессирования заболевания и нормальной продолжительности жизни. Первичный боковой склероз может ошибочно приниматься за спастические параплегии, наследственное расстройство верхних моторных нейронов, которое вызывает спазм в ногах и как правило начинается в подростковом возрасте. Большинство неврологов следуют клиническому течению пострадавшего человека в течение как минимум 3-4 лет, прежде чем поставить диагноз. Данное заболевание не смертельно, но может оказывать влияние на качество жизни.
Прогрессивная мышечная атрофия характеризуется медленной, но прогрессирующей дегенерацией исключительно нижних моторных нейронов. Заболеванию подверждены в значительной степени мужчины, с началом заболевания раньше, чем при других болезнях мотонейронов. Слабость обычно возникает сначала в руках, а затем распространяется в нижнюю часть тела, где она может быть в более тяжелой форме. Другие симптомы могут включать в себя мышечное истощение, неуклюжие движения рук и мышечные судороги. Могут пострадать мышцы, отвечающие за дыхание. Воздействие холода может ухудшить симптомы. Болезнь развивается совместно с БАС во многих случаях.
Спинальная мышечная атрофия (СМА) является наследственной болезнью, воздействующей на нижние двигательные нейроны. Это аутосомно-рецессивное заболевание, причиной которого являются нарушения в гене SMN1 (ген ответственный за производтсво белка, который важен для функционирования моторных нейронов (SMN-белок)). При СМА недостаточный уровень белка SMN приводят к дегенерации нижних моторных нейронов, вызывая слабость и истощение скелетных мышц. Слабость часто более выражена в мышцах рук и ног, а также в мышцах туловища. Спинальная мышечная атрофия у детей подразделяется на три типа, исходя из возраста начала, тяжести и прогрессирования симптомов. Все три типа вызваны дефектами в гене SMN1.
Синдром постполиомиелита (СПП) — это состояние, которое может поражать больных, перенесших полиомиелит, что может произойти в течение десятилетий после их выздоровления от полиомиелита. Полиомиелит — острое вирусное заболевание, которое разрушает моторные нейроны. Многие люди, пострадавшие от заболевания на ранней стадии жизни, восстанавливаются, а новые симптомы возникают спустя много десятилетий. После острого полиомиелита выжившие двигательные нейроны отвечают за большее количество мышц, которые они контролируют. Считается, что синдром постполиомиелита и постполиотическая мышечная атрофия возникают, когда выжившие моторные нейроны утрачиваются в процессе старения или вследствие травмы/болезни. Многие ученые считают, что СПП является скрытым симптомом слабости мышц, ранее пораженных полиомиелитом, а не новой болезнью моторных нейронов. К симптомам относится усталость, медленно прогрессирующая мышечная слабость, мышечная атрофия, непереносимость холода, боль в мышцах и суставах. Эти симптомы чаще всего проявляются среди групп мышц, пораженных начальным заболеванием, и могут состоять из проблем при дыхании, глотании или во время сна. Другие симптомы СПП могут быть вызваны скелетными деформациями, такими как давно сформировавшийся сколиоз, которые привели к хроническим изменениям в биомеханике суставов и позвоночника. Симптомы чаще встречаются у пожилых людей и тех лиц, которые в наибольшей степени страдают от более раннего заболевания. У некоторых людей наблюдаются только незначительные симптомы, в то время как у других развивается мышечная атрофия, которую можно ошибочно диагностировать как БАС. СПП как правило не угрожает жизни больного. По медицинской статистике, у 25 — 50 процентов перенесших паралитический полиомиелит обычно развивается синдром постполиомиелита.
Диагностика болезни моторных нейронов
Не существует каких-либо специальных исследований для диагностики большинства болезней мотонейронов, хотя в настоящее время существуют генетическое тестирование для генов SMA. Симптомы могут различаться у больных и на ранних стадиях заболевания могут быть похожими на симптомы других заболеваний, что затрудняет диагностику. За физическим осмотром следует тщательное неврологическое обследование. Неврологические тесты будут оценивать двигательные и сенсорные навыки, функционирование нервной системы, слух и речь, зрение, координацию и равновесие, психическое состояние и изменения настроения или поведения.
Исследования для исключения других заболеваний или измерения степени поражения мышц, могут включать следующие:
Электромиография (ЭМГ) используется для диагностики расстройств нижних моторных нейронов, а также нарушений мышц и периферических нервов. При ЭМГ врачом вводится тонкий игольчатый электрод, прикрепленный к регистрирующему инструменту, в мышцу для оценки электрической активности во время произвольного сокращения и в состоянии покоя. Электрическая активность в мышце вызвана более нижними двигательными нейронами. Когда двигательные нейроны утрачиваются, в мышце возникают характерные аномальные электрические сигналы. Тестирование обычно длится около часа или более, в зависимости от количества тестируемых мышц и нервов.
ЭМГ как правило проводится в сочетании с исследованием скорости нервной проводимости. Исследования нервной проводимости измеряет скорости передачи импульсов в нервах от небольших электродов, прикрепленных к коже, а также их силу. Небольшой импульс электричества (подобный толчке от статического электричества) стимулирует нерв, который отвечает за конкретную мышцу. Второй комплект электродов передает ответный электрический сигнал на записывающее устройство. Исследования нервной проводимости помогают дифференцировать болезни нижних моторных нейронов от периферической невропатии и могут обнаруживать нарушения в сенсорных нервах.
Лабораторные анализы крови, мочи и других веществ позволяют исключить мышечные заболевания и другие расстройства, которые могут иметь симптомы, сходные с симптомами болезни мотонейронов. Например, анализ спинномозговой жидкости, которая окружает мозг и спинной мозг, может обнаруживать инфекции или воспаление, которые также могут вызывать мышечную жесткость. Анализы крови могут назначаться для измерения уровней белковой креатинкиназы (необходима для химических реакций, которые вырабатывают энергию для мышечных сокращений); высокие уровни позволяют диагностировать мышечные заболевания, такие как мышечная дистрофия.
Магнитно-резонансная томография (МРТ) использует мощное магнитное поле для получения детальных изображений тканей, органов, костей, нервов и других структур тела. МРТ часто используется для исключения болезни, которые воздействуют на голову, шею и спинной мозг. МРТ-изображения позволяют диагностировать опухоли головного и спинного мозга, заболевания глаз, воспаление, инфекцию и сосудистые нарушения, которые могут привести к инсульту. МРТ также может обнаруживать и контролировать воспалительные заболевания, такие как рассеянный склероз. Магнитно-резонансная спектроскопия — это тип МРТ-сканирования, который измеряет уровень химических веществ в головном мозге и может использоваться для оценки целостности верхних моторных нейронов.
Биопсия мышц или нервов позволяет подтвердить наличие неврологических нарушений, в частности нарушения регенерации нервов. Небольшой образец мышечной или нервной ткани берется под местным анестетиком и исследуется под микроскопом. Образец может быть удален хирургическим путем через разрез на коже или путем биопсии, при которой тонкая полая игла вводится через кожу в мышцу. Небольшая часть мышечной ткани остается в полой игле, когда она удаляется из тела. Хотя это исследование может предоставить ценную информацию о степени повреждения, это инвазивная процедура, и многие эксперты считают, что биопсия не всегда необходима для диагностики.
Транскраниальная магнитная стимуляция была впервые разработана как диагностический инструмент для изучения областей головного мозга, связанных с двигательной активностью. Она также используется в качестве лечения некоторых заболеваний. Эта неинвазивная процедура создает магнитный импульс внутри мозга, который вызывает двигательную активность в области тела. Электроды, прикрепленные к различным областям тела, собирают и регистрируют электрическую активность в мышцах. Меры вызванной активности могут диагностировать двигательную нервную дисфункцию при болезни мотонейронов или в мониторинге прогрессирования заболевания.
Немоторные проявления болезни Паркинсона
С.Н. Иллариошкин доктор медицинских наук, профессор, заместитель директора по научной работе
ГУ НЦ неврологии РАМН
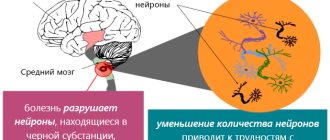
В нашем журнале мы уже неоднократно обращались к теме болезни Паркинсона, что обусловлено высокой распространенностью данного страдания в популяции, особенно у лиц старшей возрастной группы. Однако это заболевание настолько многогранно, а прогресс последних лет в изучении механизмов развития и методов терапии паркинсонизма настолько впечатляющ, что всё новые аспекты этиологии, клиники, диагностики, лечения и профилактики болезни Паркинсона привлекают внимание врачей, ученых и общества в целом. В настоящее время хорошо известно, что в основе болезни Паркинсона лежит поражение особых пигментированных («черных») клеток среднего мозга, синтезирующих вещество дофамин.
Дофамин — это основной медиатор центральной нервной системы, регулирующий двигательные функции. Снижение интенсивности дофаминовой передачи импульсов в соответствующих проводящих путях рассматривается как главный биохимический и нейрофизиологический «субстрат» болезни Паркинсона. Таких основных путей в головном мозге три.
Первый дофаминзависимый путь — нигростриарный (от лат. nigros — черный и stria — полоска). Этот путь, как следует из названия, ведет от пигментированных дофаминовых нейронов к полосатому телу — скоплению двигательных нервных клеток в глубоких отделах мозга, имеющему характерную полосатую исчерченность при микроскопии. Именно дегенерация нигростриарного пути ответственна за основные и хорошо изученные двигательные проявления болезни Паркинсона — малоподвижность, скованность различных групп мышц и тремор покоя.
Второй дофаминовый путь, также начинающийся в среднем мозге — мезолимбический (от лат. meso — средний). Он ведет к так называемой лимбической системе — эволюционно древней структуре в основании мозга, отвечающей за обоняние и эмоции. Дегенерация мезолимбического пути при болезни Паркинсона сопровождается нарушением функции обоняния (весьма ранний симптом заболевания) и разнообразными нарушениями в эмоционально-волевой сфере.
Среди последних ведущее место принадлежит депрессии. Депрессия считается практически облигатным симптомом болезни Паркинсона, она значительно затрудняет ведение пациентов и уход за ними, проведение необходимых реабилитационных мероприятий. Во многих случаях именно депрессия является первым проявлением нейродегенеративного процесса при первичном паркинсонизме.
Третий дофаминовый путь в мозге, который также страдает при патологии дофамин-продуцирующих клеток — мезокортикальный, ведущий к коре больших полушарий. Дегенерация этого пути является причиной развития нарушений познавательных (когнитивных) функций при болезни Паркинсона — памяти, абстрактного мышления, временно-пространственной ориентировки и т.д. В наиболее тяжелых случаях, обычно имеющих место на поздних стадиях заболевания, у пациентов может развиваться деменция — выраженное снижение когнитивных способностей, приводящее к социально-бытовой и профессиональной дезадаптации.
Хорошо известны и другие немоторные (то есть не связанные с двигательной сферой) проявления болезни Паркинсона — вегетативные нарушения (запоры, потливость, сальность кожных покровов), расстройства сна, снижение артериального давления. В целом патогенез немоторных проявлений чрезвычайно сложен и связан не только с дофамином, но и с рядом других медиаторов нервной системы. Следует подчеркнуть, что во многих случаях немоторные проявления болезни являются ведущей причиной инвалидизации больных. Например, расстройства мочеиспускания, сна и другие ночные симптомы могут, по оценке самих пациентов, служить главными факторами снижения качества жизни, а наступление деменции, помимо возникающих социальных проблем, является противопоказанием для применения хирургических подходов к лечению болезни (операции на глубоких ядерных структурах головного мозга).
Таким образом, своевременное выявление немоторных проявлений болезни Паркинсона и их адекватное, максимально раннее лечение представляет собой важнейшую задачу современной клинической неврологии.
Медикаментозное лечение болезни Паркинсона предполагает использование препаратов различных классов, воздействующих на разные «мишени» патологического процесса. Так, «золотым стандартом» лечения являются препараты леводопы — биологического предшественника дофамина; заместительная терапия леводопой позволяет компенсировать недостаток дофамина в головном мозге и улучшить двигательные возможности пациентов. В клинике широко применяются также препараты, воздействующие непосредственно на рецепторы дофамина (агонисты дофаминовых рецепторов); важное место занимают препараты, влияющие на метаболизм дофамина и некоторых других медиаторов мозга. Однако, к сожалению, все эти средства направлены в основном на двигательную сферу и практически не влияют на немоторные проявления болезни Паркинсона и, самое главное, не способствуют замедлению прогрессирования нейродегенеративного процесса. Именно поэтому внимание исследователей сегодня сконцентрировано на поиске лекарственных соединений, позволяющих видоизменять течение болезни, оказывать защитное действие в отношении гибнущих нейронов (нейропротекция) и при этом способствовать уменьшению выраженности резистентных к лечению немоторных симптомов.
К числу таких препаратов принадлежат амантадины — достаточно давно известные противопаркинсонические средства, значение которых в последнее время было как бы «переоткрыто» благодаря выявленным уникальным молекулярным механизмам действия и нейропротективным (защитным) свойствам. Амантадины (ПК-Мерц, мидантан и др.) характеризуются комплексным эффектом: они усиливают выделение дофамина в межклеточное пространство и замедляют его обратный захват, стимулируют рецепторы дофамина, действуют также и на другие медиаторы (ацетилхолин) и т.д. Препарат ПК-Мерц (амантадина сульфат) имеет ряд преимуществ перед другими представителями данного класса, в том числе за счет возможности внутривенного введения и, следовательно, более эффективного лечения декомпенсаций болезни Паркинсона. Было показано, что амантадины специфически блокируют рецепторы глутамата — возбуждающего нейромедиатора, избыток которого наблюдается при болезни Паркинсона и способствует повреждению нейронов. Токсическое действие глутамата является важнейшим фактором нейродегенерации, поэтому применение амантадиновых соединений может иметь превентивный эффект и замедлять прогрессирование болезни.
Совсем недавно группой исследователей из Израиля и Италии было представлено убедительное подтверждение нейропротективного действия амантадина. Ученые сравнили частоту развития деменции — важнейшего немоторного проявления болезни Паркинсона — у больных, получавших и не получавших амантадин. Оказалось, что на фоне приема амантадина имело место достоверно более медленное снижение умственных способностей, а выраженность когнитивных нарушений у больных, использовавших для лечения амантадин, была меньше по сравнению с больными, не принимавшими амантадин. Таким образом, применение амантадина способствует задержке появления симптомов деменции у пациентов с болезнью Паркинсона, а также уменьшает ее тяжесть. Интересно отметить, что аналогичное действие при другом нейродегенеративном заболевании (хорее Гентингтона) отмечено и для одного из аналогов амантадина — мемантина.
Можно заключить, что внедрение в практику «антиглутаматных» препаратов означает начало новой главы в неврологии, связанной с воздействием на механизмы прогрессирования нейродегенеративных заболеваний.
© Журнал «Нервы», 2007, №1
наверх