Нейролептики
При попытках классифицировать нейролептики ученые в первую очередь отталкиваются от их химического строения:
- алифатические фенотиазины — препараты, у которых антипсихотическая активность выражена слабо, они направлены на седацию (успокаивают, помогают уснуть);
- бутирофеноны (популярный галоперидол) — мощные антипсихотики, у которых седативного эффекта почти нет, они купируют галлюцинации и бред;
- дибензазепины отличаются слабыми побочными эффектами, лучше сочетаются с другими препаратами, но почти не обладают успокаивающим действием, направлены на купирование психотических проявлений;
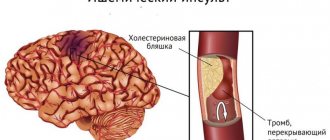
- производные фенотиазина снимают болевой синдром, назначаются при поврежденных сосудах, тромбофилите.
Нейролептики или антипсихотики бывают атипичными или типичными, пролонгированного действия или не пролонгированного. Типичные нейролептики — устаревшие препараты, которые отлично справляются со снятием психотических симптомов, но отличаются высокой вероятностью побочных действий. Атипичные — современный вариант антипсихотиков, позволяющий снизить риски побочных эффектов до минимума. Антипсихотики пролонгированного действия оказывают длительное действие, их эффект заметен на протяжении 20-30 дней. Их не принимают ежедневно.
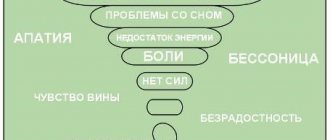
Нейролептики устраняют сильный страх, тревоги, ажитацию, улучшают сон. Их используют при тяжелых психотических депрессиях, дозировка невысокая. Нейролептики назначают чаще пациентам с психозами, сочетающимися с психомоторным возбуждением. Реже используются при апатии, вялости.
Назначение нейролептиков детям — спорный вопрос в психиатрии. Наблюдается недостаток данных доказательной медицины по поводу этого вопроса. Поэтому пациентам детского возраста антипсихотики назначаются, но редко, с осторожностью и в небольших дозировках.
Антидепрессанты: почему мы можем ошибаться в их эффективности и безопасности?
Введение
Депрессия становится одним из наиболее распространенных заболеваний, ухудшающих качество и продолжительность жизни, а также приводящих к инвалидности. [1] Указанные факторы предопределяют поиск средств для профилактики и лечения депрессивных расстройств. Среди них выделяют медикаментозные и немедикаментозные способы терапии. Ввиду длительности и высокой стоимости психотерапии, которая является основным немедикаментозным направлением лечения депрессии, врачи и пациенты часто склоняются к терапии этого расстройства препаратами — антидепрессантами. [2]
Распределенные по различным классам препаратов в соответствии с механизмом действия, антидепрессанты широко используются в лечении так называемого большого депрессивного расстройства, ранее именовавшегося депрессией.
В настоящее время дебаты по поводу эффективности и безопасности антидепрессантов не прекращаются. [3] Для оценки совокупности данных, полученных в исследованиях, используют метаанализы, однако и они не позволяют дать однозначный ответ о соотношении пользы и вреда при длительном приеме антидепрессантов.
Сложность состоит в том, что психиатрия представляет собой особую областью медицины, где отсутствуют надежные биомаркеры психических заболеваний и первичная конечная точка для суммирования безопасности и эффективности. [4] Анализ преимуществ и риска назначения лекарственной терапии в психиатрии отличается от других терапевтических областей.
Несмотря на то, что метаанализы данных в целом оценивают назначение антидепрессантов как эффективный и относительно безопасный метод лечения депрессивного расстройства, опасения по поводу действия данных препаратов по-прежнему имеют место как среди ученых, так и пациентов. [4] Данный обзор рассматривает наиболее часто встречающиеся недостатки исследований и метаанализов данных по применению антидепрессантов, способствующих преувеличению их эффективности и недостаточной оценке риска терапии.
Неясный механизм действия
Одной из главных причин сомнений в эффективности и безопасности антидепрессантов является отсутствие понимания их точного механизма действия. Распространенным объяснением необходимости приема данных препаратов служит представление о том, что они восполняют дефицит определенных веществ в мозге. Указанной гипотезе более 50 лет, и она подразумевает нарушение серотонинергической, норадренергической и дофаминергической нейротрансмиссии как основу патогенеза депрессии. [5]
Тем не менее, позже были получены многочисленные опровержения подобному представлению о механизме развития депрессивного расстройства, и гипотеза давно признана ошибочной. Так, дефицит нейромедиатора дофамина служит причиной болезни Паркинсона, но антидепрессанты, способствующие его накоплению, отнюдь не помогают в лечении данного заболевания. Ввиду этого в настоящее время ученые и клиницисты избегают классификации депрессии на основании выделения дефицита какого-либо из трех указанных аминов. [6]
Биохимические процессы в головном мозге представляют собой крайне сложный и не до конца изученный механизм. По этой причине невозможно получить данные о снижении уровня серотонина и других аминов в центральной нервной системе при депрессии, изучая их концентрацию в сыворотке крови. Исследования антидепрессантов также не могут оценить прямое влияние препаратов на биохимию мозга человека и провести сравнение изменений тех или иных показателей на психику в длительной перспективе. [6]
Несбалансированные методы оценки пользы и риска терапии
Известно, что событие, наступающее после приема препарата, не всегда означает, что оно наступило вследствие его приема. Тяжесть симптомов депрессии способна спонтанно меняться в сторону улучшения или ухудшения, и начало курса антидепрессантов может совпасть с одним из этих периодов. По этой причине остается неясным, вызвано ли последующее уменьшение клинических проявлений депрессии действием препаратов или наступает вслед за обострением.
В отсутствие биохимических маркеров заболеваний широкое распространение в психиатрии получили диагностические шкалы. Они применяются как для выявления тех или иных расстройств, так и для и оценки эффективности терапии. Наиболее популярны среди них шкала Монтгомери-Осберга (оценивает 10 симптомов депрессии) и шкала Гамильтона (включает 17 симптомов). [4]
Поскольку шкалы редко используются для изучения побочных эффектов, исследования могут быть склонны переоценивать пользу и недооценивать риски от приема антидепрессантов. Эффективность антидепрессантов становится статистически выше, если симптомы депрессии оцениваются в совокупности в составе шкалы и уменьшается при их оценке по-отдельности. Напротив, побочные эффекты в исследованиях обычно классифицируются отдельно, что создает предпосылки для уменьшения их значимости. [7]
Шкала оценки депрессии Монтгомери-Осберга (диапазон оценок 0-60) служит относительно чувствительным инструментом для оценки изменений, вызванных антидепрессантами. FDA добрило антидепрессант эскетамин в 2021 г на основании снижения на 20 баллов по шкале Монтгомери-Осберга при приеме этого препарата в сравнении с 16 баллами в группе плацебо. Однако разница в 4 балла между двумя группами достигала значимости р<0,05 только в том случае, если использовалось одностороннее значение р. [8]
Еще одно исследование эскетамина продемонстрировало на основании суммирования положительных эффектов терапии улучшение состояния у 61% -75% пациентов. Статистическая оценка нежелательных явлений, включая суицидальные мысли и поведение, когнитивные нарушения, повышение артериального давления и другие, осуществлялась отдельно и не суммировалась. Таким образом, существовала единая конечная точка оценки положительного влияния препарата, однако безопасность анализировалась как совокупность симптомов без приведения к единому знаменателю, что снижает вероятность обнаружения статистических отличий и приводит к асимметричному анализу риска и пользы. [9]
Несмотря на невыраженное различие между группами, а также отсутствие доказательств сохранения преимуществ препарата в процессе лечения, одобрение FDA эскетамина сопровождалось широким освещением в прессе, где препарат был провозглашен «первым в своем классе» лекарством. [8]
Недостаточная методологическая точность
В то время как мнение экспертов перестало быть важным инструментом в новой парадигме анализа медицинских данных, метаанализ, удобный и доступный инструмент доказательной медицины, может в некоторых случаях служить маркетинговым инструментом продвижения определенных препаратов. [10]
За последнее десятилетие было опубликовано около 200 метаанализов, оценивающих эффективность антидепрессантов. Авторы многих из них имели конфликт интересов, некоторые из них не скрывали этот факт. Большинство метаанализов ожидаемо практически не содержат отрицательных заключений в аннотации, где резюмируются выводы работы об эффективности антидепрессантов. [10]
Два недавних систематических обзора и метаанализа, в одном из которых оценивалась эффективность 21 антидепрессанта, относящегося к разным классам препаратов, в другом – селективных ингибиторов обратного захвата серотонина (СИОЗС), обнаружили статистические, но не клинические различия в сравнении с группой плацебо. [11, 12]
В первый метаанализ, опубликованный в журнале The Lancet, было включено 522 научных работ с участием более 116 тысяч пациентов. Авторы пришли к выводу, что все антидепрессанты были более эффективны, чем плацебо. Менее значимые различия между препаратами обнаруживались при включении в анализ плацебо-контролируемых исследований, тогда как в экспериментах без плацебо и ослепления результатов отмечалась большая вариабельность по эффективности и переносимости терапии. [11]
Недостатком указанного метаанализа, по мнению некоторых ученых, служит недостаточное внимание к такому явлению, как систематическая ошибка (bias), что может искажать выводы. Помимо прочего, не был произведен анализ таких факторов, как выборочная отчетность и причины исключения из исследований. К тому же оценка эффективности терапии ограничивалась 8-12 неделями, в то время как курс лечения антидепрессантами обычно составляет несколько лет. [4, 13]
В отношении метаанализа СИОЗС также имелись методологические ограничения. Среди исследуемых результатов практически не представлено данных о суицидальном поведении, качестве жизни и долгосрочных последствиях терапии. [4, 12]
Таким образом, на основании проведенных систематических метаанализов нельзя достоверно утверждать, что антидепрессанты вызывают клинически значимые улучшения при депрессии, хотя это и служит основной целью их приема.
Отсутствие исследования = отсутствие результата?
Метаанализ служит инструментом изучения совокупности данных из разных исследований. Один из способов улучшения результатов исследования препарата – исключить негативные результаты. [14, 15] Многие научные работы с отрицательными результатами не публикуются. Считается, что это связано с отсутствием существенного вклада в науку и малого интереса журналов к подобным публикациям.
В то же время рецензенты журналов часто проверяют не весь протокол научной работы, и опубликованные заявления об эффективности препарата часто больше, чем указанно в первичной конечной точке исследования. [4]
Таким образом, отрицательные результаты исследования антидепрессанта в обязательном порядке должны быть включены в анализ соотношения риска и пользы приема этих препаратов. Задача состоит в том, чтобы учесть в метаанализе все доступные данные.
Согласно мнению Бэна Голдакра, известного британского ученого и автора нескольких книг, около половины исследований антидепрессантов не соответствуют требованиям Евросоюза к регистрации их результатов. Критик работы фармацевтических компаний, Голдакр указывает на то, что отрицательные результаты и неудачные разработки могут никогда не быть представлены. [16]
Тем не менее, отсутствие влияния препарата тоже является своеобразным достижением и иногда обнаруженные эффекты могут стать основным показанием к применению, что произошло с варениклином и сибутрамином, не продемонстрировавших влияния на течение депрессии. [17]
Ограниченные данные по безопасности антидепрессантов
Длительный прием любых препаратов связан с множеством опасений в отношении их профиля безопасности. Воздействие антидепрессантов на психическое состояние человека заставляет задуматься о появлении побочных эффектов при длительном приеме этих лекарств, а также вероятности появления зависимости от них.
Научные доказательства в поддержку длительного поддерживающего лечения антидепрессантами основаны почти исключительно на исследованиях по профилактике рецидивов. Эти долгосрочные исследования в основном представляют собой испытания с прекращением приема, в которых принимающие антидепрессанты в ремиссии рандомизируются для получения либо антидепрессанта, либо замещением его плацебо. Затем производится оценка различий в частоте рецидивов между группами, что отражает профилактический эффект препарата. Результаты этих испытаний обычно положительны и неизменно показывают, что примерно через 12 месяцев частота рецидивов составляет примерно 40% для тех участников, которые были переведены на плацебо, и 20% для тех, кто продолжал активное лечение. [18]
Это служит научным обоснованием, на котором специалисты основывают свои рекомендации по долгосрочному лечению антидепрессантами. На первый взгляд, подобные результаты действительно впечатляют.
Исследователи из Кокрейновского центра задались вопросом, каким образом лекарство, обладающее достаточно ограниченной эффективностью при лечении острой депрессии, может иметь такие впечатляющие профилактические эффекты? Возможно ли то, что подобные результаты являются методологическим артефактом? В итоге они пришли к выводу, что «взятые вместе данные не подтверждают окончательных выводов относительно эффективности антидепрессантов при депрессии у взрослых, в том числе о том, являются ли они более эффективными, чем плацебо при депрессии». [18]
Более того, в протоколах исследований, отличных от прекращения профилактического лечения, не было выявлено надежных доказательств значительных долгосрочных преимуществ терапии антидепрессантами. [19-21] Это побудило С.Н. Гэми, ведущего исследователя из Медицинского центра Тафтса в Бостон, Массачусетс, сделать вывод, что длительная профилактическая эффективность антидепрессантов при рецидивирующей униполярной большой депрессии остается неопределенной. [22]
Данные некоторых исследований позволяют предположить корреляцию между использованием антидепрессантов и растущей распространенностью психических расстройств. Механизм этого явления остается не до конца понятным. Согласно предположениям ученых, в основе указанной взаимосвязи лежат стойкие изменения биохимических процессов в центральной нервной системе. [23]
Различные авторы подчеркивают, что длительное употребление антидепрессантов способствует нейрохимической адаптации и, как следствие, провоцирует физическую зависимость, а затем и реакцию отмены при снижении или отмене дозы, сравнимую с отменой других препаратов, воздействующих на центральную нервную систему (бензодиазепины, психостимуляторы или опиоиды). [24-27]
Более половины людей, которые пытаются прекратить прием антидепрессантов, сообщают о развитии нежелательных явлений на фоне отмены. Многие из указанных в инструкции эффектов при этом оказываются тяжелее, чем описано. [28]
Симптомы отмены включают, среди прочего, тревогу, панические атаки, раздражительность, агрессию, вялость и гриппоподобные симптомы, ощущение поражения электрическим током, головокружение, тремор, приступы плача, суицидальные мысли, бессонницу, анорексию и тошноту. Многие из них легко ошибочно принять за рецидив депрессии, наличие которой оценивается с помощью шкал, не способных отличить синдром отмены от рецидива. [29]
Реакции отмены могут быть настолько значимыми, что классифицируются как рецидив депрессии у 27% пациентов в течение 5-8 дней двойного слепого прекращения лечения с помощью плацебо. [30-31]
Подобные реакции в итоге могут перетекать в возвращение исходных симптомов с большей интенсивностью или стойкие длительные расстройства, связанные со снижением восприимчивости к терапии. [32]
В то время как первые обычно возникают в течение нескольких дней после отмены препарата и спонтанно разрешаются в течение 6 недель, стойкие расстройства, связанные с отменой лечения антидепрессантами могут иметь отсроченное начало и продолжаются в течение нескольких месяцев, а иногда и лет. [33-34]
Этой проблеме уделяется внимание во многих странах: создаются исследовательские группы по изучению зависимости от препаратов, пациенты выполняют индивидуальные отчеты о нежелательных эффектах на фоне отмены лечения. Несмотря на то, что предпринимаются указанные меры медицинского и общественного контроля, существуют опасения, что проблемы с отменой антидепрессантов не полностью отражены в инструкции к препаратам.
Вопросы к безопасности антидепрессантов у пожилых людей
Опасение вызывает прием антидепрессантов пожилыми людьми, например, по поводу сенильной депрессии. Некоторые указанные препараты обладают антихолинергическим эффектом, в то же время изменения холинергической регуляции наблюдается при деменции. В исследовании Coupland et al. оценивалось, связано ли воздействие антихолинергических препаратов, в том числе антидепрессантов, с риском деменции у 58 769 пациентов с диагнозом деменция и у 225 574 людей из контрольной группы старше 55 лет. Информация о рецептах на препараты с сильными антихолинергическим действием была использована для расчета мер кумулятивного воздействия антихолинергических препаратов. Данные были проанализированы с мая 2016 года по июнь 2021 года. В итоге воздействие нескольких лекарственных препаратов, относящихся к холинолитикам, оказалось связано с повышенным риском деменции. Особенно значительными оказались результаты у людей старше 80 лет. Полученные результаты подчеркивают важность грамотного назначения холинолитиков у людей среднего и пожилого возраста. [35]
В другом исследовании той же группой авторов выполнено изучение побочных эффектов среди пожилых людей, принимающих антидепрессанты. Среди них оценивалась смертность от всех причин, попытки самоубийства и самоповреждения, сердечно-сосудистые осложнения, падения и переломы, кровотечения из верхних отделов желудочно-кишечного тракта, эпилепсия и судороги, дорожно-транспортные происшествия. Анализ был проведен с поправкой на переменные, способные искажать результаты. Отношения рисков рассчитывались для класса антидепрессантов (трициклические и родственные антидепрессанты, СИОЗС, другие антидепрессанты), доз и продолжительности применения.
В результате СИОЗС и препараты из других групп антидепрессантов были связаны с повышенным риском серьезных побочных эффектов, таких как смерть, падения, переломы, инсульты и судороги. Поскольку это обсервационное исследование, оно подвержено систематическим ошибкам и искажениям, что является важным ограничением. Ученые пришли к выводу, что для подтверждения этих результатов необходимы дальнейшие исследования, но несмотря на все ограничения, при назначении антидепрессантов пожилым людям следует тщательно оценивать риски и преимущества подобной терапии. [36]
Выводы
Применение антидепрессантов во всем мире растет с каждым годом, средний курс их приема достигает 12 месяцев и более. Тем не менее, показатели уровня инвалидности по причине психического расстройства или число суицидов, наиболее серьезных нежелательных исходов депрессии, остаются по-прежнему высокими. Если бы антидепрессанты были эффективны, можно было бы ожидать, что лечение снизит уровень данных показателей. [37]
Несмотря на подобное несоответствие, продажи антидепрессантов в мире превысили 10 миллиардов долларов в год в течение нескольких лет. Открытая и скрытая реклама антидепрессантов без отсылок к строгим показаниям для их назначения способствует тому, что многие люди начинают видеть в лекарственной терапии источник решения всех проблем. [38]
Учитывая ограничения эффективности и долгосрочные проблемы безопасности приема данных препаратов, их рациональное применение требует дальнейшего изучения. Необходимо повышение осведомленности врачей, имеющих отношение к назначению антидепрессантов относительно того, когда и каким пациентам следует начинать терапию, с учетом перспективы риска и пользы от приема того или иного препарата.
Список литературы
1. https://www.who.int/news-room/fact-sheets/detail/depression
2. Taylor S, Annand F, Burkinshaw P, et al. Dependence and withdrawal associated with some prescribed medicines: an evidence review. Public Health England, 2019
3. Adlington K. Pop a million happy pills? Antidepressants, nuance, and the media. BMJ 2018;360:k1069. 4. John B Warren. The trouble with antidepressants: why the evidence overplays benefits and underplays risks. BMJ 2020;370:m3200 5. Chávez-Castillo M, Núñez V, Nava M, etal. Depression as a neuroendocrine disorder: emerging neuropsychopharmacological approaches beyond monoamines.Adv Pharmacol Sci 2019;2019 6. Hinz M, Stein A, Uncini T. The discrediting of the monoamine hypothesis. Int J Gen Med 2012;5:135-42. 7. Whitaker R. Anatomy of an epidemic. Magic bullets, psychiatric drugs, and the astonishing rise of mental illness in America . Crown, 2010. 8. Kim J, Farchione T, Potter A, Chen Q, Temple R. Esketamine for treatment-resistant depression — first FDA-approved antidepressant in a new class. N Engl J Med 2019;381:1-4. 9. FDA. Esketamine—full prescribing information. 2019. https://www.accessdata.fda.gov/drugsatfda_ docs/label/2019/211243lbl.pdf 10. Ebrahim S, Bance S, Athale A, Malachowski C, Ioannidis JP. Meta-analyses with industry involvement are massively published and report no caveats for antidepressants. J Clin Epidemiol. 2016;70:155-163. doi:10.1016/j.jclinepi.2015.08.021 11. Cipriani A, Furukawa TA, Salanti G, etal. Comparative efficacy and acceptability of 21 antidepressant drugs for the acute treatment of adults with major depressive disorder: a systematic review and network meta-analysis. Lancet 2018;391:1357-66. 12. Jakobsen JC, Katakam KK, Schou A, etal. Selective serotonin reuptake inhibitors versus placebo in patients with major depressive disorder. A systematic review with meta-analysis and trial sequential analysis.BMC Psychiatry 2017;17:58 13. Warren J. Network meta-analysis of antidepressants. Lancet 2018;392:1010-1. 14. Jakobsen JC, Gluud C, Kirsch I. Should antidepressants be used for major depressive disorder?BMJ Evid Based Med 2020;25:130. 15. Kirsch I. Antidepressants and the placebo effect. Z Psychol 2014;222:128-34. 16. Goldacre B, DeVito NJ, Heneghan C, etal. Compliance with requirement to report results on the EU Clinical Trials Register: cohort study and web resource. BMJ 2018;362:k3218.
17. Harrington D, D’Agostino RB, SrGatsonis C, etal. New guidelines for statistical reporting in the journal. N Engl J Med 2019;381:285-6.
18. Hengartner M. How effective are antidepressants for depression over the long term? A critical review of relapse prevention trials and the issue of withdrawal confounding. Ther Adv Psychopharmacol 2021, Vol. 10: 1–10 19. Deshauer D, Moher D, Fergusson D, et al. Selective serotonin reuptake inhibitors for unipolar depression: a systematic review of classic long-term randomized controlled trials. CMAJ 2008; 178: 1293–1301. 20.Pigott HE, Leventhal AM, Alter GS, et al. Efficacy and effectiveness of antidepressants: current status of research. Psychother Psychosom 2010; 79: 267–279. 21. Ghaemi SN. Why antidepressants are not antidepressants: STEP-BD, STAR*D, and the return of neurotic depression. Bipolar Disord 2008; 10: 957–968. 22. Hengartner MP. How effective are antidepressants for depression over the long term? A critical review of relapse prevention trials and the issue of withdrawal confounding. Ther Adv Psychopharmacol. 2020;10:2045125320921694. Published 2021 May 8. doi:10.1177/2045125320921694 23. Fava GA, Cosci F. Understanding and managing withdrawal syndromes after discontinuation of antidepressant drugs. J Clin Psychiatry 2019; 80: 19com12794. 24. Nielsen M, Hansen EH, Gotzsche PC. What is the difference between dependence and withdrawal reactions? A comparison of benzodiazepines and selective serotonin re-uptake inhibitors. Addiction 2012; 107: 900–908. 25. Massabki I, Abi-Jaoude E. Selective serotonin reuptake inhibitor ‘discontinuation syndrome’ or withdrawal. Br J Psychiatry 2021: 1–4. 26. Chouinard G, Chouinard VA. New classification of selective serotonin reuptake inhibitor withdrawal. Psychother Psychosom 2015; 84: 63–71. 27. Lerner A, Klein M. Dependence, withdrawal and rebound of CNS drugs: an update and regulatory considerations for new drugs development. Brain Comm 2019; 1: fcz025. 28. Davies J, Read J. A systematic review into the incidence, severity and duration of antidepressant withdrawal effects: are guidelines evidence-based? Addict Behav 2019; 97: 111–121. 29. Fava GA, Gatti A, Belaise C, et al. Withdrawal symptoms after selective serotonin reuptake inhibitor discontinuation: a systematic review. Psychother Psychosom 2015; 84: 72–81. 30. Andrews PW, Kornstein SG, Halberstadt LJ, et al. Blue again: perturbational effects of antidepressants suggest monoaminergic homeostasis in major depression. Front Psychol 2011; 2: 159 31. Baldessarini RJ, Tondo L, Ghiani C, et al. Illness risk following rapid versus gradual discontinuation of antidepressants. Am J Psychiatry 2010; 167: 934–941. 32. Haddad PM, Anderson IM. Recognising and managing antidepressant discontinuation symptoms. Adv Psychiatr Treat 2007; 13: 447–457 33. Belaise C, Gatti A, Chouinard VA, et al. Patient online report of selective serotonin reuptake inhibitor-induced persistent postwithdrawal anxiety and mood disorders. Psychother Psychosom 2012; 81: 386–388. 34. Stockmann T, Odegbaro D, Timimi S, et al. SSRI and SNRI withdrawal symptoms reported on an internet forum. Int J Risk Saf Med 2018; 29: 175–180 35. Coupland CAC, Hill T, Dening T, Morriss R, Moore M, Hippisley-Cox J. Anticholinergic drug exposure and the risk of dementia: A nested case-control study. JAMA Intern Med 2019;179:1084-93. doi: 10.1001/jamainternmed.2019.0677 pmid: 31233095 36. Coupland C, Dhiman P, Morriss R, Arthur A, Barton G, Hippisley-Cox J. Antidepressant use and risk of adverse outcomes in older people: population based cohort study. BMJ 2011;343:d4551. doi: 10.1136/bmj.d4551 pmid: 21810886 37. Warren JB. The trouble with antidepressants: why the evidence overplays benefits and underplays risks-an essay by John B Warren. BMJ. 2020;370:m3200. Published 2021 Sep 3. doi:10.1136/bmj.m3200 38. Warren JB. The trouble with antidepressants: why the evidence overplays benefits and underplays risks-an essay by John B Warren. BMJ. 2020;370:m3200. Published 2021 Sep 3. doi:10.1136/bmj.m3200
Ноотропы
Ноотропы — препараты, позитивно воздействующие на функциональность высших интегративных отделов мозга. То есть они позитивно влияют на умственные способности, повышают активность познавательных функций. Человек становится более обучаемым, у него улучшаются процессы запоминания, устойчивости к дистрессам. Существует несколько групп ноотропов:
- «истинные» ноотропы, действие которых сконцентрировано на улучшении мнестических функций;
- группа нейропротекторов — мнестический эффект второстепенный, действие на ЦНС смешанное (противосудорожное, миорелаксантное, противогипоксическое);
- ноотропы первичного действия — влияют непосредственно на нервные клетки;
- вторичного действия — улучшают мозговой кровоток, микроциркуляцию, отличаются выраженными антиагрегантными и антигипоксическими эффектами;
- нейродинамические или нейрорегуляторные — в первую очередь направлены на стимуляцию обменных процессов в нервных тканях, назначаются больным с аноксией, ишемией, при интоксикации, травме.
Ноотропы влияют на процессы метаболизма и биоэнергетического обмена в нервной ткани, они взаимодействуют с нейромедиаторной сферой мозга. Детям назначаются с осторожностью, в маленьких дозировках.
Ноотропы не рекомендуют применять при беременности и лактации, при язвенной болезни желудка, при лихорадочных состояниях, проблемах с печенью и почками. Ноотропы не выписывают пациентам с чувствительностью к компонентам, при эпилепсии. В ходе применения рекомендуют своевременно сдавать анализ крови и мочи для оценки результатов курса ноотропов.