Болезнь Паркинсона – название медленно развивающейся патологии центральной нервной системы. Основные симптомы заболевания включают двигательные нарушения, мышечную ригидность (повышенный тонус), тремор в состоянии покоя.
Носители патологии переживают не только вегетативные, но и аффективные расстройства. Врачи-неврологи диагностируют у пациентов истинный паркинсонизм – болезнь Паркинсона – и синдром паркинсонизма. Последний становится осложнением иных неврологических заболеваний: злокачественных образований головного мозга, инсультов, энцефалитов и т.д.
Классификация патологии
Наибольшее распространение в неврологии получил подход, основанный на возрасте пациента в момент обнаружения первых симптомов болезни Паркинсона. На основании этих данных выделяют:
- ювенильный паркинсонизм;
- патологию с ранним началом;
- заболевание с поздним дебютом.
В основе альтернативного подхода к классификации болезни Паркинсона лежит характер изменений в кинематике движений верхних и нижних конечностей пациентов. В этом случае синдромы паркинсонизма разделяются на дрожательные, дрожательно-ригидные, ригидно-дрожательные, акинетико-ригидные и смешанные.
Обе приведенных классификации условны. Неврологи по-прежнему не выработали единого подхода к видам и формам болезни Паркинсона.
Причины
Точные данные о причинах возникновения истинного паркинсонизма не выявлены до настоящего времени. Ведущую роль в развитии патологического процесса отдают генетической предрасположенности. Еще отмечают значение воздействия негативных факторов внешней среды (действие токсических веществ, тяжелых металлов и других причин), а также существенную роль отводят естественному старению организма.
В 15 % случаев этого заболевания прослеживают семейную предрасположенность. Генетические факторы в случае раннего дебюта играют ведущую роль. У молодых людей с диагнозом истинный паркинсонизм и наличием семейной истории заболевания находят гены: PINK1, SNCA, LRRK2 PARK2. С их присутствием, очевидно, связано развитие форм заболевания с ранним дебютом.
Симптоматика патологии
Деструктивные процессы в центральной нервной системе провоцируют развитие основных симптомов:
- тремора;
- ригидности;
- гипокинезии (ограничения подвижности);
- нарушения поступательной регуляции.
Истинный паркинсонизм характеризуется повторяющимися или постоянными приступами тремора. Для патологии характерно зацикленное движение конечностей пациента в состоянии покоя.
На ранних стадиях развития синдрома относительно незаметной остается мышечная ригидность. По мере развития остальных симптомов постоянный мышечный тонус причиняет все больше дискомфорта пациенту. Асимметрия в напряжении мышц остается одним из основных диагностических маркеров на ранних стадиях развития болезни Паркинсона.
Неврологи различают несколько этапов в развитии патологии. В учебной литературе для медицинских университетов часто приводится классификация Хена и Яра. Ее базовые положения представлены в таблице.
| Стадия | Описание |
| Нулевая | Двигательные симптомы паркинсонизма отсутствуют |
| Первая | Патология проявляется в одностороннем режиме |
| Вторая | Формируется комплекс двусторонних симптомов |
| Третья | Развивается заметная поступательная неустойчивость, но пациент сохраняет возможность самостоятельно обслуживать себя |
| Четвертая | Стремительная деградация двигательной активности, пациент может только стоять и передвигаться на небольшие расстояния без посторонней помощи |
| Пятая | Пациент не может покинуть кресло или постель без помощи врачей или родственников |
Симптомы и признаки болезни Паркинсона у женщин и мужчин совпадают. Половозрастные различия при диагностике патологии оказываются малозначительными.
У вас появились симптомы болезни Паркинсона?
Точно диагностировать заболевание может только врач. Не откладывайте консультацию — позвоните по телефону
Лечебная физкультура
Занятия физической культурой проводятся под контролем реабилитолога. Комплекс упражнений формируют, учитывая состояние пациента, стадию болезни Паркинсона, потенциал реабилитации. Все движения должны быть простыми, без перенапряжения. Обязательно составляют блок упражнений, обеспечивающих расслабление мышц: без них тремор будет усиливаться, движения начнут замедляться и становиться скованными, боль будет нарастать. Врачи рекомендуют заниматься лечебной физкультурой ежедневно, постепенно увеличивая нагрузку, прорабатывая все группы мышц. Упражнения выполняют в свободном ритме, дополняют дыхательной гимнастикой, контролируют при этом самочувствие: важно, чтобы после тренировки человек чувствовал приятную усталость, но не измождение.
У вас есть вопросы?
Мы перезвоним в течение 30 секунд
или позвоните по номеру
Нажимая кнопку «Отправить»
, вы автоматически выражаете согласие на обработку своих персональных данных и принимаете условия Пользовательского соглашения.
- Виды массажа и их польза
- Виды физиотерапии и ее польза
- Аппаратная физиотерапия
- Физиотерапия в реабилитации, лечении и профилактике
- Физиотерапия в противорецидивном лечении
- Физиотерапия в лечении зависимостей
- Польза физиотерапии для пожилых пациентов
- Физиотерапия при болезни Паркинсона
Диагностические мероприятия
Постановка диагноза осуществляется неврологом. Врачу может потребоваться значительное количество времени для дифференциации диагноза и проведения различных функциональных тестов.
Паркинсонизм с ранним началом характеризуется выраженной ограниченностью в движении при регулярных приступах тремора (частота колебаний конечностей пациентов составляет 4-6 Гц). Клиническая картина дополняется постуральной неустойчивостью, которая не связана с мозжечковыми нарушениями или полученными пациентом травмами.
Диагностические процедуры включают:
- ЭЭГ;
- реоэнцефалографию;
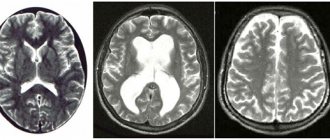
- компьютерную и магнитно-резонансную томографии головного мозга.
Механизм возникновения
Вышеперечисленный перечень фармакологической продукции в любом случае вызывает тормозящий эффект на дофаминергический участок головного мозга. Основное место занимают механизмы, провоцирующие блокировки D2-рецептора стриатума, сбои в выработке гормона из зоны пресинаптического плана. В итоге получается, что в организме человека начинается преобладание ацетилхолиновых процессов, которые в большом количестве активируют ядро хвостатой формы. Последний пункт оказывает притормаживание двигательной среды, что заметно в виде снижения числа, скорости и амплитуды активного образа жизни. Согласно проведенным анализам ученые выяснили, что клиническая картина представленного патологического процесса начинается во время блокировки более 75% рецепторов.
Также, не стоит забывать про наследственную предрасположенность к скрытой нехватке гормона, проявляющейся во время дополнительных влияний дофаминбокираторов из применяемого медикамента.
Лечение патологии
Стратегии лечения болезни Паркинсона зависят от стадии, на которой пациент начал получать необходимую терапию. По этой причине неврологи предпочитают разделять терапевтические подходы, направленные на купировании ранней и поздней симптоматики.
Лечение на ранних стадиях предполагает применение медикаментов, стимулирующих синтез дофамина в головном мозге. Терапевтический эффект достигается за счет стимуляции дофаминовых выбросов и блокировании из обратного поглощения. Благодаря этому удается добиться снижения скорости гибели нейронов. Базовые препараты могут применяться в составе комплексного лечения или в качестве монотерапии. Сочетание необходимых веществ подбирается неврологом на основании клинической картины паркинсонизма и индивидуальных характеристик пациентов.
Лечение болезни Паркинсона на поздних стадиях остается неизбежным этапом, поскольку медикаментозная терапия позволяет лишь замедлить деструктивные процессы. Прогрессирующая патология дополняется новыми симптомами, которые с трудом купируются. В определенный момент привычная эффективность лекарственных средств снижается. Пациент сталкивается с гиперчувствительностью дофаминовых рецепторов и своеобразным синдромом отмены из-за резистентности организма к принимаемым длительное время веществам.
На фоне этого врачи вынуждены назначать пациентам постоянно растущие дозы медикаментов за счет сокращения интервалов между приемами. Альтернативным решением становится переход на комбинированную схему лечения, при которой используются препараты нескольких групп. В отдельных случаях допустимо хирургическое вмешательство для имплантации пациенту электрода, обеспечивающего глубокую стимуляцию мозга. Этот метод позволяет купировать тремор покоя и восстановить двигательную активность лиц, страдающих от болезни Паркинсона.
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина №01 2006
Экстрапирамидные синдромы – группа двигательных нарушений, возникающих в результате повреждения базальных ганглиев и подкорково-таламических связей [1]. Нейролептики могут вызывать практически весь спектр экстрапирамидных расстройств: паркинсонизм, дистонию, тремор, хорею, акатизию, тики, миоклонию, стереотипии. Паркинсонизм – синдром, обусловленный поражением базальных ганглиев и нарушением их функциональных связей; он проявляется акинезией и ригидностью, иногда – тремором покоя и постуральными расстройствами. По статистике от 4 до 15% всех случаев паркинсонизма связано с приемом лекарственных препаратов [2–4], чаще всего – нейролептиков. Его распространенность особенно высока среди пациентов психиатрических клиник. Нередко таким больным ошибочно устанавливается диагноз болезни Паркинсона и назначаются дофаминергические препараты, что не дает желаемого эффекта, а иногда приводит к обострению психических проявлений. При этом своевременные и адекватные терапевтические возможности оказываются неиспользованными, что сказывается на качестве жизни таких больных, ухудшает их повседневную активность, влияет на эмоциональную сферу, а в некоторых случаях ведет к потере трудоспособности. Нейролептический паркинсонизм возникает в среднем у 10–15% больных, принимающих нейролептики. Вероятность развития паркинсонизма при приеме нейролептика прямо пропорциональна его способности блокировать М-холинорецепторы и серотониновые 5-НТ2-рецепторы. Особенно часто паркинсонизм развивается при использовании сильнодействующих блокаторов D2-рецепторов со слабой холинолитической активностью и низкой аффинностью к серотониновым рецепторам (галоперидол, фторфеназин, трифтазин). При применении атипичных нейролептиков (клозапин, оланзапин, кветиапин и др.) в силу их слабого взаимодействия с D2-рецепторами в стриатуме (активность этой группы лекарственных средств обусловлена блокадой D4-рецепторов и серотониновых рецепторов) вероятность развития паркинсонизма сведена к минимуму. Паркинсонизм может развиваться и при приеме “мягких” нейролептиков (прохлорперазин) [5]. Вероятность развития паркинсонизма выше при применении высоких доз нейролептиков, особенно пиперазинового ряда; при наличии фонового органического поражения головного мозга, черепно-мозговой травмы в анамнезе или наследственной предрасположенности к этому осложнению [6]. Кроме того, к факторам риска относят возраст, пол, курение. У пожилых людей более выражен антидофаминергический эффект нейролептиков, что было подтверждено несколькими исследованиями [7]. Нейролептический паркинсонизм в большинстве случаев возникает у лиц старше 40 лет; у женщин – в 2 раза чаще, чем у мужчин [2]. Среди других возможных факторов риска указывают на семейный анамнез болезни Паркинсона, предшествующие моторные нарушения, ранний возраст начала шизофрении у психиатрических больных, наличие когнитивных нарушений, сахарного диабета [2]. Патогенетические факторы развития нейролептического паркинсонизма не вполне ясны. Нейролептики блокируют дофаминовые D2-рецепторы в нигростриальной системе мозга, что ведет к угнетению дофаминергической передачи, изменению чувствительности дофаминовых рецепторов. Нейрохимический дисбаланс проявляется повышением активности холинергической, серотонинергической систем, а также повышением активности глутаматергических субталамических нейронов, что приводит к увеличению высвобождения глутамата и активации окислительного стресса, который является одним из основных факторов, способствующих повреждению нейронов базальных ганглиев. Благодаря своей липофильности нейролептики обладают способностью встраиваться в клеточные мембраны и нарушать энергетический обмен нейронов. Однако часто отсроченный побочный нейролептический эффект указывает на то, что он связан не только с непосредственной блокадой D2-рецепторов. Как показывают экспериментальные исследования, при блокаде постсинаптических D2-рецепторов дофаминергические нейроны черной субстанции (как и нейроны вентральной части покрышки среднего мозга) постепенно (в течение нескольких недель) прекращают разряжаться вследствие деполяризационного блока, что совпадает по времени с развитием паркинсонизма [5]. Диагноз нейролептического паркинсонизма устанавливают в соответствии с американской классификацией DSM-IV (1994 г.): А. Наличие одного или нескольких симптомов, появляющихся на фоне нейролептической терапии:
- тремора (конечностей, головы, языка);
- мышечной ригидности с пластическим повышением мышечного тонуса и симптомом “ зубчатого колеса”;
- акинезии.
В. Симптомы группы А появляются в течение первых нескольких недель с момента начала нейролептической терапии или повышения дозы ранее принимаемых нейролептиков и уменьшаются после назначения антипаркинсонических корректоров. С. Симптомы группы А не должны быть обусловлены психическим заболеванием (кататония, негативные симптомы шизофрении, двигательная заторможенность при большом депрессивном эпизоде и др.). D. Симптомы группы А не должны быть обусловлены приемом другого препарата, а также неврологическим или соматическим заболеванием (болезнь Паркинсона, болезнь Вильсона и др.). В настоящее время в ряде работ зарубежных авторов широко обсуждается вопрос о терапевтической эффективности препаратов амантадина, холинолитиков (тригексифенидил, бипериден) в купировании экстрапирамидных нейролептических синдромов. Ряд исследований сообщают об эквивалентной эффективности биперидена и амантадина [8], другие указывают на большую эффективность амантадина в коррекции нейролептических осложнений [9]. В двойном слепом плацебо-контролируемом исследовании, проведенном W.Fann и C.Lake (1976 г.), выявлено, что при лечении нейролептического паркинсонизма амантадин в дозе 200 мг/сут терапевтически эквивалентен 8 мг/сут тригексифенидила. Амантадин вызывал значительно реже и менее тяжелые побочные эффекты, чем тригексифенидил, хотя эта разница не достигала уровня статистической достоверности [10]. В то же время сообщается о ряде преимуществ амантадинов перед холинолитиками. Холинолитики в стандартных клинических дозах могут ухудшать когнитивные функции пациентов [11, 12]. По-сравнению с антихолинергическими препаратами когнитивные функции у здоровых [8, 13] и больных шизофренией [14] при лечении амантадином сохраняются дольше. Кроме того, антихолинергические препараты могут уменьшать антипсихотический эффект нейролептиков и приводить к злоупотреблению ими из-за анксиолитических свойств и способности вызывать эйфорию [15]. Наконец, они могут продуцировать изменения в реполяризации сердца [16]. По данным некоторых исследователей, антихолинергические препараты провоцируют развитие поздней дискинезии [12, 15, 17]. В одном из сообщений Американской психиатрической ассоциации указывается, что амантадин эффективен в лечении поздней дискинезии (1992 г.). Улучшение состояния наблюдали у всех 6 пациентов, получавших амантадин и нейролептики, причем улучшение было достигнуто при отмене антихолинергических препаратов. В настоящее время детально не изучены факторы, повышающие степень риска возникновения нейролептических экстрапирамидных расстройств, особенности клинической картины нейролептического паркинсонизма. Предметом особого внимания и дискуссии являются методы коррекции данного осложнения. Целью работы явилось изучение особенностей клинических проявлений и течения нейролептического паркинсонизма, а также определение подходов к его коррекции.
Материал и методы
В исследование включены 90 больных с диагнозом параноидной шизофрении (в соответствии с критериями МКБ-10), у которых на фоне приема нейролептиков развился синдром паркинсонизма. Клиническая оценка состояния больных включала исследование неврологического и соматического статуса с объективизацией имеющихся неврологических нарушений с помощью шкалы Hoehn & Yahr в модификации Lindvall (1988 г.), Tetrud и Langston (1989 г.); шкалы UPDRS, 3-я версия (S.Fahn и соавт., 1987). Клиническую оценку проводили до начала коррекции осложнения, в процессе терапии, через 1 мес терапии. Длительность последующей корригирующей терапии определялась темпом регресса нейролептического осложнения. В качестве корректоров использовали амантадина сульфат и тригексифенидил. Амантадина сульфат является антагонистом NMDA-рецепторов глутамата, являющегося возбуждающим нейротрансмиттером. При терапии амантадина сульфатом снижается преобладание глутаматергической системы, уровень ацетилхолина в полосатом теле, увеличивается синтез дофамина в пресинаптических терминалях и его высвобождение в синаптическую щель. Средняя суточная доза амантадина сульфата составляла 300 мг/сут. Механизм действия холинолитика тригексифенидила заключается в уменьшении функциональной активности холинергических систем и восстановлении нейромедиаторного дисбаланса. Средняя суточная доза тригексифенидила составляла 7,5 мг/сут. Результаты исследования обрабатывали при помощи статистической программы Statistica 6.0 с использованием критерия Стьюдента, критерия согласия c2, критерия U, непараметрического критерия знаков, рангового корреляционного анализа (по Спирмену). Все приведенные ниже данные представлены в виде М±d.
Результаты и обсуждение
Обследованы 90 пациентов (34 мужчины, 56 женщин) с нейролептическим паркинсонизмом. Средний возраст больных составил 45,7±15,5 года. Средняя продолжительность лечения нейролептиками составила 143,3±121,9 мес (от 1 мес до 35 лет). Степень тяжести паркинсонизма по шкале Hoehn–Yahr составила 2,5±0,5 балла. Все обследуемые пациенты по поводу основного психического заболевания принимали нейролептические препараты в среднетерапевтических суточных дозах. Из типичных нейролептиков наиболее часто применялись алифатические производные фенотиазина (n=37), пиперазиновые производные фенотиазина (n=44), пиперединовые производные фенотиазина (n=16), производные бутирофенона (n=49), производные тиоксантена (n=36), замещенные бензамиды (n=6). Каждый пациент получал комбинации этих препаратов между собой и с атипичными нейролептиками, из которых применялись производные бензизококсазола (n=17), производные дибензодиазепина (n=25), пролонгированные формы нейролептиков (n=35). Часть пациентов получали нейролептики в комбинации с трициклическими антидепрессантами (n=21), транквилизаторами (n=16), препаратами лития (n=3). Нейролептический паркинсонизм отмечен достоверно чаще (p<0,05) у женщин, чем у мужчин (в 1,6 раза). Выявлена положительная корреляция между возрастом больных (R=0,3; p=0,002), продолжительностью нейролептической терапии (R=0,4; p=0,0006) и сроками возникновения паркинсонизма. Клиническая картина нейролептического паркинсонизма во многом была сходна с проявлениями болезни Паркинсона и характеризовалась такими же основными симптомами (гипокинезия, ригидность, тремор, постуральная неустойчивость). У всех пациентов выявлялись гипокинезия и мышечная ригидность, тремор покоя отмечен у 26 (34,4%) больных, а постуральная неустойчивость – у 46 (44,6%).
Гипокинезия
у больных нейролептическим паркинсонизмом была наиболее ранним проявлением паркинсонического синдрома, преобладала в дистальных отделах конечностей, доминировала над ригидностью, характеризовалась умеренной или значительной степенью выраженности.
Ригидность
развивалась позже, чем гипокинезия, проявлялась пластическим повышением мышечного тонуса в мышцах конечностей, аксиальной мускулатуре и быстрее регрессировала на фоне противопаркинсонической терапии.
Тремор
при нейролептическом паркинсонизме несколько отличался от тремора при болезни Паркинсона. Он характеризовался симметричностью и чаще имел постурально-кинетический характер; тремор покоя наблюдался несколько реже. У 1 больного был выявлен тремор, охватывающий только периоральную область и напоминающий жующие движения кролика – “синдром кролика”. В структуре синдрома паркинсонизма тремор был наиболее редко встречающимся симптомом и носил непостоянный характер.
Постуральная неустойчивость
проявлялась нарушениями способности удерживать равновесие, а также падениями и расстройствами ходьбы. Постуральную нестабильность наблюдали у 76 пациентов; у 63% пациентов – ретропульсии. Падения отмечены у 19% пациентов, а 2% пациентов даже требовалась посторонняя помощь. Таким образом, почти в половине случаев имели место нарушения постуральной устойчивости, однако, как правило, они носили незначительный характер и не являлись доминирующими в структуре нейролептического паркинсонизма. Также в меньшей степени страдала ходьба; сгорбленная поза и семенящая, шаркающая походка не были характерны для таких больных (табл. 1).
Частота встречаемости экстрапирамидных нейролептических синдромов.
Таблица 1. Степень выраженности и частота основных симптомов нейролептического паркинсонизма (n=90)
| Основные симптомы паркинсонизма | Степень выраженности, баллы (М±s) | Частота встречаемости, % |
| Гипокинезия | 16,3±8,2 | 100 |
| Ригидность | 9,6±4,4 | 100 |
| Тремор покоя | 6,7±4,1 | 31 |
| Постурально-кинетический тремор | 3,9±1,9 | 35 |
| Постуральная неустойчивость | 1,3±0,6 | 84 |
Таблица 2. Выраженность клинических проявлений синдрома паркинсонизма у больных нейролептическим паркинсонизмом с различной степенью тяжести (шкала Hoehn–Yahr UPDRS, III часть)
| Степень тяжести паркинсонизма по шкале Hoehn–Yahr , баллы | Клинические проявления синдрома паркинсонизма по шкале UPDRS (III часть) | |||
| гипокинезия | ригидность | тремор | общий балл | |
| 2,0–2,5 | 8,1±3,3 | 13,1±5,8 | 4,9±3,6 | 29,5±10,1 |
| 3,0–3,5 | 14,2±2,9 | 26,2±5,2 | 6,5±5,3 | 48,4±11,4 |
| 4,0 | 19,3±1,2 | 33,7±3,2 | 8,0±6,4 | 68,0±2,0 |
Таблица 3. Оценка эффективности амантадина сульфата (ПК-Мерц) в купировании проявлений нейролептического паркинсонизма (n=30)
| Симптомы паркинсонизма (шкала UPDRS, III часть) | Баллы (M±d) | Улучшение, % | |
| до лечения | после лечения | ||
| Гипокинезия | 19,2±9,2 | 9,4±6,6** | 53 |
| Ригидность | 9,6±5,5 | 3,5±3,3** | 64 |
| Тремор | 5,4±2,8 | 2,5±1,8* | 54 |
| Постуральная неустойчивость | 1,8±0,9 | 0,9±0,5* | 50 |
| Общий балл | 37,6±15,7 | 15,5±10,6** | 58,8 |
| Примечание. Здесь и в табл. 4: * – p<0,05; ** – p<0,01. | |||
Таблица 4. Оценка эффективности тригексифенидила (циклодол) в купировании проявлений нейролептического паркинсонизма (n=70)
| Симптомы паркинсонизма (шкала UPDRS, III часть) | Баллы (M±d) | Улучшение, % | |
| до лечения | после лечения | ||
| Гипокинезия | 15,2±7,6 | 11,6±6,7** | 23,7 |
| Ригидность | 9,6±3,9 | 6,2±3,6** | 35,4 |
| Тремор | 7,0±6,4 | 5,2±4,8** | 25,7 |
| Постуральная неустойчивость | 1,2±0,4 | 1,1±0,3 | 8,3 |
| Общий балл | 33,1±13,2 | 23,4±13,3** | 29,3 |
Таблица 5. Частота (в %) побочных эффектов тригексифенидила и амантадина сульфата при коррекции нейролептического паркинсонизма (n=90)
| Побочный эффект | Тригексифенидил | Амантадина сульфат |
| Сухость во рту | 92 | – |
| Запоры | 80 | – |
| Задержка мочеиспускания | 20 | – |
| Нарушение зрения | 5 | – |
| Сетчатое ливедо | – | 4 |
| Беспокойство | – | 12 |
| Головокружение | – | 20 |
| Экзацербация психотической симптоматики | 8 | – |
Таблица 6. Сравнение эффективности амантадина сульфата и тригексифенидила в лечении нейролептического паркинсонизма
| Амантадин | Тригексифенидил |
| Более эффективен в коррекции двигательных расстройств | Менее эффективен в коррекции двигательных расстройств при |
| при паркинсонизме | паркинсонизме |
| Не уменьшает антипсихотического эффекта нейролептиков | Уменьшает антипсихотический эффект нейролептиков |
| Не вызывает когнитивных нарушений | Вызывает когнитивные нарушения |
| Редко вызывает побочные эффекты | Часто вызывает побочные эффекты |
| По данным экспериментальных исследований, возможно, оказывает нейропротекторный эффект | Не имеет нейропротекторного эффекта |
Таблица 7. Влияние терапии амантадином сульфатом и тригексифенидилом на показатели качества жизни и повседневной активности больных нейролептическим паркинсонизмом (n=90)
| Шкала | Улучшение, % | |
| тригексифенидил | амантадина сульфат | |
| UPDRS (II часть) | 50,4 | 63,0 |
| PDQ-39 | 20,1 | 30,2 |
| EUROQoL (II часть) | 29,6 | 30,2 |
У большинства пациентов степень тяжести паркинсонизма по шкале Hoehn–Yahr составила 2–2,5 балла (табл. 2). У обследованных пациентов были выявлены следующие клинические формы нейролептического паркинсонизма: 79% – акинетико-ригидная, 20% – ригидно-дрожательная, 11% – акинетико-ригидно-дрожательная (смешанная). С увеличением длительности нейролептической терапии увеличивалась частота встречаемости дрожательных форм паркинсонизма. У большинства больных (88%) отмечен симметричный паркинсонизм, лишь в 12% случаев – преобладание двигательных симптомов с одной стороны. У всех больных симптомы паркинсонизма развивались быстро: у 17% пациентов – остро (симптомы появились в течение 1–2 дней); у 83% пациентов – подостро (нарастание двигательных расстройств отмечалось в течение недель). У 53 (59%) пациентов наблюдали сочетание синдрома паркинсонизма с другими нейролептическими экстрапирамидными расстройствами (см. рисунок). Частота встречаемости синдромов превышала 100%, так как у многих больных одновременно отмечалась их комбинация. В данном исследовании катамнестическое наблюдение за больными в течение 2 лет позволило выделить следующие типы течения нейролептического паркинсонизма: – быстрорегрессирующий
, при котором в течение 1 мес лечения на фоне снижения дозы типичного и/или назначения атипичного нейролептика в комбиниции с корректором (холинолитик, амантадин) происходил регресс симптомов более чем на 50%;
– медленнорегрессирующий
, при котором в течение 1–6 мес лечения на фоне снижения дозы типичного и/или назначения атипичного нейролептика в комбиниции с корректором (холинолитик, амантадин) происходил регресс симптомов от 20–50%;
– стационарный
, при котором на фоне снижения дозы типичного и/или назначения атипичного нейролептика в комбиниции с корректором (холинолитик, амантадин) отсутствовал или отмечался незначительный регресс симптомов до 20% в течение 6 мес лечения. Медленнорегрессирующий тип течения паркинсонизма был отмечен в 40% случаев, в 36% случаев был выявлен быстрорегрессирующий тип течения и в 24% случаев – стационарное течение паркинсонизма. Чем выше был возраст больных с нейролептическим паркинсонизмом, чем больше была продолжительность нейролептической терапии, тем чаще встречался стационарный тип течения данного синдрома у пациентов (R<0,4; p<0,01). Достоверно чаще (p<0,05) быстрорегрессирующий тип течения паркинсонизма встречался у пациентов с акинетико-ригидной формой (40%), чем у пациентов со смешанной формой (15%). Регресс проявлений паркинсонизма, вызванного приемом атипичных нейролептиков, был более выраженным и возникал в более ранние сроки после уменьшения дозы препаратов или их отмены.
Подходы к коррекции нейролептического паркинсонизма
Коррекция синдрома паркинсонизма проводилась в соответствии с общими принципами лечения нейролептических осложнений: при возможности – отмена препарата, вызвавшего осложнение (n=10), или снижение его дозы (n=36), или назначение атипичного нейролептика (n=86), или замена одного атипичного нейролептика на другой (n=5). Одному и тому же больному часто одновременно снижали дозу типичного и назначали атипичный нейролептик. Основной массе пациентов (n=70) проводили инфузионную терапию, включавшую внутривенное капельное введение 5% глюкозы, витаминов группы В, аскорбиновой кислоты, пирацетама 20% – 10 мл, рибоксина – 10 мл; некоторым пациентам вводили эуфиллин 2,4% – 10 мл. В дополнение к этой терапии пациентам назначали холинолитик и/или амантадин.
Сравнительная оценка эффективности амантадина сульфата (ПК-Мерц) и холинолитика тригексифенидила (циклодол) в коррекции нейролептического паркинсонизма
Для коррекции нейролептического паркинсонизма в данном исследовании использовали амантадина сульфат и тригексифенидил. Нейролептики блокируют дофаминовые D2-рецепторы в нигростриальной системе мозга, что сопровождается угнетением дофаминергической передачи, изменением чувствительности дофаминовых рецепторов. Развивается медиаторный нейрохимический дисбаланс, который проявляется повышением активности холинергической, серотонинергической систем, а также повышением активности глутаматергических субталамических нейронов. Это приводит к увеличению высвобождения глутамата, который является возбуждающим нейротрансмиттером. При этом увеличивается приток ионов кальция в нейроны, повышается уровень ацетилхолина в нейронах полосатого тела, активируются холинергические системы и появляются тремор, ригидность, гипокинезия. Повышение концентрации кальция в нигростриарных нейронах способствует дегенерации этих нейронов и активации окислительного стресса, который является одним из основных факторов, способствующих повреждению нейронов базальных ганглиев. Возбуждающее действие глутамата опосредуется через рецепторы N-метил-D-аспартата (NMDA-рецепторы). Благодаря своей липофильности нейролептики обладают способностью встраиваться в клеточные мембраны и нарушать энергетический обмен нейронов.
Амантадина сульфат
является антагонистом NMDA-рецепторов глутамата, через которые осуществляется возбуждающее действие последнего; снижает преобладание глутаматергической системы, уровень ацетилхолина в полосатом теле; увеличивает синтез дофамина в пресинаптических терминалях и его высвобождение в синаптическую щель, тормозит обратный захвата дофамина в пресинаптическую терминаль, стимулирует ДА-рецепторы; опосредованно уменьшает концентрацию ионов кальция в нигростриарных нейронах, в результате чего, возможно, обладает нейропротекторным действием [9, 18]. Механизм действия холинолитиков заключается в уменьшении функциональной активности холинергических систем и восстановлении нарушенного в связи с дефицитом дофамина равновесия дофаминергической и холинергической систем в базальных ганглиях, блокировании обратного захвата дофамина из синаптической щели (табл. 3, 4) [1]. Анализ полученных результатов показал значительное преимущество амантадина сульфата перед тригексифенидилом в лечении основных двигательных нарушений, вызванных нейролептическим паркинсонизмом. В отличие от тригексифенидила амантадина сульфат уменьшал выраженность расстройств позы и походки. С целью оценки безопасности лечения проводился анализ частоты побочных эффектов фармакотерапии (табл. 5). Таким образом, амантадина сульфат при купировании нейролептического паркинсонизма вызывал меньше побочных эффектов, чем тригексифенидил. В целом можно отметить ряд преимуществ амантадина сульфата над тригексифенидилом в коррекции нейролептического паркинсонизма (табл. 6). Амантадина сульфат значительно улучшал показатели повседневной активности (шкала UPDRS, II часть) и качества жизни (шкала PDQ-39 и шкала EUROQoL, II часть) по сравнению с тригексифенидилом (табл. 7). Таким образом, в данном иследовании выявлен ряд особенностей, отличающих нейролептический паркинсонизм от болезни Паркинсона. Нейролептический паркинсонизм развивается подостро, реже остро, как правило, в течение 1–2 нед после начала терапии нейролептиком или увеличения его дозы. Отмечено более частое его развитие у женщин, преимуществено после 40 лет. В клинической картине преобладает симметричность проявлений. Гипокинезия может быть наиболее ранним и иногда единственным его проявлением. Классический тремор покоя встречается реже, чем постурально-кинетический, который в свою очередь характеризуется симметричностью. При нейролептическом паркинсонизме не характерны грубые постуральные нарушения, редко встречаются нарушения походки и падения. Характерной особенностью нейролептического паркинсонизма является комбинация его с разнообразными дискинезиями и дистониями. При отмене нейролептика или снижении его дозы проявления паркинсонизма обычно регрессируют в течение нескольких недель. Однако у части пациентов отмечается более медленное уменьшение двигательных расстройств или их стационарное течение, что, как правило, наблюдается у больных с наличием в анамнезе органической патологии и терапии пролонгированными формами нейролептиков. Факторами риска развития нейролептического паркинсонизма являются пожилой возраст больных и длительная продолжительность нейролептической терапии. Терапия нейролептического паркинсонизма амантадина сульфатом приводит к более значительному и более раннему регрессу основных симптомов нейролептического паркинсонизма, не влияет на когнитивные функции больных и не снижает антипсихотического действия нейролептиков. Кроме того, амантадина сульфат значительно реже вызывает побочные явления и статистически достоверно улучшает показатели качества жизни и повседневной активности больных.
Вопросы и ответы
Излечим ли истинный паркинсонизм?
Современная фармакология и медицина не располагают средствами для полного излечения болезни Паркинсона. Используемые схемы лечения направлены на замедление деструктивных изменений, купирование основных симптомов и улучшение качества жизни лиц, страдающих от паркинсонизма. Методы лечения болезни Паркинсона и причины возникновения этой патологии по-прежнему пристально изучаются ведущими учеными мира. Возможно, что в обозримом будущем случится прорыв в медицине.
Как спрогнозировать продолжительность жизни пациента с болезнью Паркинсона?
Прогноз формируется лечащим врачом на основании клинической картины, хронических патологий пациента и результатах диагностических процедур. Оценка перспектив лечения – сложная задача, поскольку неврологи не могут заранее оценить реакцию человеческого организма на медикаментозную терапию.
Можно ли устранить возможные причины болезни Паркинсона в юности и избежать развития патологии в зрелые годы?
Невропатологи полагают, что паркинсонизм относится к генетически обусловленным патологиям. По этой причине разработка действенного комплекса профилактических мер не представляется возможной. Отметим, что симптомы и признаки болезни Паркинсона на ранних стадиях остаются недостаточно выраженными для принятия экстренных мер.
Диагностика паркинсонизма в Клиническом госпитале на Яузе
В отделении неврологии Клинического госпиталя на Яузе проводится комплексная диагностика паркинсонизма.
Несмотря на то, что это заболевание имеет ряд характерных внешних проявлений, для того чтобы врач имел исчерпывающую информацию о состоянии пациента, необходима лабораторная диагностика: общий и клинический анализ крови; определение содержания в крови глюкозы, холестерина, билирубина, креатинина, бета-липопротеидов, триглицеридов.
Также для обследования пациентов с подозрением на паркинсонизм применяют инструментальную диагностику: электромиографию, которая позволяет определить причину тремора и исключить мышечные заболевания, и электроэнцефалографию для диагностики нарушений деятельности мозга. Плюс к этому для диагностики паркинсонизма специалисты отделения неврологии Клинического госпиталя на Яузе направляют пациентов на МСКТ головного мозга, сосудов шеи и сосудов головного мозга с контрастированием; МРТ головного мозга; МР-ангиографию интракраниальных артерий и сосудов шеи.
Обследование проводится в комплексе, поэтому пациента также направляют на консультацию к узким специалистам (окулисту, физиотерапевту и другим).
Прогноз и профилактика болезни Паркинсона
В наши дни данное заболевание продолжает оставаться неизлечимым. Сегодня медики не могут предложить препараты, способные восстанавливать структуру мозга. Прогноз развития связан с возрастом больного, наличием сопутствующих диагнозов.
Выраженность симптоматики позволяет снизить своевременное диагностирование и назначение действенной терапии. Прогноз развития зависит:
- возраста первых проявлений, чем моложе, тем больше у организма сил на сопротивление скорому развитию с частыми атаками, приводящими к гибели нейронов;
- перспективы использования современных препаратов, в том числе Леводопы. Это средство сегодня в РФ входит в список медикаментов, назначаемых федеральным льготникам по СНИЛС;
- возможности использования инновационных операционных методов, чаще всего предлагаемых пациентам молодого и среднего возраста, которые способны выдержать оперативное вмешательство.
За счет отсутствия точных данных о причинах начала болезни Паркинсона точные методы профилактики также неизвестны. Но для снижения рисков рекомендуется вести здоровый образ жизни, отказаться от приема наркотических препаратов, алкоголя. Важным вариантом профилактики становится регулярное прохождение диспансеризации.