Перевод презентации «Anomalies and normal variants of the intracranial arteries: proposed workflow for classification and significance».
| Congress: | ECR 2016 |
| Poster No.: | C-0199 |
| Authors: | A. Hakim1, J. Gralla1, C. Rozeik2, P. Mordasini1, F. Pult1, L. Leidolt1, E. Piechowiak1, K. Hsieh1, M. El-Koussy1; 1Bern/CH, 2Loerrach/DE |
| DOI: | 10.1594/ecr2016/C-0199 |
| DOI-Link: | https://dx.doi.org/10.1594/ecr2016/C-0199 |
Перевод на русский: Симанов В.А.
1.1. Варианты происхождения (отхождения) сосудов
1.1.1. Общее происхождение: два разных сосуда могут иметь одно и те же происхождение (отхождение)
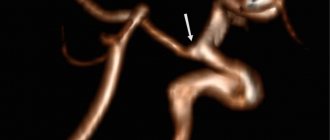
SCA / PCA: 2-22% Рис.3 :
Общий ствол отходит от основной артерии, затем разветвляется на заднюю мозговую артерию (PCA) и верхнюю мозжечковую артерию (SCA) [1].
PICA / AICA: распространенный вариант Рис.4:
Передняя нижняя мозжечковая артерия (AICA) разделяет общий ствол с задней нижней мозжечковой артерии (PICA) [2].
1.1.2. Воронка: 7-15% Рис.5:
Представляет собой воронкообразную дилатацию сосуда у места отхождения. Её диаметр должен быть не более 3мм. Наиболее часто встречается у места отхождения задней соединительной артерии (Pcom). Также подобный вариант был описан в передней соединительной артерии (Acom), глазной артерии и передней хориоидальной артерии [2].
1.1.3. Аномальное происхождение (отхождение) из-за персистирующего эмбрионального кровообращения:
Фетальный тип PCA :
Задние соединительные артерии являются терминальными ветвями базилярной артерии. В процессе развития РСА берут свое начало от внутренней сонной артерии (ICA). Такой вариант, если он сохраняется в постнатальном периоде, называется «фетальным происхождением». Этот вариант может быть классифицирован на два подтипа: Рис.6
- Полная фетальная PCA : 4-26% односторонняя, двусторонняя 2-4%.PCA полностью берет свое начало от ICA. P1 сегмент отсутствует, т.е., только ICA кровоснабжает затылочные доли [3]. При двустороннем полном фетальном типе PCA основная артерия может быть гипоплазирована Рис.7.
- Частичная фетальная PCA : 11-29% односторонняя, 1-9% двусторонняя. Р1 сегмент по — прежнему присутствует, но меньше или равен по диаметру Pcom, т.е. большая часть кровоснабжения затылочных долей осуществляется из ICA[3].
Персистирующая дорзальная глазная артерия (PDOA): 1,1% Рис.8, Рис.46 :
Во время эмбрионального развития, орбита снабжается кровью через переднюю и заднюю ветви, которые берут начало от ICA. Как правило, задняя ветвь облитерируется, а передняя ветвь продолжает кровоснабжать орбиту. Тем не менее, при данном варианте происходит обратное. PDOA входит в орбиту через верхнюю глазничную щель [4].
Глазная артерия также может отходить от других частей ICA, в том числе от кавернозного сегмента, у 8% населения [2] Рис.9.
ММА из глазничной артерии: 16% Рис.10 :
Во время эмбриогенеза средняя менингеальная артерия (ММА) отходит от стременной артерии (stapedial artery). Стременная артерия отдает ветви ECA. Одна из этих ветвей надглазничная артерия, которая образует анастомоз с развивающейся глазной артерией. Вдоль этого анастомоза, провал сегментарной регрессии или персистенция сегментов, которые должны регрессировать, приводят к ряду аномалий, таких как происхождение ММА из глазной артерии [2].В этом случае foramen spinosum будет отсутствовать.
Рис.3 TOF MRA, общий ствол PCA и SCA (красная стрелка) и ипсилатеральная доминантная позвоночная артерия (белая стрелка)
Рис.4 3D TOF MRA AICA (белая стрелка), идущая в каудальном направлении, кровоснабжающая территорию PICA. Обратите внимание на отсутствие PICA ипсилатерально. Контралатеральная PICA присутствует (зеленая стрелка).
Рис.5 3D TOF МРА, воронкообразное расширение (воронка) в месте отхождения Pcom (стрелка).
Рис.6 3D TOF MRA, полная фетальная PCA (белая стрелка) с отсутствием P1 сегмента с одной стороны и частичная фетальная PCA (красная стрелка) с гипоплазией P1 сегмента (зеленая стрелка) на другой стороне. Примечание фенестрация проксимальной части P1 сегмента (синяя стрелка).
Рис.7 3D TOF, полные фетальные PCA с обеих сторон и гипоплазированная базилярная артерия
Рис.8 Персистирующая дорсальная глазная артерия: MIP (а) и 3D (б) TOF MRA показывают глазную артерию, отходящую от задней поверхности ICA (стрелка на рисунке а) и отмеченную красным цветом (на рисунке b).
Рис.9 Кавернозное происхождение глазной артерии: вид сбоку MIP TOF (а), вид снизу 3D TOF MRA (b), и вид сбоку 3D rotational DSA (с), показывающие глазную артерию (белая стрелка), отходящую от латеральной поверхности кавернозного сегмента ICA. Обратите внимание на случайно обнаруженную аневризму Pcom (красная стрелка).
Рис.10 DSA (а), показывающая ММА (красная стрелка), отходящую от глазной артерии (белая стрелка). MIP реконструкция в костном окне КТ (b), показывающая отсутствие foramen spinosum с левой стороны. Foramen spinosum c правой стороны отмечено для сравнения (синяя стрелка).
Варианты развития артерий головного мозга и эпилепсия
Сложившиеся представления о механизмах развития церебральной ишемии подразумевают возникновение несоответствия между имеющимся кровоснабжением и потребностями мозговой ткани. К наиболее важным достижениям в области клинической ангионеврологии относится современная концепция гетерогенности ишемического инсульта, в основе которой лежит представление о многообразии причин и механизмов развития острого очагового ишемического повреждения мозга. Величина обратимого и необратимого повреждения мозга в значительной степени зависит от состояния гемодинамического, коллатерального, перфузионного и метаболического резервов мозга. Патологическая извитость магистральных артерий головы — наследственно детерминированная функциональная неполноценность соединительной ткани — встречается не менее чем у 10 % населения. Среди основньгх форм поражений интракраниальных артерий выделяют перегибы и петлеобразования, аневризматические расширения артерий, артериовенозные аневризмы. Чрезмерная извилистость сосудов способствует формированию в них тромбов. У 71 % больных с окклюзией артерий отмечен извитой ход сосудов. Недоразвитие артерий головного мозга в виде гипоплазии или стеноза задней нижней мозжечковой артерии и/или базилярной артерии, редко нижняя передняя мозжечковая артерия и извитость позвоночной артерии являются причинами снижения слуха и глухоты. Слабые анастомозы артерий головного мозга вызывают церебральную ишемию после дискэктомии шейного отдела позвоночника. При болезнях Паркинсона и Альцгеймера нейровизуализационные и патологоанатомические исследования в 20-30 % случаев обнаружили цереброваскулярные поражения, а в основе деменции может быть сосудистое заболевание головного мозга. Структурные изменения сосудов головного мозга, снижение скорости кровотока и наличие в 30 % стеноза в средней мозговой артерии могут стать предпосылками развития инсульта у больных с синдромом апноэ во сне.
При аномалии Киммерле необходимо учитывать наличие врожденных изменений позвоночных артерий. Диспластические нарушения в области краниовертебрального перехода в 2 раза чаще отмечены при патологической извитости позвоночных артерий, в меньшей степени за счет гипоплазии позвоночных артерий. До 51,9 % больных с мальформацией Киари и сирингомиелией имеют особенности строения артериального круга большого мозга. Извитости, асимметрии и гипоплазии позвоночных артерий с признаками нарушения кровотока характерны для вертебробазилярной недостаточности вследствие шейной дорсопатии и отмечены в 76,6 % случаев при центральном вестибулокохлеарном синдроме.
Артериальное русло головного мозга оказывается пораженным и при таких системных заболеваниях организма, как ревматоидный артрит, узелковый полиартериит, болезнь Такаясу, болезнь Шенлейна-Геноха, При проведении стоматологических манипуляций у больных с болезнью Штурге-Вебера или Реклингхаузена как типичных нейрофиброматозов возможно развитие угрожающего кровотечения. Первичное поражение церебральных артерий в виде васкулита и эндартериита лежит в основе развития нейросифилиса и приводит к вторичному страданию нервной ткани и возникновению инфарктов в головном мозге. Церебральный васкулит и герпетический церебральный васкулит могут развиться на фоне герпетической инфекции. При ишемических инсультах в 70 % наблюдений в ткани головного мозга, наряду с изменениями, обусловленными острым нарушением мозгового кровообращения, отмечаются очаговые поражения, сходные с изменениями при менингоэнцефалитах, вызванных опоясывающим и простым герпесом.
Изменения строения артерий головного мозга необходимо учитывать при оценке онкологических метастазов, а также у 40 % больных с тяжелой черепно-мозговой травмой при выявлении травматических субарахноидальных кровоизлияний и сопутствующего ангиографического вазоспазма.
По ходу выполнения изысканий по изучению взаимосвязи вариантов артерий головного мозга человека с цереброваскулярными расстройствами в рамках острых нарушений мозгового кровообращения и хронической ишемии головного мозга у нас сложились наблюдения о взаимосвязи вариантов строения и топографии артерий головного мозга человека с рядом других нозологических единиц. В этой связи мы представляем результаты собственных исследований о вариантах развития артерий головного мозга человека с различными видами эпилепсий.
Нами было проанализировано состояние артериального русла головного мозга 748 амбулаторных и стационарных пациентов от 22 лет до 81 года, находившихся на обследовании и лечении в неврологических и нейрохирургическом отделениях ОКБ № 2 им. профессора И.Н. Аламдарова г. Астрахани в период 1983-1998 гг., неврологических отделениях Городской больнтщы № 3 и Городской больницы № 4 г. Тамбова, нейрохирургическом отделении Тамбовской областной больницы, реабилитационно-оздоровительном комплексе семьи «Б. Липовица», неврологических кабинетах и в дневных стационарах Городской больницы № 4, Узловой поликлинике на ст. Тамбов ОАО «РЖД» и ЦДЛ ООО «Тамбовмедсервис», а также в амбулатории «Домашний доктор» (г. Тамбов) в течении 1998-2009 гг.
Всем пациентам проводилось комплексное клинико-инструментальное исследование, включающее данные клинического обследования невролога, терапевта и офтальмолога, стандартные лабораторные данные, электрокардиографию, флюорографию или обзорную рентгенографию органов грудной клетки. По показаниям были проведены консультации и обследования у нейрохирурга, гинеколога, отоларинголога, кардиолога, эндокринолога и психотерапевта; исследование когнитивной сферы по краткой шкале оценки психического статуса или миниисследование психического статуса, транскраниальная допплерография, электроэнцефалография. Всем пациентам были вьшолнены магнитно—резонансная томография (МРТ) и магнитно-резонансная ангиография (МРА).
Согласно полученным данным, варианты строения и топографии артериального круга большого мозга верифицированы всего в 27 случаях (61,4 % наблюдений) из 44 больных с эпилепсией или энцефалопатиями с ведущими эпилептиформными синдромами. Среди проанализированной группы пациентов с различными видами эпилепсий выявлены следующие варианты строения и топографтии артериального круга большого мозга: 1) изгиб обеих передних мозговых артерий у 1 (3,7 %) пациента; 2) гипоплазия левой позвоночной артерии у 2 (7,4 %) пациентов; 3) задняя трифуркация обеих внутренних сонных артерий и передняя трифуркация левой внутренней сонной артерии, гипоплазия базилярной артерии у 3 (11,1 %) пациентов; 4) передняя трифуркация левой внутренней сонной артерии, гипоплазия базилярной артерии у 6 (22,2 %) пациентов (рис. 1); 5) гипоплазия правой позвоночной артерии, аплазия задней соединительной артерии справа у 4 (14,8 %) пациентов; 6) гипоплазия правой позвоночной артерии, гипоплазия базилярной артерии у 5 (18,5 %) пациентов (рис. 2); 7) передняя трифуркация левой внутренней сонной артерии, гипоплазия задней соединительной артерии` гипоплазия правой задней мозговой артерии у 3 (11,1 %) пациентов;  извитость обеих позвоночных артерий у 2 (7,4 %) пациентов; 9) гипоплазия и извитость обеих позвоночных артерий у 1 (3,7 %) пациента, Ниже приведены достаточно показательные клинические наблюдения из совокупности собственных исследований.
извитость обеих позвоночных артерий у 2 (7,4 %) пациентов; 9) гипоплазия и извитость обеих позвоночных артерий у 1 (3,7 %) пациента, Ниже приведены достаточно показательные клинические наблюдения из совокупности собственных исследований.
Пример 1. Пациентка Н., 54 лет, наблюдается в Узловой поликлинике на ст. Тамбов ОАО «РЖД» с диагнозом: энцефалопатия как неуточненная (эпилептическая и дисциркуляторная) с полиморфными пароксизмами (по типу паралича Тодда) на фоне аномалий строения артерий головного мозга. Жалобы на шум в голове, шаткость при ходьбе, приступы слабости в правых конечностях и потери сознания. Неврологически: в сознании менингознаков нет, когнитивные функции снижены, эмоционально лабильна, зрачки d = s, конвергенция ослаблена, легкая слабость мимических мышц справа, парез правой кисти до 4 баллов, чувствительных нарушений нет, сухожильные рефлексы повышены d > s, в позе Ромберга пошатывание, координаторные пробы выполняет с промахиванием DetS, тремор век. Окулист: гипертонический ангиосклероз сосудов сетчаток обоих глаз. Терапевт: гипертоническая болезнь II степени, степень тяжести артериальной гипертонии II, категория риска 3. БАК: холестерин — 4,5 ммоль/л, β-липопротеиды — 3,5 г/л, креатинин — 69 мкмоль/л, мочевина — 7,9 ммоль/л. Протромбин — 88 %, фибриноген — 4.25 г/л. ЭКГ: син, ритм 80 в мин., нормальное положение ЭОС. МРТ и МРА: отображены на рисунке 1. Амбулаторное лечение: пирацетам, глицин, кавинтон, циннаризин, аминалон, энап, престариум, индопамин. Прошла курс лечения в дневном стационаре: мексидол, магния сульфат, престариум, индопамид, милдронат, эналаприл. Жалобы сохранились прежние. Неврологически — в сознании менингознаков нет, когнитивные функции снижены, черепные нервы без динамики парез правой кисти до 4,5 баллов, в пробе Ромберга пошатывание, координаторные пробы с интенцией с обеих сторон. Консультирована в Тамбовской психиатрической больнице, где поставлен диагноз: последствия органического поражения ЦНС сложного генеза с полиморфными пароксизмами. ЭЭГ: выраженные общемозговые изменения биори биоэлектрической активности, α-активности практически нет. По всем регионам полири менее 5 мкв. Регионарность, реакция активации отсутствуют, усвоения нет. Стойкая дезорганизация деятельности срединных структур. Заинтересованность левой височной области, где выявлен очаг медленноволнового раздражения. Низкое функциональное состояние коры с высокой чувствительностью ее к гипоксии, со снижением порога возбудимости ствола. Одиночные разряды заднестволовых отделов. Сосудистые влияния выражены. Катамнез: на фоне приема депакина-хроно жалобы значительно уменьшились, приступов не отмечено.
Пример 2. Пациент ВН., 21 год, наблюдается в Узловой поликлинике на ст. Тамбов ОАО «РЖД» с диагнозом: эпилепсия с полиморфными церебральными пароксизмами и когнитивными нарушениями. Наблюдается с детства — жалобы на приступы с потерей сознания. После начала лечения с 14 лет в неврологическом отделении Тамбовской областной детской больницы состоял на учете с диагнозом: эпилепсия, парциальные приступы с вторичной генерализацией. ЭЭГ (Психиатрия и наркология, 17.04.02): пароксизмальной активности не выявлено, Неустойчивый α-ритм. Дисфункция диэнцефальной области. Сосудистые влияния с повышенной вегетативной возбудимостью (15.06.04): ОМИ умеренные, но стойкие, с низкоамплитудной дизритмией. Регионарность нечеткая. Реакция активации снижена, усвоения нет. Грубой медленноволновой или пароксизмальной активности не выявлено. Снижена реактивность коры. Высокая вегетативная возбудимость. Сосудистые влияния 22.02.05: по сравнению с 15.06.04, положительная динамика. Общемозговые изменения умеренные, регуляторного характера. Умеренная дисфункция диэнцефальной области с усилением ее активности. Появился неустойчивый α-ритм, фрагментарный. Улучшилась реактивность коры. Несколько повысилась чувствительность коры к РФС, что приводит к снижению порога возбудимости заднестволовых структур. Пароксизмальных тенденций коры нет. Повышена вегетативная возбудимость. МРТ и МРА: отображены на рисунке 2. Неврологически: в сознании менингознаков нет, когнитивные функции несколько снижены, эмоционально лабилен, дистальный гипергидроз, тремор век и вытянутых пальцев рук, зрачки d = s, конвергирует, слабость мимических мышц справа, в позе Ромберга легкое пошатывание, координаторные пробы выполняет, парезов, чувствительных нарушений нет, сухожильные рефлексы d = s, симптом Бабинского слабоположителен с обеих сторон, Эпилептолог: когнитивные расстройства вследствие эпилепсии. Постоянно получает финлепсин (приступы связывает с нерегулярным приемом препарата).
Таким образом, считаем необходимым, сделать следующие выводы. 1. Варианты строения и топографии артериального круга большого мозга могут рассматриваться в качестве предикторов эпилептиформных феноменов структур головного мозга. 2. При различных церебральных пароксизмах, очевидно, есть целесообразность в исследовании артериального круга большого мозга. 3. Варианты строения и топографии артериального круга большого мозга в каждом конкретном случае следует рассматривать с точки зрения малых аномалий развития.
1.2. Изменение количества сосудов
1.2.1. Уменьшение количества сосудов
ICA агенезия : 0,01% Рис.11, Рис.47:
Примерно к 24 — му дню эмбриогенеза, ICA развивается из дорсальной аорты и третьей дуги. Впоследствии, примерно на 5 — й — 6 — й неделе, основание черепа начинает принимать свою форму. Таким образом, отсутствие ICA приведет к отсутствию каротидного канала, идентификация которого является наиболее практичным методом в определении этой аномалии в клинических условиях. Как правило, пациенты с агенезией ICA бессимптомны благодаря хорошо развитой коллатеральной циркуляции через ECA и вертебробазилярную систему [2].
Аплазия А1 сегмента: 1-2%. Рис.12 и Рис.15 :
В этой ситуации оба сегмента А2 кровоснабжаются из существующего A1 сегмента [2].
Azygos ACA: менее 1% Рис.13 :
Оба сегмента А1 образуют общий А2 сегмент, который кровоснабжает оба полушария[2].
Отсутствие Acom: 5% Рис.14 [2]:
Как правило, отсутствие передней соединительной артерии (Acom) не легко определить на времяпролетной МР-ангиографии, потому что артерия может присутствовать, но сигнал потока слишком слабый, чтобы быть визуализированным.
Отсутствие Pcom: 0,6% Рис.15 :
Задняя соединительная артерия (Pcom), как правило, меньше, чем P1 сегмент. Полное отсутствие редко [2].
Артерия Першерона (Percheron): 4-11.5% Рис.16 :
Таламо-мезенцефальное артериальное кровоснабжение может быть подразделено на 3 типа: тип 1 является наиболее распространенным, перфорантные артерии с обеих сторон отходят от P1 сегментов; тип 2, известный как артерия Першерона, отходящая от одного из P1 сегментов, кровоснабжающая обе стороны; тип 3 представляет собой арку, которая соединяет оба сегмента P1, и из которой берут начало перфорантные артерии [5].
1.2.2. Увеличение числа сосудов
Добавочная MCA: 2,7% Рис.17 :
Литературные определения добавочной средней мозговой артерии (MCA) и удвоения MCA довольно дихотомичны. В данной работе мы используем определение Teal и др., которые ограничили термин «добавочная MCA» ветвью, происходящей из передней мозговой артерии (ACA), а термин «удвоенная MCA» артерией, возникающей из дистального сегмента ICA [6]. Чтобы отличить добавочную MCA от удвоенной, доминирующий сосуд должен быть идентифицирован путем тщательного поиска бифуркации MCA. Сравнение с контралатеральной стороной также полезно, чтобы найти уровень бифуркации ICA [1].
Удвоение: относится к двум отдельным артериям, которые не демонстрируют дистального слияния. Например:
- Удвоение MCA: 0.2-2.9% Рис.18 : удвоенной MCA является артерия, которая отходит от ICA и проходит параллельно главному стволу MCA. Данный вариант не следует путать с ранним разветвлением MCA, при котором присутствует короткий единственный M1 сегмент. Его также не следует путать с передней височной ветвью, которая часто отходит от М1 сегмента.
- Удвоение Acom: 18% Рис.19 [1].
- Удвоение SCA: 14% Рис.12 [2].
Трифуркация:
- Трифуркация АСА: 2-13% Рис.20 : к трифуркации относится наличие трех сегментов А2 и описывается различными названиями, такими как перикаллезный триплекс, arteria mediana corporis callosi и персистирующая примитивная срединная артерия мозолистого тела [2]. Раннее отхождение фронто-полярной ветви, например, из Acom, может выглядеть как третий А2 сегмент.
Трифуркация MCA: 12% Рис.21 : Горизонтальный сегмент MCA делится на верхний и нижний стволы примерно у 78%. У 12% присутствует дополнительный (средний) ствол, данная ситуация называется трифуркацией, а наличие более 3-х стволов, например, квадрифуркация, наблюдается примерно у 10% Рис.22 [2].
Рис.11 Агенезия левой ICA. TOF MRA (а), отсутствие сигнал от потока в левой ICA. MIP СТА (с), CCA продолжается как ECA с отсутствием ICA. Костное окно КТ (b), отсутствие костного сонного канала на левой стороне. Нормальный сонный канал на правой стороне отмечен красной стрелкой для сравнения.
Рис.12 3D MRA, отсутствие А1 сегмента ACA, оба А2 сегмента, отходят с контралатеральной стороны. Обратите внимание на частичную фетальную PCA (белая стрелка), удвоение верхней мозжечковой артерии (синяя стрелка) и гипоплазию позвоночной артерии (красная стрелка), которая заканчивается, как PICA.
Рис.13 3D MRA, слияние обоих A1 сегментов с формированием единого А2 сегмента (azygos ACA) (стрелка).
Рис.14 3D TOF MRA, отсутствие Acom.
Рис.15 3D TOF, отсутствие Pcom и A1 сегмента на одной стороне. Значение этого варианта: в случае окклюзии ICA на этой стороне не будет возможности коллатерализации через Вилизиев круг. Случайная находка: аневризма терминальной части контралатеральной ICA (стрелка).
Рис.16 MIP (а) и 3D TOF (b), тип 2 таламо-мезенцефального артериального кровоснабжения (артерия Першерона) с одиночным артериальным стволом (стрелка), отходящим от P1 сегмента, ветви которого кровоснабжают обе стороны.
Рис.17 3D TOF, добавочная MCA (стрелка), отходящая от А1 сегмента.
Рис.18 3D TOF, удвоенная MCA (красная стрелка), отходящая от дистальной части ICA. Эту артерию не следует путать с передней височной ветвью (белая стрелка), являющейся частой находкой.
Рис.19 3D TOF, удвоение Acom (белые стрелки), фенестрация проксимальной части A2 сегмента (красная стрелка), аплазия А1 сегмента и полная фетальная PCA (синяя стрелка).
Рис.20 3D TOF, трифуркация АСА с тремя А2 сегментами (стрелки), третья ветвь возникает из Acom
Рис.21 3D TOF, трифуркация MCA с дополнительным средним стволом.
Рис.22 3D TOF, квадрифуркация MCA.
Всё о лечении гипоплазии позвоночных артерий
Большинство заболеваний, поражающих головной мозг, имеют сосудистую природу. Гипоплазия – не исключение. Это врождённая патология, затрагивающая внутричерепное кровоснабжение. Сущность заболевания, его симптомы, диагностика и лечение – вот предмет исследования данной статьи.
Большинство заболеваний, поражающих головной мозг, имеют сосудистую природу. Гипоплазия – не исключение. Это врождённая патология, затрагивающая внутричерепное кровоснабжение. Сущность заболевания, его симптомы, диагностика и лечение – вот предмет исследования данной статьи.
Диагностика
Выявить гипоплазию на ранних стадиях ее развития чрезвычайно сложно из-за отсутствия характерных симптомов и проявлений. Существует три основных метода диагностики сужения просвета позвоночных артерий, которые включают:
- Ультразвуковое исследование сосудов головы и шеи. В ходе проведения процедуры изображение артерии фиксируется с помощью аппарата УЗИ, после чего проводится анализ типа, интенсивности и диаметра кровотока (серьезным дефектом считается сужение диаметра сосудов до 2-х мм и меньше).
- Томография головы и шеи. Посредством компьютерных и магнитно-резонансных томографов оценивается состояние сосудов, заполненных специальным контрастным веществом.
- Ангиография. Рентгенографическое исследование, которое выявляет аномалии в строении сосудов и позвоночных артерий.
Кроме того, для диагностики сопутствующих заболеваний, которые могут повлиять на течение гипоплазии (например, патологии позвонков шейного отдела), врач может назначить дополнительные исследования.
- Гипоплазия левой позвоночной артерии: что это такое, причины и особенности лечения
На стадии ярко выраженных клинических симптомов гипоплазии правой или левой позвоночной артерии назначается консервативное лечение сосудорасширяющими препаратами – они устраняют неприятные явления и улучшают качество жизни пациента. В случаях, когда имеется риск образования тромбов, показан прием антикоагулянтов (медикаментов, разжижающих кровь).
Когда диагностируется гипоплазия позвоночной артерии
Именно в интракраниальном сегменте чаще всего наблюдается патологическое сужение позвоночных артерий. Диаметр этих магистральных сосудов неравномерен по всей длине и колеблется от самой малой величины — 2 мм, до просвета величиной в 4.5 мм. Нормальный диаметр ПА обычно лежит в пределах от 3.5 до 4 мм.
Гипоплазией позвоночной артерии считается ее критическое сужение до двух миллиметров. Также возможен врожденный обрыв или полное отсутствие одной из ветвей — такая патология называется аплазией.
- Неправильное положение плода в утробе матери, из-за чего он подвергается нежелательному механическому воздействию.
- Вынашивание беременности в негативных условиях, отрицательно сказывающихся на развитии эмбриона: употребление матерью алкоголя, наркотиков, курение;
- нахождение будущей роженицы во вредной среде (работа на химическом производстве, проживание на загазованной или радиоактивной территории );
- инфекционные патологии, травмы, прием лекарств, интоксикации, отравления в период беременности.
Синдром Барре-Льеу
Классический признак нарушения питания затылочной доли мозга. Дает головную боль, тошноту, редко рвоту.
Также снижается ориентация в пространстве, обнаруживается патологическая усталость и утомляемость.
Бессонница, депрессивный настрой, постоянно подавленное состояние, апатичность и нежелание что-либо делать.
Гипоплазия позвоночной артерии: что это такое?
Одной из самых распространенных патологий позвоночных артерий является их гипоплазия, то есть недоразвитость. Проявляется эта аномалия значительным сужением просвета сосуда (он становится менее 2 мм). Левая позвоночная артерия поражается чаще, чем правая. Возникает гипоплазия внутриутробно – это врожденная патология. Спровоцировать появление рассматриваемой болезни могут различные факторы:
- Вредные привычки будущей мамы.
- Употребление женщиной опасных лекарств на ранних сроках беременности.
- Внутриутробное инфицирование эмбриона.
- Влияние на беременную радиации.
Стоит также отметить, что довольно часто гипоплазия обнаруживается у детей, которые не имеют в анамнезе ни одного из перечисленных факторов.
Методики лечения
Для лечения гипоплазии позвоночных артерий применяются методы консервативной терапии и оперативное лечение.
Для лечения гипоплазии позвоночных артерий применяются методы консервативной терапии и оперативное лечение.
- Что такое гипоплазия правой или левой позвоночных артерий, как лечить это заболевание?
Диагностика гипоплазии позвоночной артерии головного мозга
При гипоплазии позвоночной артерии головного мозга присутствуют типичные клинические симптомы, которые являются прямым показанием для назначения ряда клинических исследований. Обычно диагностика включает в себя:
- рентгенографический снимок шейного отдела позвоночника;
- МРТ структур головного мозга;
- дуплексное сканирование церебральных кровеносных сосудов;
- ангиография с введением контрастного вещества.
Стоит обратить внимание на следующие негативные проявления болезни:
1.3. Изменение морфологии
1.3.1. Гипоплазия
Гипоплазия ICA: 0,079% Рис.23 :
В отличие от агенезии, тонкий сосуд идентифицируется. Опять же, томография основания черепа полезна для визуализации костного сонного канала, который при гипоплазии тоньше, чем обычно [2].
Гипоплазия A1: 10% Рис.24 :
Асимметрия А1 сегментов наблюдается в 80% случаев. Гипоплазия определяется при диаметре сосуда меньше, чем 1,5мм [2].
Гипоплазия A2 (bihemispheric ACA): 7% Рис.24 :
Один из сегментов А2 гипоплазирован. В этом варианте кровоснабжение ипсилатерального полушария происходит в основном из контралатерального (доминирующего) А2 сегмента [2].
Гипоплазия Pcom: 34% Рис.25 :
но полное отсутствие является редкой находкой [2].
Гипоплазия позвоночной артерии:
50% с правой стороны (левая доминантная), 25% левосторонняя (правая доминантная), 25% кодоминантные. Примерно у 0,2% позвоночная артерия заканчивается в PICA Рис.12 и Рис.26 [7] [2]
1.3.2. Гиперплазия
Гиперплазия передней хориоидальной артерии: 2,3% Рис.27 :
Передняя хориодальная артерия отходит от задней поверхности терминального сегмента ICA, дистальнее места отхождения Pcom. Это, как правило, небольшая ветвь. Если она увеличена (гиперплазирована), то кровоснабжает часть территории задней мозговой артерии (затылочно-височной ветви) [1, 2].
1.3.3. Ранняя бифуркация (раннее деление):
Ранняя бифуркация MCA : это частая находка Рис.28 :
Горизонтальный сегмент MCA, как правило, длиной 12 мм, но может быть короче, с ранним разветвлением (би- или трифуркация) [1].
1.3.4. Фенестрация: 0,7% с учетом всех внутричерепных сосудов Рис.6 , Рис.19 и Рис.29 . Фенестрация является разделением просвета артерии на два отдельных канала. Каждый канал имеет свой собственный эндотелий и мышечный слой и могут разделять адвентицию. Эти два канала сливаются дистальнее. Фенестрация чаще наблюдается в задней циркуляции [1, 2].
- Фенестрация А1: 0-4% [1]
- Фенестрация А2: 2% Рис.19 [1]
- Фенестрация Acom: 12-21% [1]
- Фенестрация позвоночной артерии Рис.29 : 0,3-2% [1].
Фенестрация базилярной артерии Рис.29 : 0.12-1.33%: основная артерия образована путем слияния двух продольных невральных артерий. Неполное слияние приводит к сегментарной фенестрации, которая обычно присутствует в проксимальном сегменте базилярной артерии [2].
Рис.23 CTA (а), гипоплазированная ICA (стрелки). Костное окно КТ (b) асимметричный костный сонный канал
Рис.24 3D TOF, гипоплазия А2 сегмента (белая стрелка) и контралатеральный доминантный A2 сегмент «bihemispheric АСА». Обратите внимание на гипоплазию A1 сегмента (красная стрелка).
Рис.25 MIP CTA, гипоплазия правой Pcom (стрелка). Обратите внимание на патологическую окклюзию контрлатеральной ICA.
Рис.26 3D TOF, гипоплазия позвоночной артерии (белая стрелка), которая заканчивается, как PICA (зеленая стрелка).
Рис.27 3D TOF, гиперплазия передней хориоидальной артерии (белая стрелка). Контралатеральная передняя хориоидальная артерия нормального калибра (зеленая стрелка). Красная стрелка указывает на фетальную PCA, синяя стрелка на Pcom.
Рис.28 3D MRA, ранняя бифуркация с коротким пребифуркационным сегментом М1 (стрелка).
Рис.29 Фенестрация А1 сегмента (а), Acom (b), M1 сегмента (с), V4 сегмент (d) и проксимальной части основной артерии (е).
Симптомы
Симптомы хронического нарушения кровообращения мозга зависят от сосудистого бассейна, в котором развивается ишемия ткани мозга. Всех пациентов может беспокоить:
- головная боль;
- головокружение;
- шум в голове;
- ухудшение памяти;
- нарушения сна.
Для гипоплазии артерий каротидного бассейна также характерны слабость и/или онемение в конечностях, нарушения речи. Для ишемии в бассейне позвоночных артерий – нарушения координации, неустойчивость походки.
Для диагностики гипоплазии мозговых артерий и определения лечебной тактики проводятся:
- церебральная ангиография – рентгеновское исследование артерий мозга с введенным в них контрастным веществом;
- КТ-ангиография;
- МР-ангиография;
- ультразвуковое исследование (дуплексное сканирование) сосудов шеи и головы;
- ПЭТ;
- однофотонно-эмиссионная компьютерная томография.
Консервативную терапию препаратами, улучшающими кровоснабжение и метаболизм головного мозга, проводят, если данные выполненного обследования позволяют заключить, что она сможет предотвратить дальнейшее усиление ишемии мозга и ишемический инсульт.
1.4. Изменение хода
1.4.1. Аберрантная латеральная глоточная ICA, извитая ICA и «целующиеся» сонные артерии:
Во время эмбрионального развития, ICA, как полагают, чтобы начать разматываться как дорсальный корень аорты, спускается в грудную клетку, что дает прямой путь для ICA. Сбой в разматывании приводит к извилистости ICA, которая проходит в непосредственной близости от средней линии задней стенки глотки, и называется аберрантной латеральной глоточной артерией [6].
Такая морфология чаще наблюдается у пациентов пожилого возраста или у пациентов с артериальной гипертензией, но её не следует путать с эмбриональным вариантом, хотя оба варианта имеют одинаковое значение (см ниже). Частота аберрантной латеральной глоточной ICA составляет около 5%, но точная распространенность аномалии не известна, так как она не может быть морфологически отдифференцирована от извитости. Исследования, проведенные Ekici и соавт. показали, что наименее вовлеченной возрастной группой с извитостью ICA была младшая возрастная группа [8].
Термин «целующиеся сонные артерии» описывает удлиненные сонные артерии ,которые соприкасаются по средней линии; могут наблюдаться заглоточно или интрасфеноидально / интраселлярно Рис.30 [2].
1.4.2. Персистирующая примитивная обонятельная артерия: 0,14%
ACA происходит из примитивной обонятельной артерии, которая регрессирует с образованием возвратной артерии Хюбнера (Heubner). Нарушение регрессии приводит к сохранению примитивной обонятельной артерии. Эта артерия имеет крайний передне-нижний ход в сегменте А1, который перемещается вдоль обонятельного тракта перед задне-верхним переходом к А2 сегменту, образуя конфигурацию в форме шпильки [9].
1.4.3. Персистирующий эмбриологический анастомоз
+ персистирующий каротидно-вертебробазиларный анастомоз:
Во время эмбрионального развития, передняя циркуляция питает задний мозг через несколько анастомозов, так как задняя циркуляция пока еще недостаточно развита. После развития позвоночных артерий, эти анастомозы регрессируют. Нарушение регрессии приводит к аномальному сообщению между передней и задней циркуляцией в постнатальном периоде. Наиболее распространенной формой этих анастомозов является фетальный тип PCA (см. варианты происхождения/отхождения сосудов). Распознавание хода этих аномальных сосудов, а также уровень входа в череп, имеют решающее значение для их дифференциации Таблица 1
- персистирующая тригеминальная артерия (PTA): 0,1-0,2% Рис.31 Рис.48 : PTA берет свое начало от кавернозного сегмента ICA и сообщается с основной артерией. Проксимальнее уровня анастомоза базилярная артерия, как правило, гипоплазирована. На ангиограмме, при виде сбоку, имеет характерную конфигурацию «трезубец Нептуна» или Tau sign, напоминающий греческую букву «Tau » [1] [2]. Имеются две различные классификации Таблица 2 Рис.32 и Рис.33 [10].
- Варианты PTA (Saltzman III): 0.18-0.76%: Артерии, которые кровоснабжают заднюю черепную ямку, отходящие от прекавернозного сегмента ICA и не сообщающиеся с базилярной артерией [1].
- Персистирующая ушная артерия (otic artery): самый редкий каротидно-вертебробазилярный анастомоз. Существование ушной артерии спорно, поскольку она не идентифицирована у низших животных. Она проходит от каменистого сегмента ICA к базилярной системе через внутренний слуховой канал [2].
- Персистирующая примитивная подъязычная артерия (PPHA): 0.03-0.26% Рис.34 Рис.49 : Эта артерия идет от шейного сегмент ICA к базилярной артерии через подъязычный канал. Позвоночная артерия гипоплазирована. КТ основания черепа показывает увеличенный костый подъязычный канал [1, 2].
- Proatlantal intersegmental artery: очень редко. Соединяет шейный сегмент ICA или наружную сонную артерию (ECA) с вертебробазилярной системой. Артерия входит в основание черепа через большое затылочное отверстие, что позволяет отдифференцировать её от подъязычной артерии. Есть два типа:
- Тип I: впадает в позвоночную артерию над атласом.
- Тип II: впадает в позвоночную артерию через атлас [1, 2].
+ персистирующий внутренний-наружный сонный анастомоз
- Аберрантная интратимпаническая ICA: очень редко. Этот вариант является анастомозом между ICA и ECA, поскольку он, как полагают, возникает из-за агенезии шейного сегмента ICA и развития анастомоза между горизонтальным (каменистым) сегментом ICA и увеличенной нижней барабанной артерией, являющейся ветвью ECA. ICA (или, вернее, увеличенная нижняя барабанная артерия) в этом случае имеет меньший диаметр, чем обычная ICA, с отсутствием восходящей части сонного канала, как он входит в основание черепа, кзади и параллельно яремной луковице, которая напоминает массу в hypotympanum; также отсутствует костная пластина между сонным каналом и барабанной полостью [1].
- Персистирующая стремянная артерия (stapedial artery): 0,48%. Эта аномалия возникает в связи с сохранением анастомоза через стремянную артерию, которая обычно присутствует в процессе развития между ECA и ICA. Артерия начинается от каменистого сегмента ICA, проходит через запирательное отверстие и заканчивается как ММА в эпидуральном пространстве средней черепной ямки. КТ основания черепа может показать небольшой канал возле сонного канала. Foramen spinosum, которое содержит ММА, будет отсутствовать. персистирующая стремянная артерия может быть ассоциирована с аберрантной ICA [1, 2].
В таблице 3 приведена частота обсуждаемых вариантов, тем не менее, существуют и другие редкие варианты, которые не могут быть включены в один документ. И, наконец, наличие полностью развитого Виллизиева круга можно считать вариантом, поскольку он присутствует менее чем у 50% популяции [2]
* N.B.: частота варьируется между авторами в зависимости от типа проведенного исследования (КТ, МРТ, хирургическое или посмертное). Частота также может варьироваться в зависимости от географического распределения; опубликованные данные не всегда могут быть применимы к другим группам популяции.
Таблица 1: Типы персистирующих каротидно-вертебробазилярных анастомозов
Таблица 3: встречаемость анатомических вариантов
Рис.30 корональная MIP CTA пациента с историей гипертензии показывает удлиненные сонные артерии, достигающие средней линии («целующиеся» сонные артерии).
Рис.31 3D TOF, вид сбоку (а) и сверху (b), персистирующая примитивная тригеминальная артерия (красная стрелка), отходящая от кавернозного сегмента ICA и сообщающаяся с базилярной артерией, которая до уровня анастомоза гипоплазирована(белая стрелка). В боковой проекции аномальная артерия с ICA напоминают трезубец Нептуна и греческую букву «tau».
Рис.32 MIP CTA персистирующей примитивной тригеминальной артерии (красная стрелка) в двух различных случаях. По словам Salas есть 2 вида: медиальный сфеноидальный или интраселлярный (а), который проходит в турецкое седло и перфорирует твердую мозговую оболочку или спинку седла (зеленая стрелка), как в этом случае, и латеральный каменистый или параселлярный (b), при котором сосуд идет с сенсорными корешками тройничного нерва, сбоку от турецкого седла.
Рис.33 3D TOF, показаны два различных случая персистирующей примитивной тригеминальной артерии (красная стрелка). Классификация в соответствии с Saltzman: Тип I (а), в котором РТА кровоснабжает верхнюю часть базилярной артерии, включая заднюю территорию, и тип II (b) с фетальной PCA (белая стрелка).
Рис.34 3D CE MRA косая (а) и задняя (b) проекции, показывающие персистирующую примитивную подъязычную артерию (красная стрелка), которая отходит от шейного сегмента ICA (зеленая стрелка) и продолжается как вертебробазилярная артерия (синяя стрелка). ECA отмечена белой стрелкой.
Значение
В списке на Рис.35 приведены значения анатомических вариантов.
2.1. Распознавание анатомических паттернов и способность отличать их от патологических изменений:
2.1.1. Знание нормальных вариантов является частью анатомических знаний, которые важны для каждого радиолога и хирурга. Знание нормальных вариантов и их близость к другим структурам облегчает понимание и диагностику различных заболеваний, таких, как:
- Невралгия тройничного нерва, которая может быть вызвана наличием варианта РТА (реже РТА), из-за близости сосуда к тройничному нерву [11].
- Языкоглоточная невралгия или паралич подъязычного нерва, который может быть вызван персистирующей подъязычной артерией [1].
- Пульсирующий звон в ушах в случаях персистирующей стремянной артерии [1].
2.1.2. Вариант против патологии:
- Воронка: воронку Pcom не следует путать с аневризмой Рис.36.
- Гипоплазия ICA может быть спутана с диссекцией или фибромускулярной дисплазией, в то время как агенезия ICA может быть спутана с окклюзией. Визуализация основания черепа способствует дифференциации, так как костный сонный канал будет узким в случаях гипоплазии и отсутствует при агенезии, но будет выглядеть нормально при других приобретенных заболеваниях Рис.11 и Рис.23.
- Различные паттерны перфузионных нарушений могут встречаться с нормальными вариантами, которые могут вызвать путаницу, особенно в контексте инсульта:
- Асимметрия КТ- или МР-перфузии в затылочных долях, в случае односторонней фетальной PCA. Контралатеральная сторона может показать замедленную перфузию, поскольку она кровоснабжается из задней циркуляции Рис.37 .
- Двусторонняя задержка перфузии в затылочных долях по сравнению с лобными и теменными долями может наблюдаться при двустороннем отсутствии Pcom Рис.38 .
- Относительная гипоперфузия на территории PICA в случаях гипоплазии позвоночной артерии. Гипоперфузия может быть представлена, как удлинение времени до пика (time-to-peak), удлинение основного времени прохождения (main transit time) или уменьшение мозгового кровотока (cerebral blood flow), но это никогда не влияет на мозговой объем крови (cerebral blood volume) Рис.39 [12].
2.2. Гемодинамический эффект нормальных вариантов и аномалий:
2.2.1. Понимание функционирования коллатералей: наличие гипоплазии или аплазии сегмента (-ов) в Виллизиевом круге может повлиять на функционирование коллатералей, при окклюзии одной или нескольких артерий Рис.15 .
2.2.2. Объясняет неясные случаи инсульта:
Сосудистые условия, которое вызывают изменения в неожиданных сосудистых территориях, могут быть объяснены нормальными вариантами, такими как:
- Ишемия в задней территории может сопровождать патологию ICA из — за наличия фетальной PCA Рис.40.
- Двусторонняя ишемия и ишемия в определенных зонах, могут обратить внимание на наличие патологии в одном из вариантов, таких, как:
- Двусторонний передний инфаркт в случае тромбоэмболии azygos ACA или доминантной bihemispheric ACA Рис.41.
- Двусторонний мезэнцефалоталамический инфаркт с артерией Першерона Рис.42.
2.3. Ассоциация с сосудистыми и несосудистыми врожденными аномалиями и другими заболеваниями:
2.3.1. Ассоциация с аневризмами: изменения в сосудистой анатомии могут быть признаком недостатка сосудистой зрелости и уязвимости к формированию аневризм. В работе Lazzaro и др., нормальные варианты Виллизиева круга были более распространены в случаях с разрывом аневризм, чем в случаях аневризм без разрыва [13]. На основании обзора литературы, следующие варианты и аномалии были ассоциированы с аневризмами: Таблица 4 Рис.43
- Фенестрации: частота аневризм (IoA) примерно 7% от всех фенестраций. Дефект в медии фенестрированного сегмента и турбулентный поток на обоих концах фенестрации может привести к образованию аневризмы. Кроме того, в работе Hudák и др., фенестрация была частой находкой у больных с необъяснимым субарахноидальным кровоизлиянием из-за слабой артериальной стенки [1] [2] [14]
- ICA агенезия и гипоплазия: IoA 67% [2].
- Аплазия A1 сегмента: IoA14% [15].
- Azygos ACA: IoA 41%. В связи с увеличением потока из обоих сегментов A1 [2].
- Персистирующая дорсальная глазная артерия: IoA 45% [4].
- Персистирующая примитивная обонятельная артерия: в работе Uchino и др, 2 аневризмы внутричерепных артерий были обнаружены у 14 пациентов с PPOA (IoA около 14%); один из них в изгибе шпильки (7%) [9].
- PTA: IoA 14% [1].
- Персистирующая подъязычная артерия: IoA 26% [16].
- Proatlantal intersegmental artery: IoA 10% [1, 2]
- Другие варианты и аномалии, ассоциированные с аневризмами, случаи о которых сообщались, но не доступны, включают infraoptic АСА, верхнюю переднюю соединительную артерию, добавочную MCA, аплазию MCA, вариант PTA и асимметрию Виллизиева круга [1, 2].
2.3.2. Ассоциация с другими сосудистыми аномалиями и заболеваниями:
- фенестрация позвоночной артерии ассоциирована с артериовенозной мальформацией в 7% [6].
- РТА наблюдается при сосудистых аномалиях, таких как АВМ, каротидно-кавернозная фистула, и болезнь Мойа-мойа в 25% случаев [17].
- Proatlantal intersegmental artery: частота цереброваскулярных нарушений, таких как АВМ, мальформация вены Галена и варианты дуги аорты, составляет 59% [18].
- Спонтанная диссекция позвоночной артерии встречалась немного чаще у лиц с гипоплазией позвоночной артерии, чем в контрольной группе (30,4% против 17,4%). Также было установлено, что спонтанная диссекция позвоночной артерии встречается чаще при гипоплазии позвоночных артерий, нежели при доминантных позвоночных артериях (68% против 32%) [19].
2.3.3. Ассоциация с другими врожденными аномалиями:
- Azygos ACA может быть ассоциирована с голопрозэнцефалией и аномалиями миграции Рис.44 [1].
- Гипоплазия ICA, ассоциирована с анэнцефалией и базальной телеангиоэктазией [2].
- фенестрация позвоночной артерии может быть ассоциирована с слиянием позвонков [6].
2.3.4. Ассоциация с другими расстройствами:
- Дисфункция гипофиза и акромегалия при интраселлярных «целующихся» сонных артериях[2].
- Было установлено, что мигрень с аурой чаще встречается у пациентов с незамкнутым Виллизиевым кругом [20].
2.4. Предоперационное планирование для черепно-мозговой хирургии, хирургии головы и шеи и нейроинтервенционных процедур:
Описание нормальных вариантов очень важно для хирургов и интервенционных радиологов, так как некоторые из этих вариантов следует учитывать, чтобы избежать катастрофических последствий во время вмешательства.
2.4.1. Риск катастрофических кровоизлияний существует в следующих случаях:
- Транссфеноидальные операции на гипофизе в случаях PTA или интраселлярных «целующихся» сонных артериях.
- Операции на среднем ухе в случаях персистирующей стремянной артерии и аберрантной интратимпанической ICA.
- Глоточные операции, такие как резекция отофарингеальной опухоли, тонзиллэктомия, аденоидэктомия и палатофарингопластика, в случаях аберрантной латеральной глоточной артерии.
2.4.2. Знание нормальных вариантов имеет важное значение в интервенционных процедурах. Это знание может помочь получить доступ к сосудам, например, доминантная против гипоплазированной позвоночной, или доступ через вариант, или избежать осложнений во время процедур, таких как эмболизация опухоли, через катетеризацию ECA в случаях с ММА отходящей от офтальмической артерии, что может привести к слепоте. Рис.45 Рис.50
2.4.3. Наличие персистирующих каротидно-базилярных анастомозов следует исключать перед определенными процедурами, такими как тест Wada: так как в этом случае инъекция амитала может привести к потере сознания и апноэ [2]
Рис.35 Значение нормальных вариантов
Таблица 4: Варианты, ассоциированные с аневризмами и их встечаемость
Рис.36 3D TOF MRA, воронкообразное расширение с месте отхождения Pcom (белая стрелка), которое не следует путать с аневризмой. Обратите внимание на небольшую аневризму в месте отхождения контрлатеральной Pcom (красная стрелка). Также обратите внимание на трифуркацию АСА.
Рис.37 МР-перфузия, TTP map (а) показывает замедленную перфузию в левой затылочной доле, по другим параметрам перфузии никаких отклонений не обнаружено. 3D TOF (b), показывает фетальную PCA на контралатеральной стороне (стрелка).
Рис.38 TTP perfusion map (а) показывает симметричную задержку в затылочных долях, никаких отклонений в других параметрах перфузии замечено не было. 3D TOF показывет отсутствие Pcom с обеих сторон.
Рис.39 (тот же пациент, что и на рисунке 12) с гипоплазией правой позвоночной артерии, которая заканчивается, как PICA. TTP map показывает задержку перфузии на территории правой PICA. Исследование, проведенное через 6 недель, по другим причинам (не показано) показало отсутствие патологии на этой территории.
Рис.40 МРТ 56-летнего пациента с жалобами на головную боль показывает диссекцию левой ICA (красные стрелки) с интрамуральной гематомой на Т2 (а) и T1FS (b). DWI (с) и ADC (d) показывают подострый инфаркт на территории левой PCA, который обусловлен наличием фетальной PCA (TOF не показана).
Рис.41 72-летний пациент с гемиплегией, эпилепсией и нарушением сознания. DWI (а) и ADC (b) показывают двусторонние инфаркты на территории ACA. DSA (с), показывает проксимальную окклюзию azygos ACA (стрелка).
Рис.42 Двусторонние острые инфаркты таламусов на DWI (а). DSA показывает окклюзию P1 сегмента левой PCA (b). Минимальная реканализация после внутриартериального тромболизиса (с), с легким помутнением артерии Першерона (стрелки), отходящей от левой PCA.
Рис.43 Аневризмы (стрелки), ассоциированные с аномалиями; а) аплазия А1 с аневризмой Acom. b) Azygos ACA с перикаллозной аневризмой. с) фенестрация основной артерии с проксимальной базилярной аневризмой после койлинга.
Рис.44 Аксиальные (а) и сагиттальные (b) МРТ изображения ребенка с голопрозэнцефалией, слиянием поясных извилин спереди и ненормальными клювом и коленом мозолистого тела. Обратите внимание на пустоту потока передней мозговой артерии (стрелка), которая является одиночной (azygos) и смещена кпереди.
Рис.45 55-летняя пациентка, попавшая в ДТП. Первоначальная КТ (а), показывает перелом левой височной кости. Позже она жаловалась на пульсирующий шум в ушах. Была выполнена DSA (с) с flat panel CT angiography (b и d). Восстановленные изображения показали среднюю менингеальную артерию (желтые стрелки), отходящую от глазной артерии (синяя стрелка) и травматическую АВМ (красные стрелки) дренирующуюся в наружную яремную вену с образованием аневризмы (оранжевая стрелка). Знание такого варианта имеет важное значение при планировании терапии.
Ишемический инсульт в бассейне задних мозговых артерий: проблемы диагностики, лечения
И.А. ХАСАНОВ, Э.И. БОГДАНОВ
Республиканская клиническая больница МЗ РТ, г. Казань
Казанский государственный медицинский университет
Хасанов Ильдар Акрамович
врач неврологического отделения для больных с острыми нарушениями мозгового кровообращения
420064, г. Казань, ул. Оренбургский Тракт, д. 138, тел. (843) 237-35-47, e-mail
В статье в свете современных данных рассматриваются проблемы диагностики и лечения ишемических инсультов в бассейне задних мозговых артерий (ЗМА) с учетом особенностей их этиологии, клинической картины и данных нейровизуализации.Парные задние мозговые артерии, формирующиеся путем бифуркации базилярной артерии и являющиеся ее терминальными ветвями, служат основными источниками кровоснабжения верхней части среднего мозга, таламусов и задне-нижних частей полушарий головного мозга, включая затылочные доли, медиобазальные отделы височных долей и нижнемедиальные отделы темени.Ишемические инсульты в бассейне задних мозговых артерий составляют, по разным данным, от 5-10 до 25% случаев всех ишемических инсультов.Наиболее частой причиной изолированных инфарктов в бассейне ЗМА является эмболическая окклюзия ЗМА и ее ветвей, которая имеет место примерно в 82% случаев.В 9% случаев в ЗМА выявляется тромбоз in situ, еще в 9% случаев причиной инсульта служат вазоконстрикция, связанная с мигренью, и коагулопатии.Очень редкой причиной инфаркта в данном бассейне может быть и артериальная диссекция, затрагивающая ЗМА.Наиболее частыми и характерными признаками инфарктов в бассейне ЗМА являются зрительные нарушения (гомонимная гемианопсия), центральный парез лицевого нерва, головная боль, нарушения чувствительности, афатические нарушения, гемипарез и ниглект.
Ключевые слова:
ишемический инсульт, инфаркт мозга, задняя мозговая артерия, нейровизуализация, тромболитическая терапия
I.A. KHASANOV, E.I. BOGDANOV
Kazan State Medical University
Republican Clinical Hospital of the Ministry of Health of the Republic of Tatarstan, Kazan
Ishemic stroke in a system of posterior cerebral arteries: problems of diagnosis and treatment
In the article on the basis of present knowledge are considered the problems of diagnosis and treatment of ishemic strokes in a system of posterior cerebral arteries (PCA) taking into account their causation, clinical presentation and neuroimaging data.Paired posterior cerebral arteries, which are shaped by basilar artery bifurcation and are its terminal branches, are the main sources of blood supply of the upside of midbrain, thalamus and back and bottom parts of cerebral hemispheres, including occipital lobes, mediobasal branches of temporal lobes and lower medial crown branches.Ishemic strokes in a system of posterior cerebral arteries amount to 5-10% or up to 25% of all ishemic strokes.The most common cause of isolated heart attacks
in a system of PCAistheembolic occlusionof PCAand its branches, which occurs in about 82% of cases.In 9% of cases in PCAisrevealed thrombosis, inother9% of cases the cause of stroke are vasoconstriction associated with migraine, and coagulopathy.A very seldom reason for a heart attack in this system can be artery dissection which affects PCA.The most frequent and characteristic features of heart attacks in a system of PCA are visual impairments (equilateral hemianopsia), central paresis of facial nerve, headache, sensation disorders, aphatic disorders, hemiparesis and neglect.
Key words:
ischemic stroke, cerebrovascular accident, posterior cerebral artery, neuroimaging, thrombolytic therapy.
Ишемические инсульты в бассейне задних мозговых артерий (ЗМА) составляют, по разным данным, от 5-10 до 25% случаев всех ишемических инсультов [1-4]. Они могут явиться причиной целого ряда клинических симптомов, далеко не всегда своевременно и адекватно распознающихся самими пациентами, их родственниками и врачами, ведь остро возникший грубый моторный дефицит, с которым обычно ассоциируется инсульт, в этом случае может быть невыраженным или вовсе отсутствовать. Отсрочка в своевременной диагностике или некорректный диагноз ставят под сомнение возможность проведения больному адекватной терапии (прежде всего тромболизиса), что в свою очередь не может не влиять на исход болезни [5]. Большую роль в постановке диагноза играет возможность использования нейровизуализации, правильный выбор метода и грамотная интерпретация результатов [2]. Видится важным представление и анализ особенностей клинической картины, нейровизуализации и лечения ишемических инсультов в бассейне задних мозговых артерий в свете современных данных.
Наиболее частой причиной изолированных инфарктов в бассейне ЗМА является эмболическая окклюзия ЗМА и ее ветвей, которая имеет место в 82% случаев. При этом кардиогенный генез наблюдается в 41% случаев, в то время как артерио-артериальная эмболия из позвоночных и базилярной артерий — лишь в 32% случаев. У 10% пациентов источник эмболии установить не удается. В 9% случаев в ЗМА выявляется тромбоз in situ. Вазоконстрикция, связанная с мигренью, и коагулопатии являются причинами инфаркта мозга в 9% случаев [6]. Если изолированные инфаркты в бассейне ЗМА в большинстве случаев имеют кардиоэмболическую природу, то вовлечение ствола мозга и/или мозжечка в сочетании с инфарктом в бассейне ЗМА наиболее часто связано с атеросклеротическим поражением сосудов вертебробазилярного бассейна [7, 8]. Очень редкой причиной инфаркта в данном бассейне может быть и артериальная диссекция, затрагивающая ЗМА [9]. Вне зависимости от причины инфаркта обычно он лишь частично захватывает бассейн ЗМА [10, 11].
Парные задние мозговые артерии, формирующиеся путем бифуркации основной артерии и являющиеся ее терминальными ветвями, служат основными источниками кровоснабжения верхней части среднего мозга, таламусов и задне-нижних частей полушарий головного мозга, включая затылочные доли, медиобазальные отделы височных долей и нижнемедиальные отделы темени [10, 12, 13].
На ранних стадиях развития организма человека задняя мозговая артерия представляет собой ветвь внутренней сонной артерии (ВСА) и кровоснабжается из системы каротид, при этом задняя соединительная артерия (ЗСА) исполняет роль ее проксимального сегмента. В последующем кровь в задние мозговые артерии начинает поступать из основной артерии, а ЗСА, являясь ветвью внутренней сонной артерии, становится наиболее значимым анастомозом между каротидным и вертебробазилярным бассейнами. По разным данным, от 17 до 30% взрослых людей имеют фетальный (эмбриональный) тип строения ЗМА, при котором ВСА в течение всей жизни остается основным источником кровоснабжения ЗМА. Фетальный тип строения ЗМА в большинстве случаев наблюдается унилатерально, при этом противоположная ЗМА обычно начинается от асимметрично расположенной, изогнутой базилярной артерии. В случаях, когда обе задние мозговые артерии являются ветвями внутренних сонных артерий, как правило, наблюдаются хорошо развитые крупные задние соединительные артерии, а верхний сегмент базилярной артерии бывает короче, чем обычно (базилярная артерия заканчивается отходящими от нее двумя верхними мозжечковыми артериями). Примерно в 8% случаев обе ЗМА исходят из одной и той же ВСА [7, 8, 12, 14, 15].
ЗСА впадает в ЗМА примерно на 10 мм дистальнее места бифуркации базилярной артерии. Каждую ЗМА условно можно разделить на 3 части: предкоммуникационная часть, или Р1-сегмент по Фишеру, — участок ЗМА проксимальнее места впадения в нее ЗСА, посткоммуникационная часть, или Р2-сегмент, расположенный дистальнее места впадения ЗСА в ЗМА, и конечная (корковая) часть, отдающая ветви к соответствующим областям коры головного мозга [12, 16]. От предкоммуникационной части отходят парамедианная мезенцефалическая, задняя таламоперфорирующая и медиальная задняя хороидальная артерии, участвующие преимущественно в кровоснабжении вентролатеральных ядер таламуса и медиального коленчатого тела. Левая и правая задние таламоперфорирующие артерии могут отходить от общего ствола, называемого артерией Першерона; подобный вариант строения обычно встречается в сочетании с односторонней гипоплазией Р1-сегмента и фетальным строением ЗМА. Ветвями посткоммуникационной части являются педункулярные перфорантные, таламо-геникулятная и латеральная задняя хороидальная артерии, кровоснабжающие латеральное коленчатое тело, дорсомедиальные ядра и подушку таламуса, часть среднего мозга и латеральную стенку бокового желудочка [2, 12, 17]. Основными корковыми ветвями ЗМА являются передняя и задняя височные, теменно-височная и шпорная артерии [10]. Границы водораздела бассейнов средней и задней мозговых артерий значительно колеблются. Обычно границей бассейна ЗМА служит сильвиева борозда, но иногда средняя мозговая артерия кровоснабжает и наружные отделы затылочной доли вплоть до затылочного полюса. При этом ЗМА всегда снабжает кровью участки коры головного мозга в области шпорной борозды, а зрительная лучистость в ряде случаев получает кровь из средней мозговой артерии, соответственно, гомонимная гемианопсия не всегда подразумевает инфаркт в бассейне ЗМА [12].
При ишемических инсультах в бассейне ЗМА в зависимости от локализации окклюзии сосуда, а также от состояния коллатерального кровоснабжения в клинической картине могут выявляться симптомы поражения среднего мозга, таламусов и полушарий головного мозга. В целом до 2/3 всех инфарктов в бассейне ЗМА являются корковыми, таламусы вовлекаются лишь в 20-30% случаев, а средний мозг менее чем в 10% случаев [7, 18, 19]. Соответственно наиболее частым вариантом ишемического инсульта в бассейне ЗМА является изолированный инфаркт полушарий большого мозга, в первую очередь затылочных долей, реже встречается сочетанное поражение таламусов и мозговых полушарий, в небольшом проценте случаев — изолированный инфаркт таламуса и, наконец, комбинация поражения среднего мозга, таламуса и/или гемисфер является наиболее редким вариантом [2].
Иногда наблюдается билатеральное поражение областей мозга, кровоснабжаемых из ЗМА. Это имеет место в первую очередь при синдроме верхушки базилярной артерии (top of the basilar syndrome), который представляет собой эмболическую окклюзию дистального отдела основной артерии и характеризуется угнетением сознания, зрительными нарушениями, глазодвигательными и поведенческими расстройствами, часто без моторной дисфункции [2].
По данным ряда авторов, наиболее частыми и характерными признаками инфарктов в бассейне ЗМА являются зрительные нарушения (до 95% случаев), гомонимная гемианопсия (66,7% случаев), центральный парез лицевого нерва (52% случаев), головная боль, преимущественно в затылочной области (50 случаев), нарушения чувствительности (40% случаев), афатические нарушения (38% случаев), гемипарез (18% случаев) и ниглект (10% случаев). Пациенты обычно имеют комбинацию симптомов [2, 7, 8, 11].
Гомонимная гемианопсия возникает с контрлатеральной стороны при инфарктах в зонах кровоснабжения полушарных ветвей ЗМА вследствие поражения стриарной коры, зрительной лучистости или латерального коленчатого тела. В отсутствие вовлеченности затылочного полюса макулярное зрение остается сохранным. Дефект полей зрения может ограничиваться лишь одним квадрантом. Верхнеквадрантная гемианопсия возникает при инфаркте стриарной коры ниже шпорной борозды или нижней части зрительной лучистости в височно-затылочной области. Нижнеквадрантная гемианопсия — следствие поражения стриарной коры выше шпорной борозды или верхней части зрительной лучистости в теменно-затылочной области. Окклюзия шпорной борозды также может быть ассоциирована с болями в ипсилатеральном глазу. Нарушения зрения могут иметь и более сложный характер, особенно при двустороннем поражении затылочных долей, включая зрительные галлюцинации, зрительную и цветовую агнозию, прозопагнозию (агнозия на знакомые лица), синдром отрицания слепоты (синдром Антона), дефицит зрительного внимания и оптико-моторную агнозию (синдром Балинта). Часто нарушения зрения сопровождаются афферентными нарушениями в виде парестезий, расстройств глубокой, болевой и температурной чувствительности. Последние указывают на вовлечение таламуса, теменной доли либо ствола мозга (вследствие окклюзии проксимальных отделов вертебробазилярного бассейна) [2, 8, 10, 20].
Нейропсихологические нарушения, ассоциированные с инфарктами в ЗМА, значительно варьируют и присутствуют более чем в 30% случаях. Инсульт в бассейне мозолистых ветвей левой ЗМА у правшей, затрагивающий затылочную долю и валик мозолистого тела, проявляется алексией без аграфии, иногда цветовой, предметной или фотографической аномией. Правополушарные инфаркты в бассейне ЗМА нередко вызывают контрлатеральный геминиглект. При обширных инфарктах с вовлечением медиальных отделов левой височной доли или двусторонних мезотемпоральных инфарктах развивается амнезия. Также при моно- или билатеральном мезотемпоральном инфаркте может развиться ажитированный делирий. Обширные инфаркты в бассейне левой задней височной артерии клинически могут проявляться аномией и/или сенсорной афазией. Таламические инфаркты в зонах кровоснабжения пенетрирующих ветвей ЗМА могут вызывать афазию (при заинтересованности левой подушки), акинетический мутизм, глобальную амнезию и синдром Дежерина – Русси (расстройства всех видов чувствительности, грубые дизестезии и/или таламическая боль и вазомоторные нарушения в контрлатеральной половине тела, сочетающиеся с обычно преходящим гемипарезом, хореоатетозом и/или баллизмом). Также инфаркты в бассейне ЗМА могут быть ассоциированы с дискалькулией, пространственной и временной дезориентацией. [6, 12, 21, 22].
Билатеральные таламические инфаркты нередко связаны с глубокой комой. Так, окклюзия артерии Першерона вызывает развитие двусторонних инфарктов в интраламинарных ядрах таламусов, что приводит к тяжелому нарушению сознания [2, 12].
Гемипарез при инфарктах в бассейне ЗМА встречается лишь у 1/5 больных, чаще является легким и преходящим и обычно ассоциирован с вовлечением в патологический процесс ножек мозга [23, 24]. Описаны случаи инфарктов в бассейне ЗМА, когда у больных выявлялся гемипарез без вовлечения ножек мозга. У этих пациентов имело место поражение дистальных отделов ЗМА, в первую очередь заинтересованность таламо-геникулятной, латеральной и медиальной задних хороидальных артерий [23, 25]. Предполагается, что гемипарез при инфарктах в бассейне задних хороидальных артерий может быть связан с поражением кортико-бульбарных и кортико-спинальных трактов, даже при отсутствии видимого поражения внутренней капсулы или среднего мозга по данным нейровизуализации [23]. Существуют мнения, что развитие гемипареза связано со сдавлением внутренней капсулы отечной тканью таламуса [12].
Инфаркты в бассейне ЗМА имитируют инфаркты в каротидном бассейне у 17,8% пациентов [24], особенно при сочетанном поражении поверхностных и глубоких ветвей ЗМА, которое наблюдается приблизительно в 38% случаев [7, 19, 26]. Дифференциальная диагностика бывает затруднена вследствие наличествующих афатических нарушений, ниглекта, сенсорного дефицита, а также обычно легкого и преходящего гемипареза, возникающего вследствие вовлечения пирамидных трактов. Кроме того, нарушения памяти и другие остро возникшие нейропсихологические нарушения могут существенно осложнять обследование таких пациентов [2, 18, 19].
Среди других состояний, нередко клинически имитирующих инфаркты в бассейне ЗМА, следует выделить некоторые инфекционные заболевания (в первую очередь токсоплазмоз), синдром задней обратимой лейкоэнцефалопатии, неопластические поражения, как первичные, так и метастатические, и таламические инфаркты, вызванные тромбозом глубоких мозговых вен [2, 27]. Зачастую при постановке диагноза определяющую роль играют методы нейровизуализации.
Основными требованиями к нейровизуализации в острейшем периоде ишемического инсульта являются быстрота проведения исследования и информативность полученных данных. Главными задачами, стоящими перед врачом при использовании этих методов, являются исключение неишемической причины симптомов у пациента, определение локализации и размеров ишемических очагов и наличия жизнеспособной мозговой ткани, определение состояния церебральных сосудов, выявление отека мозга и смещения срединных структур, а также наличия геморрагического пропитывания ишемических очагов. Эти данные должны помочь в скорейшем определении тактики лечения пациента — возможности проведения внутривенного или внутриартериального тромболизиса, механического удаления бляшки, операции по декомпрессии головного мозга [28, 29].
Компьютерная томография (КТ) обычно не выявляет ишемические изменения в паренхиме мозга в течение первых нескольких часов от начала инсульта, времени, наиболее важном для начала терапии, а иногда даже и в более поздние сроки заболевания. Особенно затруднительна визуализация задних отделов мозга вследствие артефактов, обусловленных костями черепа. Однако при инсультах в бассейне ЗМА, как и при инсультах в бассейне средней мозговой артерии, в ряде случаев КТ может показывать гиперинтенсивный сигнал от самой ЗМА, что является наиболее ранним признаком инсульта в ее бассейне и выявляется в 70% случаях в течение первых 90 минут от начала заболевания и в 15% случаях в сроки от 12 до 24 часов. Данный признак появляется за счет визуализации кальцифицированного эмбола или атеротромбоза in situ. На стандартной КТ плоскость срезов параллельна орбито-меатальной линии (линии, соединяющей наружный угол глаза с наружным слуховым проходом и далее идущей к первому шейному позвонку). Исходя из хода СМА ее просвет обычно визуализируется на одном срезе, что позволяет легко выявить гиперденсную СМА, особенно при наличии атрофических изменений мозга. Ход ЗМА более сложен. Обычно проксимальный ее сегмент восходит латерально вокруг ножек мозга и, достигая обводной цистерны, идет горизонтально внутрь к височной доле, в непосредственной близости от намета мозжечка. Циркулярная часть (Р1- и Р2-сегменты) заканчивается в квадригеминальной цистерне, где начинается кортикальная часть ЗМА. Только Р2-сегмент идет параллельно срезу внутри обводной цистерны и, соответственно, гиперденсность, при ее наличии, наиболее вероятно может быть обнаружена в этой области. Впоследствии КТ-признаки ишемических изменений проявляются в виде участков гипоинтенсивности в паренхиме головного мозга [2, 3, 30].
Магнитно-резонансная томография (МРТ) позволяет более точно определить наличие и характер ишемических изменений в головном мозге при инсульте. Получение диффузионно-взвешенных изображений (DWI) позволяет выявлять ранние ишемические изменения, часто в течение часа от начала симптомов, и определять локализацию и распространенность очагов более точно, чем КТ [2]. Совместное использование режимов DWI, ADC и FLAIR позволяет дифференцировать острые, подострые и хронические ишемические изменения в паренхиме мозга, а также отличать цитотоксический отек мозга, наблюдающийся при ишемическом инсульте, от вазогенного отека при синдроме задней обратимой лейкоэнцефалопатии и гипертонической энцефалопатии [2, 27, 31, 32].
В неинвазивной диагностике стено-окклюзивного поражения крупных экстра- и интракраниальных артерий немалую роль играет КТ ангиография (КТА). Эта методика позволяет выявить степень стеноза, морфологию бляшки, а также наличие артериальной диссекции как при поражениях сосудов вертебробазилярного, так и каротидного бассейнов. Кроме того, оцениваются анатомические особенности коллатералей и вариантов циркуляции ЗМА [2, 33, 34]. Дополнительную информацию о сосудистой анатомии можно получить с помощью МР ангиографии с контрастированием, которая в сочетании с КТА позволяет оперировать данными, которые раньше можно было получить только с помощью классической ангиографии. Кроме того, эти методы имеют значение в оценке эффективности тромболитической терапии в случае артериальной реканализации [2].
В настоящее время тромболитическая терапия ишемического инсульта может применяться при поражении артерий как каротидного, так и вертебробазилярного бассейнов. Тем не менее все существующие на сегодняшний день руководства по проведению тромболизиса ориентированы в первую очередь на сосудистую катастрофу в каротидном бассейне, в первую очередь средней мозговой артерии; это связано прежде всего с наличием у таких пациентов явного неврологического дефицита в виде грубых парезов и нарушений чувствительности. Типичный функциональный дефицит у больного с инфарктом в бассейне ЗМА в острейшем периоде не всегда расценивается врачом как инвалидизирующий. Оценка неврологического дефицита по шкале инсульта национального института здоровья (NIHSS), являющаяся одним из критериев отбора пациентов для тромболитической терапии, обычно не в состоянии в полной мере отразить тяжесть состояния больного с инфарктом в вертебробазилярном бассейне [7]. По отношению к изолированному дефекту зрительных полей при остром инфаркте в бассейне ЗМА вообще не существует каких-либо рекомендаций [2]. Поэтому тромболитическая терапия у больных с инфарктами в бассейне ЗМА используется недостаточно широко. Тем не менее, учитывая, что гемипарез в ряде случаев является значительной клинической составляющей инфарктов в бассейне ЗМА, таким пациентам при отсутствии противопоказаний обоснованно проводится системный и/или внутриартериальный тромболизис [35].
При сравнении профилей эффективности и безопасности внутривенного тромболизиса, проводимого в течение первых трех часов от появления симптомов, у пациентов с инфарктами в каротидном бассейне и инфарктами в бассейне ЗМА значимой разницы в безопасности и исходе лечения обнаружено не было [7]. При этом, по данным ряда авторов, при проведении внутривенной тромболитической терапии при ишемических поражениях в вертебробазилярном бассейне, и в частности ЗМА, возможно расширение терапевтического окна до 6,5-7 часов и даже больше по сравнению с 4,5 часами при инфарктах в каротидном бассейне [36, 37].
Проведение внутриартериального тромболизиса при окклюзии средней мозговой артерии рекомендуется в течение не позднее 6 часов от начала симптомов, при окклюзии основной артерии — не позднее 12 часов [28]. При этом на сегодняшний день не существует четких рекомендаций по временным пределам при проведении внутриартериального тромболизиса у пациентов с поражением ЗМА [15]. N. Meier и соавт. (2011) описали 9 случаев внутриартериального тромболизиса у пациентов с окклюзией ЗМА в течение первых 6 часов от начала заболевания. Через 3 месяца после лечения функциональная независимость (по модифицированной шкале Ренкина 0-2 балла) была выявлена у 67% пациентов, что соотносится с аналогичными данными по каротидному бассейну [15].
Установленный на ранних сроках диагноз ишемического инсульта в бассейне ЗМА позволяет врачу своевременно определить тактику лечения пациента и рассмотреть при отсутствии противопоказаний возможность проведения тромболитической терапии, что, несомненно, делает прогноз для больного более благоприятным.
ЛИТЕРАТУРА
1. Brandt T., Steinke W., Thie A., Pessin M.S., Caplan L.R. Posterior cerebral artery territory infarcts: clinical features, infarct topography, causes and outcome. Multicenter results and a review of the literature // Cerebrovasc. Dis. — 2000. — Vol. 10. — P. 170–182.
2. Finelli P. Neuroimaging in acute Posterior Cerebral Artery Infarction // The Neurologist. — 2008. — Vol. 14. — P. 170-180.
3. Krings T., Noelchen D., Mull M. et al. The hyperdense posterior cerebral artery sign // Stroke. — 2006. — Vol. 37. — P. 399-403.
4. Hill M.D. Posterior cerebral artery stroke // e-medicine, 2005.
5. Хасанов И.А. Особенности инфарктов в бассейне задних мозговых артерий // Неврологический вестник. — 2012. — Т. XLIV, вып. 3. — С. 69-74.
6. Caplan L. Posterior Circulation Ischemia: Then, Now, and Tomorrow: The Thomas Willis Lecture-2000 // Stroke. — 2000. — Vol. 31. — P. 2011-2023.
7. Breuer L., Huttner H.B., Jentsch K. et al. Intravenous Thrombolysis in Posterior Cerebral Artery Infarctions // Cerebrovasc Dis. — 2011. — Vol. 31. — P. 448-454.
8. Caplan L., Bogousslavsky J. Posterior cerebral artery syndromes // Cerebrovascular Disease: Pathology, Diagnosis and Management. — 1998. — P. 1028.
9. Caplan L., Estol C., Massaro A. Dissection of the posterior cerebral arteries // Arch Neurol. — 2005. — Vol. 62. — P. 1138-1143.
10. Бразис П. Топическая диагностика в клинической неврологии / П. Бразис, Д. Мэсдью, Х. Биллер — М.: МЕДпресс-информ, 2009. — 736 с.
11. Caplan L. Posterior Circulation disease: Clinical Findings, Diagnosis and Management / Boston, MA: Butterworth-Heinemann, 1996. — 533 p.
12. Бер М. Топический диагноз в неврологии по Петеру Дуусу / М. Бер, М. Фрот-шер. — М.: Практическая медицина, 2009. — 468 с.
13. Tatu L., Moulin T., Bogousslavsky J. et al. Arterial territories of the human brain // Neurology. — 1998. — Vol. 50 — P. 1699-1708.
14. de Monye C., Dippel D.W., Siepman T.A. et al. Is a fetal origin of the posterior cerebral artery a risk factor for TIA or ischemic stroke? A study with 16-multidetector-row CT angiography // J. Neurol. — 2008. — Vol. 255 — P. 239-245.
15. Meier N., Fischer U., Schroth G. Outcome after thrombolysis for acute isolated posterior cerebral artery occlusion // Cerebrovasc. Dis. — 2011. — Vol. 328. — P. 79-88.
16. Phan T., Fong A., Donnan G. et al. Digital map of posterior cerebral artery infarcts associated with posterior cerebral artery trunk and branch occlusion // Stroke. — 2007. — Vol. 38. — P.1805-1811.
17. Chaves C.J. Posterior cerebral artery. Stroke syndromes. 2nd edition / Chaves C.J., Caplan L.R. Cambridge, New York: Cambridge University Press. — 2001. — 747 p.
18. Cals N., Devuyst G., Afsar N. et al. Pure superficial posterior cerebral artery territory infarction in the Lausanne Stroke Registry // J. Neurol. — 2002. — Vol. 249. — P. 855-861.
19. Kumral E., Bayulkem G., Atac C., Alper Y. Spectrum of superficial posterior cerebral artery territory infarcts // Eur. J. Neurol. — 2004. — Vol. 11. — P. 237-246.
20. Ng Y.S., Stein J., Salles S.S. et al. Clinical characteristics and rehabilitation outcomes of patients with posterior cerebral artery stroke // Arch. Phys. Med. Rahabil. — 2005. — Vol. 86. — P. 2138-43.
21. Brandt T., Thie A., Caplan L. et al. Infarkte in Versorgungsgebiet der A. cerebri Posterior // Nervenarzt. — 1995. — Vol. 66. — P. 267-274.
22. Savitz S.I., Caplan L.R. Vertebrobasilar disease // N. Engl. J. Med. — 2005. — Vol. 352. — P. 2618-26.
23. Finelli P. Magnetic Resonance Correlate of Hemiparesis in Posterior Cerebral Artery Infarction // Journal of Stroke and Cerebrovascular Disease. — 2008. — Vol. 17. — P. 378-381.
24. Maulaz A.B., Bezerra D.C., Bogousslavsky J. Posterior cerebral artery infarction from middle cerebral artery infarction // Arch. Neurol. — 2005. — Vol. 62. — P. 938-941.
25. Neau J.-P., Bogousslavsky J. The syndrome of posterior choroidal artery territory infarction // Ann. Neurol. — 1996. — Vol. 39. — P. 779-788.
26. Lee E., Kang D.W., Kwon S.U., Kim J.S. Posterior cerebral artery infarction: diffusion-weighted MRI analysis of 205 patients // Cerebrovasc. Dis. — 2009. — Vol. 28. — P. 298-305.
27. Богданов Э.И., Хасанов И.А., Мамедов Х.И. и др. Cиндром задней обратимой лейкоэнцефалопатии у больных с преэклампсией и эклампсией // Неврологиче-ский журнал. — 2011. — № 5. — С. 35-40.
28. Adams H., Del Zoppo G., Alberts M. et al. Guidelines for the early management of adults with ischemic stroke // Stroke. — 2007. — Vol. 38. — P. 1655-1711.
29. Wahlgren N., Ahmed N., Davalos A. et al. Thrombolysis with alteplase for acute ischemic stroke & the Safe implementation of thrombolysis in stroke — monitoring study (SITS-MOST): an observational study // Lancet. — 2007. — Vol. 369. — P. 275-282.
30. Berge E., Nakstad P.H., Sandset P.M. Large middle cerebral artery infarctions and the hyperdense middle cerebral artery sign in patients with atrial fibrillation // Acta Radiol. — 2001. — Vol. 42. — P. 261-268.
31. Covarrubias D.J., Leutmer P.H., Caumpeau N.G. Posterior reversible leukoencephalopathy syndrome: prognostic utility of quantitative diffusion-weighted MR image // AJNR Am J. Neuroradiol. — 2002. — Vol. 23, N 6. — P. 1038-1048.
32. Garg R. Posterior leukoencephalopathy syndrome // Postgrad. Med. J. — 2001. — Vol. 77, N 903. — P. 24-28.
33. Choi C., Lee D., Lee J. et al. Detection of intracranial atherosclerotic steno-occlusive disease with 3D time-of-flight magnetic resonance angiography with sensitivity encoding at 3T // AJNR Am J. Neuroradiol. — 2007. — Vol. 28. — P. 439-446.
34. Lev M., Farkas J., Rodrigues V. et al. CT angiography in the rapid triage of patients with hyperacute stroke to intraarterial thrombolysis: accuracy in the detection of large vessel thrombus // J Comput Assist Tomogr. — 2001. — Vol. 25. — P. 520-528.
35. Ntaios G., Spengos K., Vemmou A. M. et al. Long-term outcome in posterior cerebral artery stroke // European Journal of Neurology. — 2011. — P. 156-162.
36. Forster A., Gass A., Kern R. et al. MR Imaging-Guided Intravenous Thrombolysis in Posterior Cerebral Artery Stroke // AJNR Am J. Neuroradiol. — 2011. — Vol. 32. — P. 419-421.
37. Montavont A., Nighoghossian N., Derex. L et al. Intravenous r-TPA in vertebrobasilar acute infarcts // Neurology. — 2004. — Vol. 62. — P. 1854-1856.
Сокращения:
- A1: Horizontal segment of ACA
- A2: Vertical segment of ACA
- ACA: Anterior cerebral artery
- Acom: Anterior communicating artery
- AICA: Anterior inferior cerebellar artery
- AVM: Arteriovenous malformation
- BA: Basilar artery
- CBF: Cerebral blood flow
- CBV: Cerebral blood volume
- CoW: Circle of Willis
- DSA: Digital subtraction angiograph
- ECA: External carotid artery
- ICA: Internal carotid artery
- IoA: Incidence of aneurysms
- M1: Sphenoidal segment of MCA
- MCA: Middle cerebral artery
- MMA: Middle meningeal artery
- MTT: Mean transit time
- PCA: Posterior cerebral artery
- Pcom: Posterior communicating artery
- PDOA: Persistent dorsal ophthalmic artery
- PICA: Posterior inferior cerebellar artery
- PPHA: Persistent primitive hypoglossal artery
- PPOA: Persistent primitive olfactory artery
- PTA: Persistent trigeminal artery
- SCA: Superior cerebellar artery
- sVAD: Spontaneous vertebral artery dissection