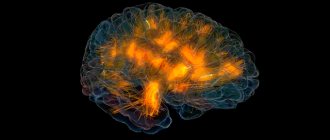
Анатомически реалистичная 3D модель мозга, изображающая локализованную активность в режиме реального времени Каждый цвет представляет собой источник биоэлектрической активности и коннектичность в различной полосе частот (тета, альфа, бета, гамма); золотые линии отображают анатомические волоконные тракты белого вещества. Предполагаемая передача информации между областями мозга визуализируется в виде импульсов света, проходящих по волоконным трактам, соединяющим эти области
Биоэлектрическая активность мозга
(БЭА) — это электрическая активность нейронов, связанная с их возбуждением, т.е. со сдвигом мембранного потенциала.
В основе биоэлектрической активности головного мозга лежат трансмембранные ионные токи, которые порождают явления потенциала действия и импульсной активности нейронов. Таким образом осуществляется нейронная передача сигналов в виде коротких электрических импульсов, каждый из которых представляет собой основную информационную единицу мозга (квант информации).12
Механизм
Биоэлектрическая активность мозга объясняется физиологией нервной ткани. Каждый нейрон покрыт мембраной. Встроенные в мембрану белковые насосы создают разницу электрических потенциалов внутри и снаружи клетки за счет нагнетания заряженных ионов натрия, калия, хлора и др.
Возбуждение нейрона связано с открытием ионных каналов и прохождением ионов через мембрану, что приводит к изменению напряжения, которое и регистрируется различными методами в виде биоэлектрической активности.
Отдельно взятый нейрон находится в непрерывном процессе биоэлектрогенеза. Возбуждение нервной клетки может происходить при ее раздражении, т.е. при поступлении импульса от других нейронов, а в некоторых случаях — спонтанно. Других источников биоэлектрического поля, кроме нейронов, в головном мозге нет.
➥ Основная статья: Биоэлектрические потенциалы
Вертикальная интеграция пространственных масштабов от молекулярного уровня (нанометровая шкала) до всего мозга (сантиметровая шкала)
Уровни организации головного мозга
Условно выделяют три уровня организации головного мозга, на которых можно исследовать разные формы биоэлектрической активности: микроуровень (активность одного нейрона), мезоуровень (активность локальной группы нейронов) и макроуровень (активность разных областей мозга).
➥ Более подробно: Функциональные системы, структура и организация мозга
Микроуровень (англ. microscale) – самый низший уровень организации головного мозга, отражающий активность одиночных нейронов за счет синаптических и молекулярных механизмов.
Мезоуровень (англ. mesoscale) – уровень, находящийся между микро- и макроуровнем, на котором происходит взаимодействия между крупными нейронными ансамблями.
Макроуровень (англ. macroscale) – используется для определения областей мозга и крупномасштабных связей между ними.
Методы регистрации биоэлектрической активности головного мозга
Регистрация БЭА на разных уровнях организации
(А) Скальповый электрод (зеленый), многоконтактный макроэлектрод (красный) и микроэлектрод (синий) (разрешение: объем
Изучение биоэлектрической активности проводится при помощи электрофизиологических методов, основанных на регистрации колебания разности потенциалов между двумя точками среды, например между двумя электродами, расположенных на коже головы.
Электроэнцефалография (ЭЭГ, англ. electroencephalography, EEG) – неинвазивный метод, позволяющий регистрировать биоэлектрическую активность мозга с поверхности скальпа черепа.
➥ Основная статья: Электроэнцефалография
Магнитоэнцефалография (МЭГ, англ. magnetoencephalography, MEG ) – метод, основанный на регистрации магнитного поля, которое формируется за счет электрической активности нейронов.
Электрокортикография (ЭКоГ, англ. electrocorticography
, ECoG) – инвазивный метод регистрации биоэлектрической активности при помощи электродов, расположенных на поверхности коры головного мозга.
➥ Основная статья: Электрокортикография
Микроэлектродные методы – совокупность методов, использующих микроэлектроды для внутри- либо внеклеточной регистрации биопотенциалов. К ним можно отнести регистрацию активности одиночного нейрона, мультиюнитной активности, потенциала локального поля (LFP), а также patch clamp и dynamic clamp методы.
➥
Виды биоэлектрической активности
Биоэлектрическая активность в зависимости от масштаба (от одного нейрона до скоординированной деятельности крупных нейронных ансамблей) проявляется в разных формах.
➥ Основная статья: Функциональные системы, структура и организация мозга
| Микроуровень мозга | Мезоуровень мозга | Макроуровень мозга | |
| Регулярная биоэлектрическая активность | Пачки спайков (англ. spike trains); Регулярный паттерн подпороговых колебаний мембранного потенциала (англ. regular pattern of subthreshold membrane potential oscillations, SMPO) | Осцилляции нейронных популяций | Мозговые ритмы или волны, порождаемые самыми крупными нейронными ансамблями |
| Нерегулярная биоэлектрическая активность | Тепловой шум (англ. thermal noise); Канальный шум (англ. channel noise); Берстовый шум (англ. burst noise); Синаптический шум (англ. synaptic noise); Cпайк (англ. spike) | 1/f шум | Дезорганизованная ЭЭГ 1/f шум |
| Транзиентная биоэлектрическая активность | Нерегулярные подпороговые колебания мембранного потенциала (англ. irregular subthreshold membrane potential oscillations); Веретенообразные подпороговые колебания мембранного потенциала (англ. spindle-like subthreshold membrane potential oscillations) | Неэпилептиформная транзиентная активность (SWR); Эпилептиформная транзиентная активность (межиктальная эпилептиформная активность, IED) | Неэпилептиформная (англ. nonepileptiform) транзиентная активность; Эпилептиформная транзиентная активность (англ. epileptiform discharges); Потенциал, связанный с событием (англ. event-related potential, ERP) |
Ритмическая активность
Регулярные подпороговые колебания мембранного потенциала
➥ Основная статья: Ритмическая активность головного мозга
Ритмическая или регулярная биоэлектрическая активность – это повторяющиеся частотные паттерны в центральной нервной системе. Иными словами, это однотипные или самоподобные колебательные события, которые повторяются с одинаковыми интервалами.
Нейронные колебания, порождаемые биоэлектрической активностью головного мозга, наблюдаются во всей центральной нервной системе на всех уровнях ее организации и включают в себя пачки спайков (spike trains/bursting), регулярный паттерн подпороговых колебаний мембранного потенциала, высокоамплитудные колебания потенциала локального поля и крупномасштабные колебания (мозговые волны).
ЭЭГ является одним из самых доступных электрофизиологических методов регистрации ритмической активности. Так как электрическое поле, создаваемое одиночным нейроном или совокупностью близкорасположенных нейронов, настолько мало, что не может быть зарегистрировано с поверхности головы, ЭЭГ – это метод, который отражает суммарную активность большого пула нейронов, величина которого достаточна для формирования разницы потенциала на поверхности скальпа. Следует подчеркнуть, что электрическая активность должна быть настолько большой мощности, насколько это потребуется для прохождения сигнала через кости черепа и кожные покровы, обладающие заметным сопротивлением электрическому току. Опять-таки, исходя из приведенных необходимых и достаточных условий: активность, регистрируемая со скальпа, обусловлена относительно мощной суммарной активностью нейронального пула, — логично вытекает положение о том, что суммарная ЭЭГ в первую очередь обусловлена активностью нейронов коры как самых близко расположенных к поверхности кожи головы — месту регистрации.
Ритмические процессы играют ключевую роль в функциональной активности головного мозга.
Неритмическая активность
К неритмической или нерегулярной активности относятся хаотические или стохастические изменения в биоэлектрической активности мозга.
На микроуровне
нерегулярную мозговую активность по механизмами можно подразделить на молекулярный, синаптический и 1/f шум,3 и спайковую активность.
Спайки
(англ. spikes) также могут быть крайне нерегулярными как во время постоянной, спонтанной активности, так и при вызванной активности при высокой частоте испускания импульсов. Существует неопределенность относительно источника этой нерегулярности, начиная от собственных источников шума в нейронах до коллективных эффектов в крупномасштабных кортикальных сетях. Корковые интернейроны показывают очень нерегулярное время спайка в ответ на введение постоянного тока in vitro. Это резко контрастирует с кортикальными пирамидными клетками, которые проявляют нерегулярную биоэлектрическую активность in vivo, но регулярную in vitro. На записях и вычислительных моделях in vitro показано, что это связано с быстрой кинетикой активации межнейрональных токов ионов К. При этом аритмичный спайк может способствовать нерегулярной активности всей кортикальной сети.45
Сверху показана нормальная ЭЭГ, снизу ЭЭГ пациента с гипсаритмией
На более высших уровнях организации неритмическая активность может проявляться в виде дезорганизации биоэлектрической активности мозга. Виды дезорганизации:
- Дезорганизация биоэлектрической активности с преобладанием альфа-активности. На ЭЭГ главной является альфа-активность, но она недостаточно регулярная или совсем нерегулярная по частоте. Такой более или менее дезорганизованный альфа-ритм имеет недостаточно высокую амплитуду и может даже доминировать во всех областях мозга. Бета-активность также нередко усилена, часто представлена колебаниями низкой частоты, увеличенной амплитуды. Наряду с этим в ЭЭГ могут присутствовать тета- и дельта-волны с достаточно высокой амплитудой.
- Дезорганизация биоэлектрической активности с преобладанием тета- и дельта-активности. Структуру данного типа характеризует слабая представленность альфа-активности. Колебания биопотенциалов альфа-, бета-, тета- и дельта-диапазонов регистрируются без какой-либо четкой последовательности. Такой бездоминантный тип кривой может иметь как средний, так и высокий амплитудный уровень.
- Гипсаритмия – проявляется как дезорганизация фоновой биоэлектрической активности мозга с нерегулярными медленными волнами высокого напряжения, во время сна могут накладываться мультифокальные пики и полиспайки.6
Пароксизмальная активность
➥ Основная статья: Пароксизмальная активность
Пароксизмы или транзиенты – это короткие интервалы (от 10 до 1000 мс),7 в течение которых сигнал резко изменяется и принимает нетипичный или относительно непредсказуемый характер.
(A) Веретенообразные подпороговые колебания мембранного потенциала; (B) Нерегулярные подпороговые колебания мембранного потенциала
Транзиентная активность отражает функциональную интеграцию структур мозга и является фундаментальным элементом нервного взаимодействия. Транзиенты, порождаемые совместно разными нейронными популяциями говорят о связи этих популяций. Эта связь может быть синхронной или асинхронной.8
Примерами такой активности могут служить спонтанные синхронные синаптические транзиенты, создаваемые токами ионов Са²+между соседними нейронами коры головного мозга.9 Спайки и острые волны, составляющие судорожную или интериктальную активность у лиц с эпилепсией или предрасположенностью к ней, либо транзиенты в виде вертексов и веретена сна, являющиеся нормой. Также с использованием внутриклеточной записи in vivo можно зарегистрировать нерегулярные подпороговые колебания мембранного потенциала и веретенообразные подпороговые колебания мембранного потенциала.
Потенциал, связанный с событием
➥ Основная статья:ERP
Потенциалы, связанные с событием
(ПСС, англ.
event-related potential
— ERP) представляют собой записанные с кожи головы колебания электрического напряжения, генерируемые в структурах мозга в ответ на определенные события или стимулы. Также относятся к транзиентной мозговой активности. Это изменения ЭЭГ, привязанные ко времени сенсорных, моторных или когнитивных событий, которые обеспечивают безопасный и неинвазивный подход к изучению психофизиологических коррелятов психических процессов. Считается, что они отражают суммарную биоэлектрическую активность постсинаптических потенциалов, возникающих, когда большое количество одинаково ориентированных кортикальных нейронов (порядка тысяч или миллионов) синхронно срабатывают при обработке информации. ERP измеряют при помощи электроэнцефалографии (ЭЭГ) и магнитоэнцефалографии (MEG) . Магнитоэнцефалографическим (MEG) эквивалентом ERP является ERF или поле, связанное с событием (
event-related field
). 10 К подтипам ERP относятся вызванные и индуцированные потенциалы.
Вызванные потенциалы
➥ Основная статья: Вызванные потенциалы
Когнитивные вызванные потенциалы (ВП, EP)
представляют собой связанную с событием активность, которая возникает в виде электрического ответа от мозга на различные типы сенсорной стимуляции нервных тканей; чаще всего используется слуховая и зрительная стимуляция. Регистрация таких электрических потенциалов представляет собой неинвазивный объективный тест, который предоставляет информацию, например, о нарушениях сенсорных путей, локализации поражений, влияющих на сенсорные пути, и расстройств, связанных с языком и речью. Вызванные потенциалы записываются с кожи головы с использованием ЭЭГ. Потенциалы, как правило, проявляют себя как переходная форма волны, морфология которой зависит от типа и силы стимула и расположения электродов на коже головы. Психическое состояние субъекта, например, внимание, бодрствование и ожидание, также влияет на морфологию формы волны.
Индуцированная активность
Наряду с вызванной активностью, нейронная активность, связанная со стимулом, может приводить к индуцированной активности
. Индуцированный ответ связан с процессами в головном мозге, которые не связаны напрямую со стимулом, а вызваны косвенно нелинейным взаимодействия нейронов после стимула. Функционально компонент индуцированного ответа, вероятно, представляет собой процессы обратной кортико-таламической (top-down) связи, связывающие внешние стимулы с внутренней корковой моделью среды, т. е. объединяющую управляемую извне сенсорную информацию с внутренней мозговой активностью.1112 Индуцированный ответ может быть связан с когнитивными функциями мозга, такими как восприятие, внимание и обучение, которые можно рассматривать как процессы более высокого порядка. Хорошо изученным видом индуцированной активности является изменение амплитуды колебательной активности. Например, гамма-активность часто возрастает во время повышенной умственной активности, как во время представления объекта. Поскольку индуцированные ответы не связаны с фазой, следовательно, будут исключаться при усреднении, то они могут быть получены только с помощью частотно-временного анализа. Индуцированная активность обычно отражает активность многочисленных нейронов: считается, что амплитудные изменения в колебательной активности возникают в результате синхронизации нейронной активности, например, синхронизации времени спайков или флуктуаций мембранного потенциала отдельных нейронов.
Альфа-Ритм
О.Н. Кирилловских, В.С. Мякотных, Е.В. Сорокова, К.В. Мякотных, Т.А. Боровкова Уральская государственная медицинская академия, 620905 Екатеринбург, ул. Соболева, 25
Обследовано 89 пациентов пожилого и старческого возраста с различными формами эпилепсии. Определены общие характерные черты биоэлектрической активности головного мозга пожилых пациентов, страдающих эпилепсией, выявлены особенности электроэнцефалографической картины в зависимости от формы заболевания, возраста его дебюта, выраженности цереброваскулярной патологии. Показано, что контроль ЭЭГ в динамике помогает в подборе адекватной противоэпилептической терапии и позволяет избежать утяжеления когнитивного дефицита.
Ключевые слова: эпилепсия, пожилой и старческий возраст, ЭЭГ, цереброваскулярная патология, когнитивный дефицит.
Актуальность проблемы.
В последние годы все большее внимание приобретает проблема эпилепсии пожилого и старческого возраста, дифференциального диагноза эпилептических припадков и неэпилептических пароксизмальных состояний иного генеза, а также возможностей лечения эпилепсии у пожилых, страдающих множественной патологией [1,3,8]. Считается, что эпилепсия является заболеванием, развивающимся на основе генетически детерминированной предрасположенности головного мозга в сочетании с экзогенными факторами, определяющими ее актуализацию в клинической форме [4]. Доказано, что этой генетически детерминированной фенотипической предосновой развития эпилепсии у детей и подростков является высокоамплитудная синхронизация работы нейронов во всех частотных диапазонах. Но в процессе естественной возрастной трансформации биоэлектрической активности головного мозга происходит замедление основных корковых ритмов, прежде всего альфа-ритма, который выступает при старении в роли биологических часов. Кроме того, наблюдается снижение общего амплитудного уровня ЭЭГ и повышение доли бета-активности вследствие усиления неспецифических активирующих влияний срединно-стволовых структур [4,7]. Также с возрастом увеличивается количество медленных волн (МВ), преимущественно тета-диапазона, возникающих как регионально, преимущественно в лобно-височных областях, так и в виде генерализованного замедления основных корковых ритмов. Тем не менее, несмотря на происходящие возрастные изменения биоэлектрической активности головного мозга и укоренившееся мнение о том, что эпилепсия является заболеванием преимущественно представителей молодого возраста, заболеваемость эпилепсией в старших возрастных группах продолжает расти [7]. Поэтому нам показалось интересным определить особенности биоэлектрической активности как у пожилых пациентов с длительным анамнезом эпилепсии, так и у пациентов с дебютом эпилепсии в возрасте старше 60 лет.
Цель исследования
С помощью электроэнцефалографических (ЭЭГ) исследований определить особенности биоэлектрической активности головного мозга при эпилепсии у лиц пожилого и старческого возраста.
Материалы и методы.
В течение 5 лет, с 2006 по 2010 гг. проводилось проспективное исследование клинико-нейрофизиологических особенностей эпилепсии и возможностей ее лечения у 89 пациентов в возрасте 63-96 лет (m=75,5±6,87 лет). Диагноз эпилепсии во всех случаях был установлен на основании наблюдения не менее двух неспровоцированных эпилептических приступов. Критерием исключения являлся эпилептический синдром вследствие опухоли мозга, болезнь Альцгеймера. Группа контроля была представлена 30 пациентами в возрасте 65-85 лет (m=75±5,66 лет), не страдающих эпилепсией, но имеющих сходный спектр сопутствующей патологии, в основном сердечно-сосудистой. В зависимости от времени дебюта эпилепсии все больные основной группы наблюдений были подразделены на две сравниваемые группы: 1-я – пациенты с дебютом эпилепсии в пожилом и старческом возрасте, в основном постинсультного генеза (n=34); 2-я – пациенты с длительным анамнезом эпилепсии при ее дебюте до 60-летнего возраста (n=55). Отдельно из представителей 2-й группы была выделена подгруппа 2А – 18 пациентов старческого возраста, старше 80 лет, перенесших в годы Великой Отечественной войны тяжелую черепно-мозговую травму (ЧМТ) и страдающих посттравматической эпилепсией. Всем пациентам в исследуемых группах проводилось ЭЭГ исследование с периодичностью 4-6 за год. Применяли регистрацию ЭЭГ с визуальной оценкой и вычислением индексов для стандартных частотных диапазонов на компьютерном электроэнцефалографе «Энцефалан-131-01» (Россия, Таганрог). В процессе подбора оптимальной комбинации противоэпилептических препаратов записывали ЭЭГ в динамике через 5, 14 и 30 дней после смены схемы лечения. В случае отсутствия на рутинной ЭЭГ эпилептиформной активности или при сомнительных результатах больным проводили ЭЭГ с депривацией сна, дневной амбулаторный ЭЭГ – мониторинг, ЭЭГ- мониторинг сна на аппарате «Nicolet-one». При проведении ЭЭГ с частичной депривацией сна, лучше переносимой пожилыми, больного будили накануне в 4 часа утра и в 9 часов проводили запись ЭЭГ. Запись проводилась при биполярном и монополярном монтаже электродов с использованием 18-21 стандартного отведения по схеме 10-20, в качестве функциональных проб использовались: открывание и закрывание глаз, ритмичная фотостимуляция с частотой 3, 5, 10 и 15 Гц, блок с непрерывным возрастанием частоты фотостимуляции с 3 до 27 Гц и гипервентиляция в течение 3 минут. Оценка результатов ЭЭГ проводилась с использованием современных методов интерпретации – компьютерной обработки с вычислением индекса и амплитуды основных ритмов ЭЭГ, однако основным методов оценки ЭЭГ являлся визуальный. Первичная оценка варианта ЭЭГ проводилась с использованием классификации Е.А. Жирмунской [2], более детальное описание патологических изменений – с использованием Классификации Американской Ассоциации нейрофизиологов [6].
Результаты и их обсуждение.
При исследовании ЭЭГ пациентов обеих выделенных групп выявлены некоторые общие черты, которые отличают биоэлектрическую активность головного мозга пациентов больных эпилепсией пожилого и старческого возраста от таковой у лиц аналогичного возраста, но не страдающих эпилептическими припадками (табл. 1). Это, прежде всего, более высокий амплитудный уровень основных ритмов ЭЭГ: если в группе сравнения амплитуда ЭЭГ, как правило, не превышала 60 мкВ, то у больных эпилепсией средний амплитудный уровень оказался вдвое выше, составив 120-150 мкВ. Достоверных различий между представителями основной группы и группы контроля не выявлено только по частоте встречаемости межполушарной асимметрии, вспышек бета- активности и диффузной эпилептиформной активности. По остальным параметрам выявленные различия отчетливы и достоверны. Характерна также заметная тенденция к синхронизации основной биоэлектрической активности за счет дисфункции срединно-стволовых структур головного мозга. Tак, при исследовании рутинной ЭЭГ у 38 (42,7%) пациентов наблюдался высокоамплитудный для данного возраста вариант ЭЭГ с тенденцией к синхронизации основных корковых ритмов, в отличие от 2 (6,7%) пациентов контрольной группы (Р
Таблица 1. Сравнительная характеристика основных вариантов ЭЭГ и видов патологической активности.
| Основные характеристики ЭЭГ | Основная группа (n=89) | Группа сравнения (n=30) | |
| Гиперсинхронный высокоамплитудный вариант (sharp-looking) | 38 (42,7%) | 2 (6,7%) | |
| Десинхронный низкоамплитудный вариант | 0 | 14 (46,7%) | |
| Дезорганизованный гиперсинхронный вариант | 50 (56,2%) | 2 (6,7%) | |
| Дезорганизованный десинхронный вариант | 1 (1,1%) | 12 (40%) | |
| Межполушарная асимметрия | 28 (31,5%) | 4 (13,3%) | |
| Увеличение индекса бета-активности > 40% | 7 (7,9%) | 18 (60%) | |
| Вспышки бета-активности (excessivе fast) | 15 (16,9%) | 3 (10%) | |
| Замедление основной фоновой активности | I степени | 24 (27%) | 4 (13,3%) |
| II степени | 8 (9%) | 0 | |
| III степени | 3 (3,4%) | 0 | |
| Периодическое региональное замедление | в лобных отведениях | 23 (25,8%) | 5 (16,7%) |
| в височных отведениях | 41 (46,1%) | 0 | |
| Фокальная эпилептиформная активность | в состоянии бодрствования | 36 (40,4%) | 0 |
| в состоянии сна | 14 (15,7%) | 0 | |
| Диффузная эпилептиформная активность | 5 (5,6%) | 0 | |
| Индекс медленноволновой активности (%) | 39,5±6,5 | 29,9±3,1 | |
На фоне дезорганизации фоновой биоэлектрической активности у 50 (56,2%) пациентов основной группы также наблюдалась гиперсинхронизация основных корковых ритмов; в группе контроля подобного рода наблюдений оказалось всего 2 (6,7%); Р
Среди больных эпилепсией усредненные показатели индекса медленноволновой активности достигали 39,5±6,5%, в контрольной группе – 29,9±3,1% (Р
В группе больных эпилепсией в 24 (27%) наблюдениях отмечено замедление основной активности I степени (7 Гц и ниже), в контрольной группе – только в 4 (13,3%) случаях. Замедление основной активности II cтепени (6 Гц и ниже) также значительно чаще (Р=0,009) отмечено среди лиц, страдавших эпилепсией (табл. 1). Это согласуется с тем, что замедление основной активности по сравнению с возрастной нормой всегда является признаком серьезной патологии головного мозга [6]. Конечно, у пожилых больных замедление основной активности I степени может считаться условно-нормальным феноменом, так как после 60 лет происходит постепенное физиологическое уменьшение частоты альфа-ритма приблизительно на 1 Гц за каждые 10 лет [2,3,4,5]. Замедление же основной активности II-III cтепени у пожилых пациентов является маркером грубой корковой атрофии мозга [6].
В группе больных эпилепсией практически все виды пароксизмальной активности носили эпилептиформный характер; у 64 (71,9%) больных высокоамплитудные заостренные волны тета- и дельта-диапазона чаще локализовались в лобных и височных областях и являлись самым частым видом условно-эпилептиформной активности. Комплексы «острая-медленная волна», «спайк-медленная волна», классифицируемые как истинная эпилептиформная активность, встречались реже – у 36 (40,4%) больных и были обнаружены в состоянии бодрствования. У 14 (15,7%) пациентов эпилептиформная активность выявлена лишь во сне при проведении им ЭЭГ мониторинга.
Таким образом, на ЭЭГ пожилых больных эпилепсией помимо собственно эпилептиформной активности чаще встречаются следующие феномены: а) гиперсинхронная заостренная по форме альфа-активность амплитудой свыше 100 мкВ – «заостренные (sharp-looking) альфа-волны»; б) гиперсинхронная бета-активность (excessive fast) – бета-активность амплитудой свыше 30 мкВ, часто в форме веретен, распространяющихся за пределы нормальной лобно-центральной локализации; в) периодическое региональное замедление основной активности в виде вспышек билатерально-синхронных или локальных высокоамплитудных заостренных тета- и дельта-волн; г) повышение средней амплитуды ЭЭГ и увеличение мощности при компьютерном анализе во всех спектральных диапазонах; д) повышение индекса медленноволновой активности более 30%. Наличие перечисленных признаков позволяет даже при отсутствии истинной эпилептиформной активности сделать вывод об избыточной эпилептической синхронизации нейронов головного мозга, и, следовательно, подтвердить диагноз эпилепсии при соответствии анамнеза и клиники.
Сравнительный анализ характера изменений ЭЭГ в различных выделенных группах и подгруппах больных эпилепсией выявил следующие изменения (табл. 2).
Таблица 2. Сравнительная характеристика основных вариантов диффузных изменений на ЭЭГ и видов патологической активности у пациентов основных исследуемых группы и группы контроля.
| Основные характеристики ЭЭГ | Основная группа (n=89) | |||
| 1-я группа (n=34) | 2-я группа без 2A подгруппы (n=37) | 2А подгруппа (n=18) | ||
| Дезорганизованный гиперсинхронный вариант | 33 (97,1%) | 37 (100%) | 18 (100%) | |
| Десинхронный низкоамплитудный вариант | 1 (2,9%) | 0 | 0 | |
| Межполушарная асимметрия | 20 (58,8%) | 5 (13,5%)* | 3 (16,7%) | |
| Вспышки бета активности (excenssive fast) | 4 (11,8%) | 6 (16,2%) | 5 (27,8%) | |
| Замедление основной активности в фоновой записи | I степени | 11 (32,4%) | 7 (18,9%) | 6 (33,3%) |
| II степени | 2 (5,9%) | 0 | 6 (33,3%) | |
| III степени | 0 | 0 | 3 (16,7%) | |
| Периодическое региональное замедление | в лобных отведениях | 8 (23,5%) | 9 (24,3%) | 0 |
| в височных отведениях | 15 (44,1%) | 21 (56,8%) | 5 (27,8%) | |
| Фокальная эпилептиформная активность | бодрствование | 16 (47,1%) | 15 (40,5%) | 5 (27,8%) |
| сон | 6 (17,6%) | 8 (21,6%) | 0 | |
| Cредняя амплитуда (мкВ) | 98±6,7 | 116±4,8 | 93±4.9 | |
| Индекс медленноволновой активности (%) | 39,4±4,4* | 35,4±4,34* | 48,4±4,59 | |
Примечание: * – р
Все пациенты исследуемых групп с различными выделенными вариантами эпилепсии имели статистически значимые отличия (р
Амплитудная и частотная межполушарная асимметрия значительно преобладала в группе больных с поздним дебютом эпилепсии – у 20 (58,8%) пациентов (р
Рис. 1. Региональная эпилептиформная активность «острая-медленная волна» в правой височно-теменной области у пациентки В., 72 лет на фоне выраженной межполушарной асимметрии и относительной сохранности фоновой ЭЭГ в интактном левом полушарии головного мозга. Запись на фоне депривации сна.
На рутинной ЭЭГ у 16 (47,1%) больных с поздним дебютом эпилепсии выявлялся латерализованный очаг медленно-волновой активности в виде заостренных дельта- волн, частотой 1,5-3 Гц, комплексов «острая-медленная волна», реже «спайк-медленная волна», у 6 (17,6%) пациентов эпилептиформная активность выявлена на ЭЭГ мониторинге сна, у 2 (5,9%) выявлена диффузная (билатеральная) эпилептиформная активность. Сторонность выявления эпилептиформных изменений на ЭЭГ и локализации постинсультных рубцовых изменений совпадали в 70,6% (Р=0,016). У 10 (29,4%) пациентов не выявлялось очага эпилептиформной активности на рутинной ЭЭГ; это в основном были пациенты с небольшими, менее 15 мм, очагами размягчения, сформировавшимися в результате перенесенного инсульта.
Запись ЭЭГ во сне удалось провести только у 6 пациентов, так как инсомния является частым сопутствующим симптомом у данной категории больных. ЭЭГ картина медленноволнового сна у представителей 1-й группы характеризовалась дезорганизованностью с удлинением первой фазы медленноволнового сна. Сон при этом был поверхностным, с частыми пробуждениями на 8-12 секунд и артефактами движения; специфические паттерны сна – К-комплексы, вертекс-потенциалы и сонные веретена – были выражены недостаточно отчетливо, дельта- сон укорочен, амплитуда дельта- активности снижена. Стадия «быстрого сна» не была зарегистрирована ни у одного пациента 1-й группы, что в большей степени отражает дисфункцию центральных сомногенных механизмов у больных с церебральной сосудистой патологией. На дезорганизованном фоне у всех 6 пациентов, преимущественно во второй стадии медленноволнового сна, регистрировалась фокальная эпилептиформная активность типа «острая-медленная волна», локализованная в лобно-височных отведениях, на стороне постинсультного очага размягчения (рис. 2).
Рис 2. ЭЭГ больного М., 73 лет с диагнозом: Последствия ишемического инсульта в бассейне левой внутренней сонной артерии; симптоматическая эпилепсия, простые парциальные припадки с вторичной генерализацией. В I-II стадии медленноволнового сна – эпилептиформные комплексы «острая-медленная волна» в левой лобно-височной области.
Таким образом, анализирую структуру биоэлектрической активности у пациентов с поздним дебютом эпилепсии, можно предположить, что изначально, до перенесенного инсульта у больных имела место склонность нейронов коры к пароксизмальным формам реагирования в виде тенденции к высокоамплитудной синхронизации. Однако эти изменения оставались на протяжении жизни латентными и не приводили к клинической манифестации эпилепсии. Ишемический инсульт с локализацией мозгового инфаркта в корковых и корково-подкорковых областях явился тем пусковым моментом, который привел к формированию эпилептиформной активности и клиническому проявлению эпилепсии.
При изучении ЭЭГ у пациентов с длительным анамнезом эпилепсии (2-я группа наблюдений) наблюдался достоверно более высокий амплитудный уровень ЭЭГ (рЭЭГ-мониторинге сна (рис. 3). Индекс медленноволновой активности у пациентов 1-й группы, с ранним дебютом эпилепсии, достоверно выше, чем в группе контроля, но ниже чем у пациентов 1-й группы – с поздним дебютом эпилепсии (р
Рис. 3. ЭЭГ больного К., 77 лет с диагнозом: Симптоматическая эпилепсия, сложные парциальные припадки с вторичной генерализацией. Во второй фазе медленноволнового сна – короткий разряд диффузной эпилептиформной активности «спайк-медленная волна» с инициацией в левой лобно-височной области и феноменом вторичной билатеральной синхронизации.
Таким образом, биоэлектрическая активность в группе больных с ранним дебютом эпилепсии и длительным ее анамнезом отличалась признаками, характерными для биоэлектрической активности пациентов молодого возраста, страдающих эпилепсией, однако у пациентов пожилого возраста эти патологические признаки встречались реже. Процессы старения в биоэлектрической активности головного мозга больных эпилепсией проявляются, прежде всего, увеличением индекса медленноволновой активности, некоторым снижением общего амплитудного уровня ЭЭГ и снижением тенденции к генерализации эпилептиформных разрядов, что находит клиническое отражение в уменьшении доли вторично-генерализованных эпилептических припадков у пожилых пациентов. Можно предположить, что генетически детерминированные особенности биоэлектрической активности головного мозга, явившиеся причиной клинической манифестации эпилепсии, сохраняются на протяжении всей жизни.
Характерные особенности ЭЭГ в подгруппе пациентов старческого возраста (старше 80 лет) с боевой ЧМТ в анамнезе обусловлены возрастом больных и выраженными атрофическими изменениями в коре головного мозга. Основной отличительной чертой ЭЭГ представителей данной подгруппы 2А было увеличение индекса медленноволновой активности (48,4±4,59), что достоверно выше (P
Рис. 4. ЭЭГ больного Ч. 84 лет с диагнозом: Энцефалопатия сложного генеза (посттравматическая, цереброваскулярная), выраженные когнитивные и стато-координаторные нарушения. Симптоматическая эпилепсия, сложные парциальные припадки средней частоты. На ЭЭГ – диффузная медленноволновая активность в виде заостренных высокоамплитудных тета-дельта волн.
Региональная эпилептиформная активность у лиц старческого возраста выявлялась в небольшом проценте случаев – у 5 (27,8%) из 18, тем не менее, частота выявления региональной эпилептиформной активности больше чем в группе сравнения (P
Медленноволновая активность в ЭЭГ пациентов 2А группы более отражает не степень эпилептиформной активности, а уровень патологических морфологических и функциональных изменений нейронов вследствие травматических и сосудистых факторов. Индекс медленноволновой активности у этих пациентов оказался прямо пропорциональным степени атеросклеротического поражения церебральных сосудов и обратно пропорциональным количеству набранных баллов в процессе исследования когнитивных функций с помощью широко известной шкалы ММSE. Интересно, что индекс медленноволновой активности не является статической величиной, он может снижаться после курса сосудистой терапии и, наоборот повышаться при применении некоторых антиконвульсантов, в первую очередь барбитуратов. Это подтверждается анализом ЭЭГ у 3 (16,7%) представителей 2А подгруппы, принимающих барбитураты на протяжении более 60 лет; во всех случаях на ЭЭГ наблюдались грубые общемозговые изменения по органическому типу, продолженная медленноволновая активность различной амплитуды и степени синхронизации, но истинной эпилептиформной активности у данных больных не выявлено (рис. 5).
Рис. 5. ЭЭГ больного М., 85 лет с диагнозом: Сосудисто-атрофическое заболевание головного мозга, деменция, симптоматическая посттравматическая эпилепсия, редкие генерализованные судорожные припадки. Постоянный в течение 50 лет прием бензонала в дозе 100 мг 3 раза в день + фенобарбитала 100 мг на ночь. На ЭЭГ – диффузная медленно-волновая активность с синхронизацией в лобно-центральных отделах. Характерно полное отсутствие физиологических ритмов ЭЭГ. Истинной эпилептиформной активности не выявляется.
Таким образом, увеличение индекса медленноволновой активности на ЭЭГ в процессе лечения противоэпилептическими препаратами – это неблагоприятный прогностический признак углубления когнитивного дефицита который говорит о необходимости замены препарата на более современный или препарат другой группы.
Выводы.
- Частота выявления отчетливой эпилептиформной активности на ЭЭГ у пациентов пожилого и старческого возраста, страдающих эпилепсией, составляет 40,4%, условно-эпилептиформной активности – еще выше, до 72%. В ряде случаев эпилептиформную активность можно выявить при амбулаторном ЭЭГ мониторинге сна. Существуют индивидуальные различия характеристик ЭЭГ в зависимости от этиологии эпилепсии, длительности заболевания, возраста больных.
- Имеются следующие основные отличительные нейрофизиологические особенности ЭЭГ больных эпилепсией пожилого и старческого возраста:
- увеличение спектральной мощности ЭЭГ во всех частотных диапазонах – высокоамплитудный вариант ЭЭГ;
- усиление синхронизирующих влияний срединно-стволовых структур и, как следствие этого, сглаженность зональных различий;
- уменьшение доли бета-активности;
- увеличение индекса медленноволновой активности до 30% и выше, которое включает в себя как замедление основных корковых ритмов в фоновой записи, так и периодическое региональное замедление в виде билатерально-синхронных вспышек тета-дельта-волн;
- региональная эпилептиформная активность приблизительно в 40% выявляется в состоянии бодрствования, в 16% – при ЭЭГ мониторинге сна.
Литература.
- Гехт, А.Б., Бурд Г.С., Селихова М.В. Клинико-нейрофизиологические особенности двигательных нарушений у больных с постинсультной эпилепсией // Журнал неврологии и психиатрии.– 1998.– №7. – С. 4–8.
- Жирмунская, Е.А. В поисках объяснения феноменов ЭЭГ .- М.: НФП Биола, 1996. – 117 с.
- Зенков Л.Р., Елкин М.Н., Медведев Г.А. Клиническая нейрофизиология нейрогериатрических расстройств // Достижения в нейрогериатрии. – М., 1995. – С. 167-173.
- Зенков, Л.Р. Клиническая эпилептология : 2-е изд., испр. и доп. — М.: Медицинское информационное агентство, 2010.- С 123– 129.
- Зенков, Л.Р. Непароксизмальные эпилептические расстройства. – М.: Медпресс- информ, 2007. – 278 с.
- Мухин К.Ю., Петрухин А.С., Глухова Л.Ю. Эпилепсия: Атлас электроклинической диагностики.– М.: Альварес Публишинг, 2004. – 440 с.
- Мякотных В.С., Гальперина Е.Э. Электроэнцефалографические особенности у лиц пожилого и старческого возраста с различной церебральной патологией: Учебно-методические рекомендации. – Екатеринбург: Изд. УГМА. – 30 с.
- Blalock, E.M., Chen K.C., Sharrow K. Gene microarrays in hippocampal aging: statistical profiling identifies novel processes correlated with cognitive impairment // J. Neurosci. – 2003.- Vol. 23. – Р. 3807–3819.
- Carlson C. E., St Louis E.D., Granner M.A. Yield of video EEG monitoring in patients over the age of 50 // Program and abstract of the American Epilepsy Society 58th Annual Meeting. – 2004, 3 – 7 December. – Absract 2.- Р. 226.
- Van Cott, A. C. Epilepsy and EEG in the Elderly // Epilepsia. –2002. –Vol. 43, suppl. 3. – P. 94–102.
Изменения биоэлектрической активности мозга
➥ Похожая статья: Изменения ЭЭГ
Частота биоэлектрической активности может указывать на различные функциональные состояния головного мозга: сон, сознание, познание и некоторые психические расстройства. Снижение биоэлектрической активности может проявляться на ЭЭГ в виде медленных волн, которые чаще всего наблюдаются состояниях, таких как сон, кома,13 смерть мозга, депрессия,14 аутизм,15 опухоли головного мозга, обсессивно-компульсивное расстройство (ОКР),16 синдром дефицита внимания и гиперактивности (СДВГ),17 энцефалит.18
Напротив при повышенной биоэлектрической активности мозга на ЭЭГ отмечаются быстрые волны, при таких состояниях, как эпилепсия,19 беспокойство, посттравматическое стрессовое расстройство (ПТСР) и употребление наркотических средств.20
При этом необходимо отметить, что употребление терминов “снижение” и “повышение” биоэлектрической активности является некорректным, так как биоэлектрическая активность мозга на разных уровнях организации проявляет себя по-разному, и в контексте всего мозга можно лишь оценивать параметры (амплитуду, мощность, индекс) сигналов, полученных при записи ЭЭГ. Затем, опираясь на многочисленные экспериментальные данные можно уже интерпретировать изменения того или иного параметра и говорить о каких-либо изменениях в функциональной активности мозга.
Классификация изменений БЭА
По локализации изменения биоэлектрической активности могут быть:21
- Фокальные – ограниченная зона (до 3-х отведений);
- Региональные – зона доли мозга (3 и более отведений);
- Латерализованные – патологическая активность выявляемая над полушарием;
- Генерализованные – общая патологическая активность, захватывающая весь мозг, регистрирующаяся по всем отведениям по механизмам первичной и вторичной генерализации;
- Диффузные (неуточненные) – невозможно отнести к вышеперечисленным группам. По степени выраженности диффузные изменения биоэлектрической активности можно условно разделить на легкие, умеренные и выраженные.
Диффузные изменения ЭЭГ
A. Плоская ЭЭГ с подавлением вспышек с интервалом 5–10 с. B. Непрерывные генерализованные острые и медленные комплексы. C. Диффузная дельта-активность с пиками в лобно-височных областях, распространяющихся и преобладающих в левом полушарии
Характерной особенностью патологической активности при диффузных изменениях биоэлектрической активности являются отсутствие локальности, непостоянство пространственного распределения (мозаичность), нарушение билатеральной синхронии.
Диффузное поражение мозга часто связано с развитием энцефалопатии, то есть, распространенного мелкоочагового поражения. Вследствие полиморфизма мелкоочаговых изменений и их распространенности патологические изменения весьма разнообразны и не образуют какой-либо организованной активности, что проявляется мозаичными изменениями биоэлектрической активности головного мозга.
Дезорганизация ЭЭГ
При поражении мозга патологические диффузные изменения биоэлектрической активности характеризуются дезорганизацией и отсутствием регулярной доминирующей активности (альфа-ритма). Диффузная патологическая активность может проявляться по-разному (например, в форме медленноволновой ритмики или выявляется эпилептиформная активность), а также иметь различную амплитуду (низкоамплитудная, среднеамплитудная или высокоамплитудная).
Запись видео-ЭЭГ с одноканальной ЭКГ
ЭЭГ демонстрирует «медленную» и «плоскую» фазы во время сердечной асистолии, за которыми следует вторая «медленная» фаза после возобновления сердечного синусового ритма. Миоклонические судороги (МД) возникают при асистолии и после возобновления синусового ритма. Тоническая поза (тонус) возникает во время асистолии. Обратите внимание на артефакт тонического сокращения мышцы, зафиксированный на канале ЭКГ
Дезорганизация биоэлектрической активности, как правило, сопряжена со снижением амплитуды ЭЭГ и отсутствием альфа-ритма, что подробнее описано в статье депрессия альфа-ритма. Дизритмичная активность мозга может проявляться в виде плоской ЭЭГ (III десинхронный тип, рассматривается как пограничная норма), а также с преобладанием альфа-активности (IV дезорганизованный тип) и с преобладанием θ- и δ-активности (V дезорганизованный тип ЭЭГ). Подробнее: классификация нарушений ЭЭГ по типам.
Замедление мозговой активности
Замедление биоэлектрической активности мозга (когда преобладают низкие частоты) не всегда свидетельствует о патологических изменениях и может быть связано с сонливостью. Замедление фоновой ритмики у детей констатируется в зависимости от возрастной группы:
- 1 год – основная частота менее 5 Гц
- 4 года – основная частота менее 6 Гц
- 5 лет – основная частота менее 7 Гц
- старше 8 лет – основная частота менее 8 Гц
Замедление корковой ритмики часто протекает на фоне диффузной дисфункции корковых и подкорковых структур, вследствие сосудистых, метаболических или токсические поражений головного мозга, а у детей может быть следствием перинатальной патологии.
Генерализованное замедление
Паттерн FIRDA с незначительно замедленным фоном тета-ЭЭГ у пожилого мужчины с метаболической энцефалопатией. Также заметны периоды хорошо сформированной затылочной альфа-активности