Дегенерация центральной нервной системы представляет собой необратимые органические и функциональные изменения в спинном и головном мозге, которые приводят к психической дегенерации. Выделяют множество видов заболеваний, последствием которых являются нарушения работы нервной системы. Соответственно, лечение будет зависеть от вида заболевания и причин, его вызывающих. К сожалению, далеко не все болезни ЦНС поддаются лечению. Успешную терапию дегенеративных заболеваний ЦНС выполняют в Юсуповской больнице.
Дегенеративные заболевания ЦНС: общие понятия
Основными характеристиками группы дегенеративных заболеваний ЦНС являются следующие критерии:
- заболевания начинаются незаметно, до их появления нервная система могла работать абсолютно нормально;
- заболевания имеют постепенно прогрессирующее течение, могут длиться годы или десятилетия;
- некоторые дегенеративные заболевания связаны с наследственными факторами и развиваются у нескольких членов одной семьи;
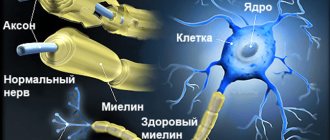
- нейродегенеративное заболевание ЦНС характеризуется постепенной гибелью нейронов и заменой их глиальными элементами;
- атрофические процессы на начальной стадии развития патологии возникают в каком-либо определенном участке одного из полушарий головного мозга; далее в периоде развернутой стадии дегенерации атрофия в головном мозге становится практически симметричной.
Различные заболевания ЦНС, список которых достаточно длинный, остаются на стадии изучения. Достоверно неизвестны причины возникновения атрофических процессов при нормальном функционировании нервной системы большую часть жизни человека. Тем не менее, существует ряд факторов, которые могут провоцировать дегенерацию головного мозга:
- злоупотребление алкоголем, наркомания;
- токсическое влияние пестицидов и гербицидов;
- менингококковая инфекция;
- вирусные энцефалиты;
- дефицит витамина В12 и фолиевой кислоты.
4.Течение болезни и уход за больными НДЗ
Неуклонное прогрессирование заболеваний, связанных с нейродегенерацией, приводит таких больных к инвалидности. Они подвержены не только расстройствам интеллекта, памяти и мышления, но и беззащитны перед нарастающими двигательными нарушениями. Утрата здоровой координации движений нередко приводит к травмам. Вегетативная нервная система под «руководством» больного мозга начинает сбоить, приводя к расстройствам пищеварения, сухости кожи, запорам, нарушению мочеиспускания.
Дееспособность больных нейродегенеративными заболеваниями также всегда является спорным вопросом. Многие из них способны на асоциальные поступки и представляют угрозу для самих себя и окружающих.
Лечение НДЗ всегда неспецифическое и направлено на оказание симптоматической помощи, осуществление должного ухода за больным, сохранение как можно более длительно способности пациента взаимодействовать с теми, кто берёт его под свою опеку. На более тяжёлых стадиях основные задачи – кормление, гигиена, профилактика инфекций и травм, а также пролежней и иных осложнений.
Органические заболевания ЦНС
Наличие органического заболевания центральной нервной системы означает, что головной мозг неполноценен. Патология может быть врожденной или приобретенной. Неврологи утверждают, что органические нарушения ЦНС первой стадии можно найти у 98% населения, однако они не требуют лечения. Вторая и третья стадии характеризуется более серьезными поражениями и сопровождаются значительными отклонениями.
Врожденные органические поражения головного мозга происходят в период эмбрионального развития или во время родов в результате родовой травмы. Причинами их появления могут быть неблагоприятные факторы, которые влияли на беременную женщину:
- употребление женщиной алкоголя, наркотиков;
- тяжелое течение гриппа или других инфекционных заболеваний во время беременности;
- действие некоторых лекарственных препаратов;
- сильный стресс.
Приобретенные органические поражения могут возникнуть после инсульта, черепно-мозговой травмы, злоупотребления алкоголем и наркотиками, инфекционных заболеваний с поражением головного мозга.
Среди болезней, которые вызваны органическими поражениями ЦНС, выделяют олигофрению и деменцию. При олигофрении происходит задержка умственного развития. Заболевание возникает в период внутриутробного развития или на первом году жизни. У детей снижен интеллект, плохо развивается речь и моторика. При деменции происходит утрата уже приобретенных навыков и знаний. Постепенно деменция приводит к полной деградации человека. Рассматривая данное заболевание ЦНС, симптомы выделяют следующие: нарушение памяти, речи, ориентации в пространстве, человек не может учиться новому и теряет старые навыки и знания.
Ранняя диагностика нейродегенеративных заболеваний
С.Н. Иллариошкин доктор медицинских наук, профессор, заместитель директора по научной работе ГУ Научный центр неврологии РАМН
Термином нейродегенеративные заболевания» определяется большая группа заболеваний преимущественно позднего возраста, для которых характерна медленно прогрессирующая гибель определенных групп нервных клеток и одновременно — постепенно нарастающая атрофия соответствующих отделов головного и/или спинного мозга. Наиболее известными представителями этого класса заболеваний человека являются болезни Альцгеймера, Паркинсона, Гентингтона, Пика. Поскольку в развитых странах мира наблюдается неуклонное старение населения, общая частота нейродегенеративных заболеваний имеет четкую тенденцию к увеличению. Достаточно сказать, что у людей старше 70 лет распространенность этих заболеваний составляет около 5%, а среди лиц старше 80 лет — уже 10-15%; число пациентов только с болезнью Альцгеймера в мире превышает 30 млн. При этом следует помнить, что указанные страдания затрагивают как психику человека (потеря памяти и в конечном счете деменция при болезни Альцгеймера), так и его способности двигаться и обслуживать себя (скованность, дрожание, расстройства ходьбы при болезни Паркинсона). Таким образом, социальная значимость данной проблемы очевидна.
К сожалению, для большинства нейродегенеративных болезней отсутствуют радикальные методы лечения, которые позволили бы полностью остановить патологический процесс и тем более обратить его вспять. Возможности симптоматической помощи таким пациентам ограничены, причем в поздних стадиях лечение особенно затруднено и нередко сопровождается многочисленными осложнениями, которые нередко могут быть даже «хуже» самой болезни. Например, применение в поздней стадии болезни Паркинсона лекарств, восполняющих дефицит двигательных импульсов в мозгу, может из-за патологической реактивности нервных клеток привести к превращению малоподвижного пациента в «танцующего маньяка», не способного ни на минуту остановиться (это чревато полным истощением, падениями, травмами и т.п.).
Где же выход? Как общество может эффективно противостоять этим, в буквальном смысле слова, «болезням века»?
Согласно современным представлениям, ключевое значение в стратегии борьбы с нейродегенеративными заболеваниями придается максимально ранней диагностике патологического процесса и в особенности — диагностике болезни в ее латентной стадии (синонимы — доклиническая, пресимптоматическая стадия). Латентная стадия означает, что на клеточном и молекулярном уровне болезнь уже началась и определенная часть нейронов уже погибла, но человек пока не ощущает себя больным и со стороны может выглядеть «в полном порядке». Причем «запас прочности» центральной нервной системы весьма высок: например, боковой амиотрофический склероз манифестирует лишь когда свыше 50% двигательных нейронов спинного мозга перестают функционировать, а болезнь Паркинсона входит в клиническую стадию лишь после гибели более 70% нейронов среднего мозга, ответственных за двигательные функции. Всё, что происходит на более раннем этапе — это латентная фаза болезни.
Данные многочисленных клинических и экспериментальных исследований показывают, что при большинстве нейродегенеративных заболеваний латентная фаза длится в среднем около 6-8 лет, а затем сравнительно быстро развивается манифестация явных клинических проявлений болезни. Именно эти несколько лет составляют наиболее благоприятное “терапевтическое окно”, в течение которого необходимо стремиться диагностировать патологию и постараться вмешаться в неблагоприятный «сценарий» — предотвратить или хотя бы отсрочить наступление необратимых изменений.
Задача диагностики латентной стадии нейродегенерации базируется на двух нижеследующих составляющих. 1. Выделение факторов риска и формирование групп риска — лиц с высокой предрасположенностью к развитию болезни. Наиболее часто речь идет о генетических и средовых факторах риска той или иной болезни. Например, весьма значимым генетическим фактором риска болезни Альцгеймера является е4-вариант гена аполипопротеина Е (аполипопротеин Е отвечает за транспорт липидов и их «мобилизацию» при построении мембран нейронов): если человек имеет две копии такого гена, то у него риск развития болезни Альцгеймера в пожилом возрасте составляет свыше 90%. Иллюстрацией средовых факторов риска может служить выявленная взаимосвязь между частотой возникновения болезни Паркинсона и длительным, многолетним контактом с некоторыми пестицидами (что может иметь место у лиц, занятых в агрохимическом производстве).
2. Установление биомаркеров ранней и пресимптоматической стадии нейродегенеративного процесса. Биомаркеры — это различные лабораторно-инструментальные показатели состояния организма, которые могут «сигнализировать» о текущем неблагополучии (в том числе о неблагополучии со стороны центральной нервной системы). В неврологии наиболее перспективными считаются три группы биомаркеров:
• нейрофизиологические и нейропсихологические (изменение нормальной картины биоэлектрической активности мозга при электроэнцефалографии, тонкие изменения психики и профиля личности при использовании специальных тестов и др.); • молекулярно-биохимические (например, повышение в цереброспинальной жидкости и крови пациентов уровня некоторых белков, строго специфичных для вещества мозга); • нейровизуализационные (выявление с помощью специальных методик рентгеновской, магнитно-резонансной или радиоизотопной компьютерной томографии тех или иных функционально-биохимических изменений в веществе мозга либо тонких признаков нарастающего уменьшения объема отдельных ядер — скоплений нейронов в определенных отделах мозга).
Выявление у человека из группы риска одного или нескольких вышеуказанных маркеров нейродегенеративного процесса позволяет с высокой степенью вероятности (которую можно даже рассчитать специальными методами) диагностировать наличие латентной стадии болезни и поставить вопрос о проведении ранней терапии, направленной на предотвращение прогрессирования (нейропротекция). По существующим прогнозам, новые препараты с доказанным нейропротективным действием могут появиться в арсенале врачей-неврологов уже в самые ближайшие годы, и мы обязательно затронем эту проблему в будущих номерах журнала.
© Журнал «Нервы», 2008, №1
наверх
Инфекционные заболевания ЦНС
Инфекционные заболевания ЦНС являются одними из наиболее распространенных неврологических патологий. Заболевания ЦНС, вызванные инфекцией, очень опасны. Они имеют тяжелое течение, оставляют серьезные последствия и значительный неврологический дефицит. Инфекционные заболевания ЦНС могут вызывать бактерии, вирусы, грибковые заболевания. Чаще всего заболевания развиваются при проникновении в организм менингококка, стафилококка, пневмококка, энтеровирусов ECHO и Коксаки, эпидемического паротита, кандиды. Входными воротами для инфекции являются ЛОР-органы, также она передаётся контактным, гематогенным, лимфогенным, периневральным путем.
Инфекция может поражать нервную систему как первичное заболевание или возникнуть вторично, в результате развития инфекционного процесса вне ЦНС. К инфекционным заболеваниям ЦНС относят:
- менингит,
- энцефалит,
- полиомиелит,
- сифилис нервной системы,
- токсоплазмоз нервной системы,
- неврологические проявления ВИЧ-инфекции,
- паразитарные заболевания нервной системы.
Сосудистые заболевания ЦНС
Нарушение кровообращения в головном мозге провоцирует развитие сосудистых заболеваний ЦНС. Эти патологии чрезвычайно опасны, поскольку приводят в большинстве случаев к инвалидизации человека. Также сосудистые заболевания ЦНС имеют большой процент смертности. Поражение головного мозга происходит в результате ишемических и геморрагических инсультов, транзиторных ишемических атак, спонтанных субарахноидальных кровоизлияний. Причинами подобных патологий являются:
- аневризмы,
- тромбоэмболии,
- атеросклероз сосудов,
- гипертоническая болезнь,
- острые токсические поражения стенок сосудов,
- хронические дегенеративные заболевания стенок сосудов.
Пусковым механизмом развития инсультов могут быть сильные стрессы, судорожные припадки, алкогольная интоксикация, резкие перепады температуры тела. Сосудистое заболевание ЦНС чаще всего возникает спонтанно и требует незамедлительного обращения за медицинской помощью.
Заболевания экстрапирамидной системы (болезнь Паркинсона и другие)
Болезнь Паркинсона («shaking palsy» — дрожательный паралич)
— медленно прогрессирующее хроническое заболевание, которое относится к нейродегенеративным заболеваниям головного мозга и характеризуется гибелью нейронов, вырабатывающих особое вещество — дофамин. Недостаточная выработка дофамина ведет к появлению основных симптомов заболевания:
- замедленности движений (брадикинезии);
- скованности движений (мышечной ригидности);
- дрожания (тремора);
- потери равновесия (постуральной неустойчивости).
Ведущие симптомы болезни приводят к тому, что движения становятся скованными, появляется неловкость при выполнении привычных дел, происходит обеднение движений. Кроме того, почерк становится мельче, в некоторых случаях присоединяется дрожание рук и ног, затрудняются мелкие движения руками, становится сложно застегнуть пуговицы, почистить зубы, одеться, завязать шнурки, порезать пищу. Дрожание усиливается при волнении и сохраняется в покое. Постепенно появляется неустойчивость, шаткость при ходьбе, а любой толчок может привести к потере равновесия и даже падению. Со временем меняется походка пациента. Сумма всех симптомов отрицательно влияет на качество жизни пациента и его привычную активность на работе и дома.
Причины болезни Паркинсона
Причины заболевания не установлены. Допускается возможность генетической предрасположенности с участием факторов внешней среды. Существует несколько гипотез, которые связывают развитие заболевания с такими факторами: раннее или «ускоренное» старение нейронов головного мозга под воздействием биохимического дефекта, нарушения в иммунной системе, воздействие внешних или внутренних токсических агентов и т.п.
Симптомы болезни Паркинсона
Следующие симптомы, которые особенно характерны для болезни Паркинсона, считаются главными или ведущими. Как правило, симптомы болезни сначала возникают и развиваются на одной стороне тела, а уже затем — менее выражено — на другой.
Замедленность движения (брадикинезия)
Под этим понимается затруднение движений. Движения становятся медленными, сокращается амплитуда движений. Типичным примером брадикинезии является короткий шаг, медленная ходьба, заторможенные жесты и мимика, тихая и монотонная речь, мелкий почерк.
Скованность движений (мышечная ригидность)
Этот симптом выражается в скованности движений частей тела. Когда человек, страдающий болезнью Паркинсона, двигает рукой или ногой, становится заметна трудность движений. Это связано с повышением мышечного тонуса. По мере развития заболевания ригидность мышц нарастает, что приводит к развитию характерной позы: голова согнута и наклонена вперед, руки согнуты в локтевых суставах и прижаты к туловищу, спина и ноги согнуты. Некоторые пациенты могут долгое время поддерживать позы, невозможные для здоровых людей, например, лежать, держа голову над подушкой.
Дрожание (тремор)
Тремор является у многих пациентов первым симптомом болезни Паркинсона, но у 30% может совсем отсутствовать. В большинстве случаев тремор начинается с руки или ноги и может постепенно возникать в других частях тела. Наиболее типичны ритмичные движения одного пальца кисти по направлению к остальным, что напоминает счет монет или скатывание пилюль. Обычно тремор более выражен в покое и заметно уменьшается или исчезает при целенаправленных движениях. Эмоциональное напряжение часто усиливает тремор.
Постуральная неустойчивость
По мере развития болезни у пациентов возникает неустойчивость в положении стоя и при ходьбе. Причиной являются нарушения равновесия, возникающие из-за ослабления стабилизирующих рефлексов. Такие нарушение равновесия могут ощущаться как головокружение или страх падения. Выраженные нарушения равновесия при болезни Паркинсона приводят к падениям и даже травмам. У пациентов пожилого возраста риск получения травмы возрастает из-за сопутствующего остеопороза и мышечной слабости.
Нарушения памяти и психические расстройства
Со временем болезнь приводит к нарушению внимания, памяти, затруднениям в ориентации, замедленности мышления. Иногда появляются равнодушие (апатия) и безучастность (безынициативность, абулия). У многих пациентов наблюдаются также психические расстройства, появляется депрессия, фобии, бессонница, иногда — бред и галлюцинации. Эти проявления заболевания нередко очень тяжелы как для самого
В настоящее время для оценки нарушений, связанных с болезнью Паркинсона, используют специальную шкалу Хен и Яра. Согласно этой классификации, любой случай болезни может быть отнесен к одной из 5 стадий:
I стадия
— симптомы болезни присутствуют только с одной стороны тела;
II стадия
— двусторонняя симптоматика без нарушений устойчивости во время ходьбы;
III стадия
— двусторонняя симптоматика с нарушениями устойчивости во время ходьбы;
IV стадия
— обездвиженность, потребность в посторонней помощи. При этом больной способен ходить и/или стоять без поддержки;
V стадия
— больной прикован к креслу или кровати. Тяжёлая инвалидизация.
Диагностика болезни Паркинсона
Диагноз «болезнь Паркинсона» устанавливается на основании жалоб, истории заболевания и наличия характерных клинических симптомов. Инструментальные методы исследования позволяют врачу дополнительно утвердиться в своем предположении, поскольку специфические маркеры заболевания в крови или в головном мозге при рутинных исследованиях выявить невозможно.
Следует помнить, что многие симптомы, характерные для болезни Паркинсона, могут появляться и при других заболеваниях, поэтому диагноз должен устанавливаться квалифицированным неврологом.
Так как эффективность лечения болезни Паркинсона напрямую зависит от того, на какой стадии начата терапия, диагностику необходимо проводить при наличии любых подозрений.
Лечение болезни Паркинсона
Методов, которые бы позволили вылечить болезнь Паркинсона, на сегодняшний день не существует. Однако правильная терапия, подобранная квалифицированным врачом, уменьшает выраженность симптомов, повышает качество жизни пациентов и продлевает период активности.
Какие есть возможные пути лечения болезни Паркинсона?
Лечение болезни Паркинсона охватывает три важнейших направления:
- медикаментозная (симптоматическая) терапия;
- лечебная физкультура;
- нейрохирургическое лечение.
Медикаментозная терапия
При болезни Паркинсона требуется длительный прием лекарственных препаратов. Выбор препарата и режим его приема определяет лечащий врач. При болезни содержание дофамина в головном мозге снижается, поэтому для лечения заболевания принимают вещества, повышающие его содержание:
Леводопа (L-дофа)
Предшественник дофамина, основное средство терапии болезни Паркинсона. В отличие от самого дофамина, принятый внутрь L-дофа может проникнуть в головной мозг через естественный барьер. Леводопа уменьшает выраженность симптомов болезни Паркинсона, таких как замедленность и скованность. При дрожании лечебный эффект достигается у 50—60% пациентов. Схема приема, суточная и разовая доза препарата определяется для каждого пациента индивидуально. Результат лечения во многом зависит от квалификации лечащего врача и его умения подобрать оптимальную для каждого конкретного пациента схему терапии.
Агонисты дофаминовых рецепторов
Вещества, усиливающие действие дофамина. Попадая в кровь, они усиливают действие дофамина и вызывают те же эффекты, что и леводопа. Являясь препаратами выбора, используются в качестве начальной терапии у пациентов младше 65 лет.
Амантадины
Блокируют глутаматные NMDA-рецепторы, оказывают непрямое действие на дофаминовые рецепторы, повышают внеклеточную концентрацию дофамина.
Ингибиторы моноаминоксидазы типа В (МАО-В) и катехол-О-метилтрансферазы (КОМТ)
В организме существуют ферменты, расщепляющие дофамин. Уменьшение активности этих ферментов естественным образом повышает концентрацию дофамина в нервной системе. Эффект от приема этих препаратов аналогичен действию леводопы, хотя его выраженность значительно меньше. Эти препараты позволяют усилить эффекты леводопы, не повышая и даже снижая её дозу.
« На предыдущую страницу
Лечение и диагностика дегенеративных заболеваний ЦНС
Опасность дегенеративных заболеваний ЦНС состоит в том, что их сложно предвидеть. При наличии провоцирующих факторов в жизни человека рекомендуется вести здоровый образ жизни и регулярно посещать невролога для профилактических осмотров. Заподозрив признаки заболевания ЦНС, следует немедленно обратиться к врачу. Чем раньше будет выявлено заболевание, тем больше шансов замедлить прогрессирование дегенеративных процессов в головном мозге.
Диагностика и лечение дегенеративных заболеваний будет зависеть от вида патологии. Определив клиническую картину болезни, врач назначит исследования для уточнения состояния пациента. Они могут включать лабораторные анализы, УЗИ, МРТ, КТ, и психологические тесты для определения состояния когнитивных навыков.
В Юсуповской больнице города Москвы работает клиника неврологии, в которой оказывают помощь высококвалифицированные неврологи, доктора наук. Врачи Юсуповской больницы имеют большой опыт лечения дегенеративных заболеваний ЦНС и используют в своей работе новейшие методики терапии и реабилитации, что позволяет браться за самые сложные случаи.
Обратиться за помощью, записаться на прием и получить консультацию специалистов можно по телефону.
Сегодня становится все труднее провести разграничение между сосудистым, дегенеративным и иммунноопосредованным (аутоиммунным, воспалительным) заболеваниями нервной системы. Этому способствовали обнаружение общих факторов риска развития болезни Альцгеймера (БА) и сосудистой деменции [1—3], выявление маркеров нейродегенерации при рассеянном склерозе (РС) [4—7], данных об ускорении прогрессирования нейродегенеративного заболевания — болезни Паркинсона (БП), а также БА в условиях активации системного воспаления [8, 9] и целый ряд других открытий.
Воспаление относится к типовым патологическим процессам организма человека. Типовой патологический процесс проявляется рядом характерных признаков:
— стереотипностью (развитие по генетически детерминированным механизмам независимо от локализации и этиологии);
— универсальностью (протекание как интегральной части патогенеза разных нозологических форм на разных уровнях организации биологической системы);
— полиэтиологичностью (индуцирование большим числом этиологических факторов различной природы и происхождения, выполняющих лишь триггерную роль);
— аутохтонностью (наличие потенциала саморазвития);
— резервированием надежности (наличие нескольких эволюционно сложившихся путей реализации);
— интерактивностью (способность индуцировать и амплифицировать развитие других типовых патологических процессов);
— эквифинальностью (однотипность финальных результатов).
РС — заболевание, традиционно относящееся к аутоиммунным с развитием воспалительных процессов в центральной нервной системе (ЦНС), Благодаря последним исследованиям представление о РС существенно изменилось. Появились убедительные данные о роли нейродегенерации как ведущего процесса, приводящего к стойкой инвалидизации пациентов [4, 7, 10, 11]. Выяснилось, что количество очагов в Т2-режиме магнитно-резонансной томографии (МРТ), в том числе активно накапливающих контраст, не коррелирует со степенью инвалидизации и не характеризует прогрессирование болезни. Кроме того, нередко новые Т2-очаги демиелинизации по данным МРТ остаются клинически бессимптомными. Эти данные создали основу новой гипотезы, согласно которой РС рассматривается как нейродегенеративное заболевание. Действительно, постепенное и неуклонное нарастание инвалидизации, как это происходит при вторично-прогрессирующем и первично-прогрессирующем РС, более типично для течения дегенеративного процесса. В основе нарастания необратимого неврологического дефицита лежит формирование так называемых черных дыр (участков необратимой гибели аксонов при визуализации в Т1-режиме) и развитие атрофии головного и спинного мозга, видимых при МРТ [11].
На определенных этапах механизмы нейродегенерации при РС и БА могут иметь общие черты. Так, при БА прогрессирование заболевания связывают с накоплением патологического белка бета-амилоида, нейрофиламентов в головном мозге. При Р.С. также было обнаружено скопление предшественника бета-амилоида, который является основным составляющим амилоидных бляшек при БА, в аксонах вокруг бляшек, и концентрация этого белка коррелирует со стадиями заболевания [12]. Исследования, опубликованные в октябре 2021 г., указывают на то, что низкое содержание бета-амилоида в цереброспинальной жидкости (ЦСЖ) является биомаркером нарастания инвалидизации по расширенной шкале оценки степени инвалидизации (Expanded Disability Status Scale — EDSS) в течение 3-летнего наблюдения, а уровень тау-белка в ЦСЖ коррелирует с увеличением общего объема очагов в Т2- и Т1-режимах при МРТ головного мозга [13]. Низкие значения уровня бета-амилоида в ЦСЖ определяли прогрессирование заболевания и инвалидизацию в течение ближайших 3 лет (р
=0,009). Авторы подтверждают положение, что нарушение обмена бета-амилоида может служить маркером нейродегенерации при РС и определять формирование необратимого неврологического дефекта.
Хотя теоретически скопление предшественника бета-амилоида могло бы сдерживать воспаление, имеются сведения, что этот белок оказывает нейротоксическое действие и вызывает воспалительные изменения в демиелинизированных аксонах. При введении животным белка бета-амилоида описаны повреждение и демиелинизация аксонов [14]. Более того, вакцинация животных амилоидным белком приводила к повреждению белого вещества и гибели олигодендроцитов, уменьшению числа нейронов в перивентрикулярной зоне, гиппокампе, подавлению нейрогенеза. Вместе с тем существует гипотеза, что бета-амилоид может выступать и как белок, ограничивающий воспаление вокруг бляшек [15].
В настоящее время активно обсуждается возможность определения при помощи позитронно-эмиссионной томографии (ПЭТ) с радиолигандами, способными метить церебральный бета-амилоид, как зон демиелинизации, так и участков ремиелинизации. Другой белок, ответственный за развитие нейродегенерации, — альфа-синуклеин, патологические формы которого связывают с развитием и прогрессированием БП, также может принимать участие в патогенезе Р.С. Было установлено, что уровень альфа-синуклеина повышается при обострении РС и оптикомиелите [5].
Остается принципиальный вопрос: если возможно остановить прогрессирование повреждения белого вещества при РС, то можно ли остановить прогрессирование болезни и инвалидизацию? Некоторые последние исследования указывают на способность ингибиторов миграции макрофагов, моноклональных антител, направленных против определенных популяций Т- и В-лимфоцитов, провоспалительных цитокинов, молекул адгезии и прочих регуляторных процессов иммунной системы, влиять не только на частоту обострений, но и уменьшать по сравнению с плацебо степень атрофии головного мозга [16—18]. Это с большей вероятностью указывает на вторичность нейродегенеративного процесса по отношению к воспалительному. Отсутствие данных об определенных генетических маркерах РС (до настоящего времени не установлены гены, определяющие развитие РС), высокая частота развития заболевания у лиц, перенесших инфицирование вирусом Эпштейна—Барр, и, наоборот, крайне редкая встречаемость РС у не болевших этой инфекцией также свидетельствуют о первичности воспалительных процессов при ремиттирующем РС с присоединением атрофии и гибели аксонов при прогредиентном течении [19].
Наличие митохондриальной дисфункции, оксидативного повреждения, характерных для нейродегенеративного процесса, также может способствовать дегенерации аксонов и нейронов при Р.С. Недавно опубликованы данные о замедлении атрофии головного мозга при длительном применении 1200 мг антиоксиданта липоевой кислоты у больных с вторично прогрессирующим РС в слепом плацебо-контролируемом исследовании [20]. Средний балл по шкале EDSS в этом исследовании у больных составлял 5,5. К концу 96-й недели рассчитывали процент годовой атрофии всего головного мозга и сравнивали между группами. Оказалось, что в группе больных, принимавших липоевую кислоту, степень атрофии была в 3 раза меньше, чем в группе плацебо (0,22 и 0,66% в год соответственно, р
=0,004). Известно также, что низкий уровень витамина D3 в крови является прогностически неблагоприятным фактором развития и прогрессирования РС [21], и назначение терапевтических доз витамина D3 оказывает благоприятное влияние на течение заболевания [7, 11, 22].
Сложнее ситуация с пониманием патогенеза нейродегенеративных заболеваний, к которым в первую очередь относятся БА и БП. В основе их развития лежит накопление патологических молекул тау-белка с образованием нейрофибриллярных клубочков и амилоидных бляшек при БА и интранейрональная экспансия патологических форм белка альфа-синуклеина при Б.П. Но всегда ли правильно бывают поняты причины и пусковые факторы возникновения этих болезней и, самое главное, можно ли выделить ключевые звенья прогрессирования этих хронических инвалидизирующих заболеваний нервной системы?
Заслуживает внимания тот факт, что любая хроническая инфекция может способствовать манифестации нейродегенеративного заболевания. Длительная персистенция вирусов простого герпеса 1-го типа ассоциирована с риском развития деменции и БА, цитомегаловируса — с развитием сосудистой деменции [23]. Хроническая инфекция приводит к активации микроглии в головном мозге, синтезу провоспалительных цитокинов (TNF-α, FGAP, IL-1, IL-6, индуцибельной формы оксида азота и др.) и запускает нейродегенеративный процесс. Первоначально защитный механизм трансформируется в патологический.
БП относят к классическим нейродегенеративным заболеваниям [24]. В основе заболевания лежит нарушение конформации клеточного белка альфа-синуклеина — основного компонента телец Леви (тельца Леви, представляющие собой крупные эозинофильные включения в цитоплазме дегенерирующих нейронов, считаются патогномоничным морфологическим признаком БП). Несмотря на обычно медленное постепенное прогрессирование БП, известно, что перенесенные острые вирусные, бактериальные инфекционные заболевания, травмы вызывают ухудшение состояния больных, вплоть до выраженной декомпенсации. Так, любое воздействие на организм, провоцирующее системную или локальную воспалительную реакцию, негативно влияет на симптомы болезни. Изучение этих фактов привело к пониманию роли воспаления в ЦНС, которое может быть инициатором и фактором, способствующим прогрессированию как моторных, так и немоторных симптомов БП [8, 9]. Классические биомаркеры воспаления в периферической крови больных с БП (TNF-α, С-реактивный белок) коррелировали с показателями шкал, оценивающих депрессию, утомляемость, когнитивные функции и даже галлюцинации. Повышенный уровень С-реактивного белка положительно коррелировал с двигательным разделом унифицированной шкалы оценки БП (Unified Parkinson’s Disease Rating Scale — UPDRS). Глиальные клетки обеспечивают выживание нейронов за счет высвобождения трофических факторов и поддержания локальной иммунореактивности. Под влиянием различных воздействий (травма головного мозга, инфекция) клетки микроглии и астроглии активизируются и удаляют поврежденные клетки мозга. Однако при нейродегенеративных заболеваниях хроническая активация микроглии и астроглии приводит к реактивному микроглиозу и астроглиозу. Глиоз нарушает процессы нейропластичности и усиливает нейротоксические эффекты альфа-синуклеина и цитокинов. Сегодня можно говорить о том, что дегенеративный процесс при БП происходит при активном участии нейроглии с вовлечением не только астроглии, но и олигодендроцитов. Последние данные о патологии проводящих путей и миелинизированных волокон указывают на определенную их роль в прогрессировании болезни [25, 26]. Если воспалительные медиаторы связаны с прогрессированием болезни, то существует потенциальная возможность селективной противовоспалительной терапии влиять на прогрессирование БП в целом. Имеющиеся сведения о снижении риска развития БП и БА у лиц, принимавших чаще нестероидные противовоспалительные препараты (в частности, ибупрофен снижает риск на 21%), носят ретроспективный характер, но до последнего времени не проведено клинических исследований новых препаратов, влияющих на процессы воспаления [27, 28]. Получены лишь экспериментальные данные о способности блокатора растворимой формы TNF-α XPro 1595 препятствовать гибели нейронов черной субстанции и активации глии в головном мозге у животных на 6-OHDA-новой модели паркинсонизма [29]. При этом оказалось, что импульсное введение леводопы экспериментальным животным вызывает повышенный синтез провоспалительных цитокинов в стриатуме и индукцию дискинезий, сопоставимые с системным введением бактериального липополисахарида. Внутрибрюшинное введение липополисахарида (активатор системного воспаления) сопровождалось активацией синтеза индуцибельной формы NO, TNF-α, GFAP в стриатуме и достоверно повышало выраженность дискинезий, в то время как постоянное введение леводопы с помощью помпы не сопровождалось изменением синтеза провоспалительных цитокинов в мозге и не индуцировало развитие дискинезий [30].
Особый интерес представляют данные о роли хронического воспаления в желудочно-кишечном тракте (ЖКТ) как триггера нейродегенеративных заболеваний, в том числе при БП [31]. Экспериментальные исследования убедительно указывают на роль дисбиотических процессов тонкой кишки в инициации и прогрессировании БП. В исследованиях на мышиных моделях, которые экспрессируют альфа-синуклеин, установлено, что микробиоматерия пищеварительного тракта необходима для реализации моторных нарушений, активации микроглии и расширения зон накопления патологического белка альфа-синуклеина в мозге. При этом антибиотикотерапия препятствует, а микробная реколонизация — способствует двигательным расстройствам у взрослых животных. Это свидетельствует о том, что постнатальная передача сигналов между пищеварительным трактом и головным мозгом модулирует болезнь. Оказалось, что пероральный прием определенных микробных метаболитов кишечной флоры стерильным мышам вызывает воспаление в ЦНС и моторные симптомы паркинсонизма. Так, микробное обсеменение кишечника мышей, которые экспрессируют альфа-синуклеин, микробиоматериалами кишки от пациентов с БП усиливает моторные симптомы по сравнению с пересадками микробиоматериалов от здоровых человеческих доноров. Эти результаты показывают, что бактерии пищеварительного тракта регулируют двигательные расстройства у мышей, и предполагают, что альтерация человеческого микробиома представляет фактор риска Б.П. Хроническое воспаление в тонкой кишке может приводить к активации глиальных клеток энтеральной нервной системы (преимущественно вегетативных волокон) и нарушению конформационных свойств белков (в данном случае альфа-синуклеина). В дальнейшем по афферентным волокнам блуждающего нерва аберрантные молекулы альфа-синуклеина транссинаптически проникают в ЦНС и начинают проявлять прионоподобные свойства. В пользу этой гипотезы свидетельствуют данные крупного 20-летнего исследования, опубликованного в 2015 г., где показано снижение риска развития БП у лиц, перенесших двустороннюю ваготомию, почти в 2 раза [32]. Последние данные, опубликованные в 2021 г. по результатам изучения биопсийного материала прямой кишки, подтверждают наличие воспаления и дисфункции интестинального барьера у пациентов с БП, способствующих накоплению патологических форм фосфорилированного альфа-синуклеина в подслизистых ганглиях и нервных волокнах [33]. Таким образом, одним из терапевтических направлений при БП может являться модификация кишечного микробиома, снижение проницаемости интестинального эпителиального барьера с целью устранения дисбиоза и хронического воспаления, как, возможно, первого шага последующего разрушительного каскада нейродегенеративного процесса при этом заболевании.
С учетом противовоспалительного потенциала статинов привлекает внимание и активно обсуждается не только их роль в терапии сосудистых заболеваний, но и их применение в качестве средств профилактики и, возможно, лечения БА и БП [34]. Благоприятное влияние статинов на воспаление реализуется достаточно сложным механизмом, включающим блокирование водородпотребляющей активности метаногенной микрофлоры кишечника (без формирования дисбиоза) и ингибирующее влияние молекулярного водорода на экспрессию мРНК индуцибельной NO-синтазы и провоспалительных цитокинов (IL-1b, IL-6, TNF-α) [35].
Для оценки влияния статинов на риск развития БА и БП в США было выполнено большое многоцентровое исследование [34], в котором проанализированы данные более 4,5 млн пациентов старше 65 лет, у которых на момент включения в протокол наблюдения не было выявлено признаков БА и Б.П. Пациенты получали различную терапию по поводу гипертонической болезни, ишемической болезни сердца, сахарного диабета и других хронических заболеваний. Около 700 тыс. из них получали терапию симвастатином. В качестве конечной точки рассматривали наступление нового случая развития деменции (БА) и Б.П. Прием симвастатина снижал риск развития деменции у этих больных более чем в 2 раза (отношение шансов 0,46; p
<0,0001), также достоверно реже развивалась БП (отношение шансов 0,51, 95% доверительный интервал 0,4—0,55;
p
<0,0001).
Данные о протективном эффекте статинов на развитие БП были подтверждены в другом крупном американском исследовании [36], включавшем 94 308 мужчин и женщин, наблюдавшихся в течение 7 лет. За этот период БП была впервые установлена у 1035 больных. Прием симвастатина достоверно снижал риск развития заболевания (соотношение риска 0,73, 95% доверительный интервал 0,60—0,88; р
=0,001).
Говоря о воспалении как типовом патологическом процессе, можно увидеть не только общие черты патогенеза при разных прогрессирующих заболеваниях нервной системы. Следует также обратить внимание на новые возможности патогенетической терапии.
Интерес представляют данные о способности бета-интерферона, применяемого для лечения РС, активировать процессы аутофагии в нейронах, приводя к деградации патологических форм альфа-синуклеина [37]. Такой механизм препарата может быть полезен на ранних стадиях Б.П. Важно отметить, что некоторые противопаркинсонические препараты, доказавшие высокую эффективность, обладают противовоспалительным эффектом [38, 39]. Так, агонист Д3-дофаминовых рецепторов прамипексол в экспериментальной модели аутоиммунного энцефаломиелита проявил выраженные противовоспалительные свойства, блокируя воспаление в спинном и головном мозге, снижая выраженность демиелинизации, продукции воспалительных цитокинов IL-17, IL-1β и TNF-α [40].
Кроме того, снижение уровня витамина D3 является фактором риска развития как РС, так и БП [41]. При обследовании 478 пациентов с БП и 431 здорового из контрольной группы выявили, что дефицит витамина D (содержание в крови менее 20 нг/мл) и даже его незначительное снижение (содержание в крови менее 30 нг/мл) повышают риск развития БП в 2,6 и 2,1 раза соответственно (р
<0,0001). Известно, что 1,25-дигидроксивитамин D3 дозозависимым образом тормозит экспрессию индуцибельной изоформы синтазы оксида азота и тем самым также проявляет противовоспалительный эффект.
Стресс эндоплазматического ретикулума и дисфункция митохондрий играют особую роль в прогрессировании нейродегенеративных заболеваний. Стресс эндоплазматического ретикулума способствует появлению белков с неправильным конформационным состоянием. При этом митохондриальные изоформы индуцибельной NO-синтазы в условиях оксидативно-нитрозативного стресса могут запускать генерацию целого каскада цитотоксических производных. В этой ситуации пристальное внимание привлекают митохондрий-таргетированные ингибиторы идуцибельной NO-синтазы, к числу которых можно отнести мелатонин, подавляющий экспрессию и активность индуцибельной митохондриальной NO-синтазы, а также, по-видимому, ингибирующий мобилизацию ионов кальция из внутриклеточных депо. По мнению некоторых исследователей [42, 43], расшифровка механизмов конформации и последующее распространение альфа-синуклеина при обязательном нарушении обмена железа являются двумя главными ключами в открытии причин БП.
Исходя из представлений о том, что при нейродегенеративных заболеваниях наиболее значимым источником прооксидантов и критически важной мишенью их повреждающего действия являются митохондрии, активность которых стимулируется ионами кальция, железа, эффективными направлениями метаболической терапии представляются:
— поддержание кальциевого гомеостаза в клетке блокаторами глутаматных NMDA-рецепторов (мемантин, амантадин);
— блокирование продукции и детоксикация прооксидантов в митохондриях (мелатонин, липоевая кислота, мексидол, витамин D3). Потенциально положительные эффекты мексидола (эмоксипина сукцинат) могут быть ассоциированы именно с железохелатирующим действием фосфорилированных и нефосфорилированных производных эмоксипина [44];
— ингибирование форсирования митохондриальной транзитной проницаемости (мелатонин, мемантин) [45];
— подавление стресса эндоплазматического ретикулума (зонизамид) [46].
Предложенные ранее терапевтические подходы являются неселективными к определенным нозологическим формам нейродегенеративных заболеваний, не имеют специфической точки приложения к определенному белку, нарушение конформации которого вызывает болезнь. В последнее время сформулированная концепция конформационных заболеваний предполагает вклад определенного белка или нескольких белков в инициацию и прогрессирование болезни [47]. Но и здесь мы сталкиваемся с наличием сочетаний нескольких вариантов белок-ассоциированной нейропатологии. Так, при БП обнаруживаются не только внутриклеточная аккумуляция альфа-синуклеина, но и бета-амилоида. Кроме того, течение болезни при этом носит неблагоприятный характер с развитием деменции, постуральной неустойчивости, застываний и падений, что требует дифференциальной диагностики с деменцией с тельцами Леви (болезнь диффузных телец Леви) и сближает их клиническую картину [48, 49]. Опубликованные в 2021 г. данные ПЭТ с радиолигандом, меченным на бета-амилоид, у пациентов с ранними стадиями БП (до III стадии по Хен—Яру) и на поздних (от III стадии по Хен—Яру) показали достоверное увеличение накопления бета-амилоида в коре, начиная с III стадии. Таким образом, кортикальное накопление бета-амилоида может быть определяющим фактором развития перехода от ранних к поздним стадиям болезни [50].
Концепция нейротоксичности бета-амилоида и его роли в прогрессировании БА могла быть отклонена, если бы не последнее исследование с моноклональными антителами [51], результаты которого позволили вновь приобрести надежду всем исследователям и родственникам больных, столкнувшимся с этим заболеванием. С 2012 по 2014 г. в США проведено испытание нового препарата, представляющего собой моноклональные антитела к бета-амилоиду, у 163 больных БА на начальных стадиях заболевания. Всем больным выполняли ПЭТ с радиолигандом, способным метить накопление амилоида в головном мозге. Ежемесячно больным вводили инфузии адуканумаба в разных дозах (1, 3, 6 или 10 мг на 1 кг массы тела). Результаты оценивали на 26-й и 54-й неделях лечения. Результаты показали, что у пациентов, получавших максимальную дозу адуканумаба в течение года, отмечено существенное снижение количества амилоидных бляшек в головном мозге с одновременным прекращением прогрессирования нарушения когнитивных функций по краткой шкале оценки психического статуса (Mini-Mental State Examination — MMSE). При этом показатели пациентов из группы плацебо продолжали прогрессирующе ухудшаться.
Аналогичные подходы апробируются и при БП. В экспериментальной модели паркинсонизма было установлено, что антитела к С-терминалям альфа-синуклеина блокируют транссинаптическое распространение патологического белка в ЦНС [52]. В настоящее время в мире проходят клинические исследования по оценке эффективности пассивной и активной иммунизации против альфа-синуклеина у пациентов с БП, результаты которых позволят получить подтверждение о решающей роли транссинаптического распространения патологических форм белка синуклеина в патогенезе Б.П. Однако следует учитывать варианты заболевания, при которых имеется синергизм или сочетание как минимум двух вариантов протеинопатии (бета-амилоид и альфа-синуклеин). В таких случаях, вероятно, необходимо рассматривать двойную терапию моноклональными антителами, влияющую на амилоидогенез и синуклеинопатию.
Таким образом, становится очевидно, что агенты, провоцирующие воспаление, могут способствовать развитию хронических прогрессирующих заболеваний нервной системы и являться триггерами нейродегенерации. На этапе инициации патологического процесса его развитие определяется не специфичностью провоцирующего агента (не принципиально, какой именно это вирус или бактерия), а его способностью длительно персистировать в организме и вызывать хроническое воспаление низкой интенсивности. Снижение инфекционной нагрузки на организм за счет элиминации бактерий и подавления репликации вирусов обеспечит уменьшение риска как дегенеративных, так и сосудистых заболеваний нервной системы. Следует исключить применение так популярных в нашей стране неселективных иммуностимуляторов, особенно бактериальных липополисахаридов (пирогенал), у лиц с высоким риском развития нейродегенеративных заболеваний и тем более у пациентов с наличием таких заболеваний. Разработка направлений, влияющих на воспалительный процесс в целом, устранение дисбиотических изменений в ЖКТ, подавление целого ряда сопряженных метаболических сдвигов создадут основу развития профилактики нейродегенеративных заболеваний и замедление темпов их прогрессирования. Решение вопросов терапии узконаправленными моноклональными антителами, в зависимости от вида протеинопатии, должно проводиться, вероятно, параллельно на ранних стадиях заболеваний.
Понимание точных механизмов дегенерации позволит снизить инвалидизацию при прогрессирующих заболеваниях головного мозга. Последние успехи в лечении БА связаны с селективным иммунологическим направлением терапии, а недавние исследования указывают, что при РС могут быть полезными препараты с метаболическим и антиоксидантным механизмами действия [7, 53]. Таким образом, все время придется решать вопрос, что первично — воспаление или дегенерация. Эта ситуация напоминает вопрос о курице или яйце. Но при применении современных лабораторных и инструментальных биомаркеров такая диагностика становится все более точной. И, самое главное, это позволит выделить ведущее звено патогенеза при этих заболеваниях и назначить обоснованную терапию.
Авторы заявляют об отсутствии конфликта интересов.