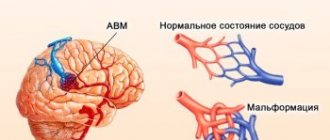
Представляют собой плотный клубок расширенных сосудов, в котором вены контактируют с артериями без участия капиллярной сети ввиду ее отсутствия. В результате отклонения, артериальная кровь шунтируется в систему глубоких и поверхностных вен без отдачи питательных веществ и выведения углекислого газа. Размеры сосудистых мальформаций могут быть как малыми, так и огромными.
Причины нарушения не выяснены до конца, однако считается, что оно не связано с наследственностью. Симптоматика бывает размытой и неспецифичной, вследствие чего АВМ обнаруживается при проведении КТ / МРТ головного или спинного мозга по стороннему поводу (например, при инсульте или травме). Механизмы и последствия влияния АВМ на жизнедеятельность человека непредсказуемы, поэтому заболевание требует адекватного лечения.
Причины сосудистых мальформаций
Сосудистая мальформация является врожденным дефектом строения сосудов центральной нервной системы. Имеет корреляцию с нарушениями внутриутробного развития плода и родовыми травмами, однако конкретные провоцирующие факторы данного явления не выяснены.
Местные аномалии формирования артерий и вен мозга происходят у эмбриона не позднее 1-2 месяца беременности.
Прямой взаимосвязи между наличием данной аномалии, а также возрастом или полом пациента, на сегодняшний день не обнаружено.
Симптоматика и клиническая картина
АВМ может не давать о себе знать на протяжении долгих лет, поэтому пациенты часто узнают о своем диагнозе случайно, проходя диагностические мероприятия по смежным поводам. Мальформации, увеличивающиеся в объеме, могут оказывать избыточное давление на мозг, и лишь в этом случае проявляются неврологические (очаговые) симптомы.
Клиническая картина нарушения неспецифична, поэтому требует углубленной дифференциальной диагностики.
В обычной жизни АВМ могут проявлять себя в следующих признаках:
• Внутричерепная гипертензия с характерным болевым синдромом давящего или пульсирующего характера;
• Вялость, апатия, снижение работоспособности;
• Расстройство координации движений;
• Видимое снижение интеллектуальных способностей;
• Моторная афазия и иные речевые нарушения;
• Подавление иннервации отдельных участков тела;
• Шаткость походки и внезапные падения (зачастую на спину или бок);
• Мышечная гипотония и судорожные приступы;
• Нарушения зрения (косоглазие, выпадение полей зрения, частичная или полная слепота);
• Эпилептические припадки разной длительности и интенсивности;
• Парезы конечностей.
Симптомы заболевания полностью зависимы от локализации мальформации (лобная или височная доля, мозжечок, основание головного мозга, спинной мозг).
Разрыв патологически измененных сосудистых клубков также влечет за собой определенные острые проявления. Это осложнение приводит к внутреннему кровотечению в головной или спинной мозг, сопряженному с внезапным нарушением их кровоснабжения. При субарахноидальном кровоизлиянии и образовании гематомы в мозге, проявления патологии становятся различимыми.
Больной может жаловаться на следующие симптомы:
• Резкий и внезапный приступ сильнейшей головной боли;
• Тошнота и интенсивная рвота без объективных причин (извержение желудочного содержимого при этом не приносит облегчения);
• Синкопальное состояние;
• Светобоязнь (боли в глазных яблоках при взгляде на источник света или нахождении в освещенном помещении);
• Обездвиженность глаз и нарушения зрения вплоть до полной его утраты;
• Нарушения экспрессивной и импрессивной речи (больной произносит нечленораздельные звуки и обрывки фраз, не воспринимает информацию из сторонних уст);
• Судорожные припадки;
• Паралич конечностей.
Если вы или ваши близкие столкнулись с приведенными клиническими проявлениями патологии, в неотложном порядке обращайтесь за профессиональной помощью.
Результаты
Из 223 больных с АВМ больших полушарий головного мозга мальформации в пределах одной доли локализовались у 151 ребенка (преобладало поражение лобной и височной долей), поражение смежных долей выявлено у 72 больных. АВМ I типа по SM отмечены у 52 (24%) больных, II типа — у 83 (39%), III типа — у 63 ( 29%), IV типа — у 9 (4%), V типа — у 7 (3,35%). У 9 детей были АВМ фистульного типа.
В группе больных с АВМ глубинных структур головного мозга (77 детей) наиболее часто мальформации локализовались в области мозолистого тела — 23 ребенка, в подкорковых узлах — 22, в зрительном бугре — 19, АВМ сосудистого сплетения были у 13 детей. Среди них маленькие АВМ (до 2,5 см) отмечены у 46 (60,5%) детей, средние (2,5-5 см) — у 22 (29%) и большие (5 см и более) — у 8 (10,5%) больных. У 1 ребенка выявлялась АВМ фистульного типа в области подкорковых узлов.
Поражение правого полушария отмечено в 49,3% случаев, левого — в 44,2%.
Связи между размерами мальформации, особенностями ангиоархитектоники и возрастом детей выявлено не было.
Клинические проявления
При сравнении двух групп больных с АВМ — полушарной (1-я группа) и глубинной локализации (2-я группа) отмечено, что у детей 2-й группы внутричерепные кровоизлияния наблюдались чаще (83,0%) , чем у больных 1-й группы (66,4%). При АВМ глубинной локализации в 20% наблюдались внутрижелудочковые кровоизлияния, нередко с гемотампонадой желудочковой системы. Внутрижелудочковые кровоизлияния при АВМ полушарной локализации отмечены в 6% случаев. Повторные кровоизлияния при АВМ глубинной локализации возникали в 2 раза чаще, чем у больных 1-й группы — 10,4 и 4,6% соответственно и протекали более тяжело. Сроки повторных кровоизлияний в обеих группах варьировали от нескольких часов до нескольких лет. Общая тенденция характеризовалась более частой угрозой кровоизлияния при АВМ небольших размеров в обеих группах (табл. 1).
В большинстве наблюдений внутримозговое кровоизлияние возникало внезапно. Провоцирующими факторами были физическая или эмоциональная нагрузка, легкая черепно-мозговая травма. Для внутричерепных кровоизлияний при АВМ глубинной локализации было характерно возникновение внезапной головной боли с тошнотой и рвотой, снижением уровня сознания, выраженными менингеальными симптомами, гипертермией. У детей младшей возрастной группы в большинстве случаев кровоизлияние протекало стерто, периоды кратковременной головной боли чередовались с периодами психомоторного возбуждения, многократной рвотой, что больше напоминало симптомы острой кишечной инфекции.
Сочетание субарахноидально-паренхиматозного кровоизлияния с внутрижелудочковым значительно ухудшало прогноз заболевания. Однако даже при массивном внутрижелудочковом кровоизлиянии состояние ребенка могло оставаться стабильно средней тяжести и лишь при повторных кровоизлияниях оно прогрессивно ухудшалось.
У части больных имелись эпилептические припадки [24]. Частота эпилептиформного синдрома составила 21% наблюдений. При АВМ глубинной локализации этот синдром наблюдался почти в 3 раза реже. Судорожный синдром, как манифестация заболевания, был более характерен для детей младшей возрастной группы (до 7 лет). Из них у 2 больных эпилептические приступы наблюдались с первых дней жизни. Большинство мальформаций у этих детей имели большие размеры (для АВМ больших полушарий SM III-V и более 5 см для АВМ глубинных структур) и в большинстве случаев дренировались в поверхностные вены мозга. Приступы у большинства детей протекали с утратой сознания и генерализованными судорогами, имели тенденцию к учащению, плохо поддавались медикаментозной коррекции.
Сочетание внутричерепного кровоизлияния с эпилептическими приступами при АВМ больших полушарий головного мозга выявлено в 4,6%, при АВМ глубинных структур головного мозга — в 1,3% наблюдений.
Цефалгический синдром характеризовался постоянной головной болью, усиливающейся при физическом или психическом напряжении, либо приступообразными болями. В большинстве случаев боли плохо купировались обезболивающими препаратами. Цефалгический синдром был более характерен для АВМ больших полушарий головного мозга (5,5%), особенно при локализации мальформации в затылочной области.
Методы лечения
Микрохирургическое иссечение АВМ.
Иссечение АВМ микрохирургическим методом произведено 84 больным в возрасте от 4 до 18 лет. АВМ больших полушарий головного мозга, которые соответствовали вариантам по SM I-III, имели 73 ребенка. У 70 (94%) пациентов с АВМ данной локализации заболевание проявилось СИК, у 2 (4%) детей — фармакорезистентными эпилептическими приступами и в 1 (1%) наблюдении отмечался цефалгический синдром; 11 детей были с мальформациями глубинных структур головного мозга размерами до 2,5 см, в 100% проявившихся СИК.
При поступлении у детей выявлялась следующая неврологическая симптоматика: пирамидные нарушения — у 18 (21%) детей; речевые нарушения по типу сенсомоторной афазии — у 5 (6%) больных; поражение черепно-мозговых нервов (наиболее часто недостаточность III и VII пар) — у 4 (5%) и 7 (8%) детей соответственно. У 15 (18%) пациентов с АВМ затылочной области и задних отделов таламуса выявлялись нарушения полей зрения по типу гомонимной гемианопсии.
Показаниями к данному методу лечения явились: 1) возможность тотального иссечения АВМ; 2) локализация АВМ вне функционально важных зон мозга.
Проведено 87 операций. В 82 наблюдениях (по данным протоколов операций) достигнуто тотальное иссечение мальформации, частичное — в 5 случаях. В последней группе у 3 больных это подтверждено при послеоперационном ангиографическом контроле. У 2 детей были повторные внутричерепные кровоизлияния: в 1 наблюдении через 5 мес после операции, в другом — через 1 год.
В послеоперационном периоде можно было отметить следующую динамику неврологической симптоматики: к моменту выписки из клиники у детей с двигательными нарушениями отмечались улучшения функций паретичных конечностей в 7 (39%) наблюдениях, преимущественно у детей дошкольного и младшего школьного возраста. В 4 (22%) наблюдениях отмечалось нарастание двигательных расстройств, что было характерно для больных старше 15 лет. У 6 (33%) детей динамики не отмечалось. У 3 пациентов регрессировали речевые нарушения. Изменения полей зрения и поражения черепно-мозговых нервов носили стойкий характер.
В послеоперационном периоде у 12 (29%) детей, поступивших без неврологического дефицита, отмечалось нарастание очаговой симптоматики в виде гемипарезов у 4 детей и нарушений полей зрения — у 8.
Пример тотального иссечения АВМ представлен на рис. 3.
Рисунок 3. Больной Ш., 10 лет. АВМ левой теменной области. Ангиограммы: А и Б — до операции; В и Г — после операции (иссечение АВМ).
Эндоваскулярная эмболизация.
Проведено 85 эндоваскулярных операций 64 детям в возрасте от 3 мес до 18 лет. С АВМ больших полушарий головного мозга были 55 детей, с АВМ глубинных структур — 9. Большинство АВМ больших полушарий головного мозга соответствовали SM I-III. Среди АВМ глубинных структур преобладали мальформации до 2,5 см.
В данной группе больных также преобладали дети, перенесшие СИК, — 34 (53%) больных. Следует отметить, что в данной группе по сравнению с группой больных, которым проводилось иссечение АВМ, преобладали дети с фармакорезистентными эпилептическими приступами — 25 (40%) больных. С цефалгическим синдромом были 5 (8%) больных.
Клиническая симптоматика была представлена пирамидными нарушениями у 3 (5%) детей, нарушениями полей зрения по типу гомонимной гемианопсии — у 3 (5%) детей и нарушением функции VI пары черепно-мозговых нервов — у 2 больных.
Показаниями к эндоваскулярным операциям были: 1) паллиативный метод при АВМ больших размеров, проявившихся фармакорезистентными эпилептическими приступами; 2) АВМ фистульного типа; 3) АВМ, расположенные в функционально значимых зонах мозга, проявившиеся СИК; 4) наличие доступных для катетеризации афферентных сосудов.
В 1 этап эмболизация проведена 34 больным, в 2 этапа — 24, в 3 этапа — 1. Ангиографически подтвержденная тотальная облитерация АВМ была достигнута у 27 (32%) детей, субтотальная — у 12 (14%), частичная — у 15 (18%) больных. Пример тотальной эмболизации представлен на рис. 4.
Рисунок 4. Больная С., 14 лет. АВМ задних отделов левой височной области. Ангиограммы: А и Б — до операции; В и Г — после операции (тотальная эмболизация гистоакрилом).
В послеоперационном периоде не отмечалось ни положительной, ни отрицательной динамики имевшихся до операции симптомов. У 6 детей, ранее не имевших неврологической симптоматики, транзиторный дефицит в виде моторной афазии наблюдался у 2 детей, стойкие нарушения в виде гомонимной гемианопсии — у 4 пациентов.
Обращала на себя внимание динамика эпилептиформного синдрома. После эндоваскулярных операций и при адекватной противосудорожной терапии у 12 (48%) детей отмечалось уменьшение количества приступов до 1-2 в мес; у 6 (24%) детей выявлено изменение характера припадков; в 4 (16%) наблюдениях отмечалось исчезновение приступов. У 1 (4%) ребенка отмечалось резкое нарастание частоты эпилептических приступов, и у 2 (8%) детей динамики эпилептиформного синдрома не было.
Особую группу составили дети с фистульными АВМ — 10 больных. Всем больным проведено эндоваскулярное лечение. У 3 больных достигнуто тотальное выключение АВМ из кровотока (рис. 5), в 7 наблюдениях — субтотальное.
Рисунок 5. Больная Б., 15 лет. Фистульная АВМ правой височной области. Ангиограммы: А и Б — до операции; В и Г — после операции (эмболизация гистоакрилом).
Радиохирургическое лечение.
Стереотаксическая радиохирургия (СТРХ) проведена 77 детям. Возраст больных от 4 до 18 лет. В данной группе больных имелись возрастные ограничения — лечение было показано только детям старше 3-летнего возраста. С АВМ больших полушарий головного мозга были 37 детей, с АВМ глубинных структур — 40. Размеры АВМ не превышали 3 см. При мальформации более 3 см применялось радиотерапевтическое лечение. Больные находились в клинически стабильном состоянии.
У большинства детей заболевание проявилось СИК — 32 (86%) больных с АВМ больших полушарий головного мозга и 38 (95%) пациентов с АВМ глубинных структур. Значительно меньше было детей с фармакорезистентными эпилептическими приступами. Следует отметить, что в данную группу вошли больные с ранее неоперабельными АВМ, т.е. те больные, которым было невозможно провести иссечение либо эмболизацию мальформации.
Показаниями к радиохирургии являлись: 1) глубинно расположенные мальформации; 2) если риск эндоваскулярной операции или прямого хирургического вмешательства превышал риск повторного кровоизлияния.
Проведен анализ результатов радиохирургического лечения 14 детей в сроки от 6 мес до 4 лет. По данным контрольной МРТ через 2-2,4 года у 7 детей отмечалась тотальная облитерация АВМ, однако по данным контрольного ангиографического исследования это подтвердилось только у 4 детей, у 1 пациента выявлено уменьшение АВМ и у 2 больных АВМ функционирует в полном объеме. У 7 детей по данным МРТ выявляется наличие функционирующей АВМ.
Комбинированное лечение.
Комбинированное лечение проведено 42 детям в возрасте от 7 до 18 лет. Детей с АВМ больших полушарий головного мозга было 34, с АВМ глубинных структур — 8. Большинство мальформаций отнесены к SM II-III типа. У 29 (80%) детей этой группы заболевание началось с СИК, у 7 (20%) отмечались фармакорезистентные эпилептические приступы. Среди глубинных АВМ были мальформации от 2,5 до 5 см, у всех детей проявившиеся СИК.
При обследовании только у 2 детей выявлена пирамидная симптоматика, остальные дети были без неврологического дефицита.
Показанием к комбинированному методу лечения явилась невозможность тотальной эмболизации или тотального иссечения АВМ.
У 36 детей комбинированное лечение проводилось в виде эмболизации с последующей радиохирургией (рис. 6); 4 детям выполнена эмболизация с последующим иссечением АВМ и 2 больным на первом этапе проводилось иссечение АВМ, а на втором — радиохирургия.
Рисунок 6. Больная К., 15 лет. АВМ правой затылочной области. Ангиограммы: А и Б — до операции; В и Г — после частичной эмболизации гистоакрилом (перед радиохирургией); Д и Е — через 3 года после радиохирургии (тотальная облитерация АВМ).
В послеоперационном периоде у 1 ребенка возник стойкий гемипарез после первого этапа лечения (эмболизации АВМ).
Скончались 2 больных. Ребенок 7 лет с АВМ левой затылочной доли умер от повторного интракраниального кровоизлияния во время второго этапа эндоваскулярной операции. Девочка 8 лет скончалась в результате интраоперационного кровоизлияния из АВМ правой затылочной области. Общая послеоперационная летальность составила 0,7%.
Отдаленные результаты хирургического лечения
Отдаленные результаты лечения оценены у 73 (27%) детей с АВМ головного мозга после применения различных методов лечения АВМ: с АВМ больших полушарий головного мозга — 57 детей, с АВМ глубинных структур головного мозга — 16. Сроки наблюдения составили от 3 мес до 15 лет.
Проведен анализ отдаленных результатов лечения 22 больных после эндоваскулярных операций. По RS отличные результаты (0-я степень) выявлены у 5 детей, хороший результат (1-2-я степень) — у 10 больных, удовлетворительный (3-4-я степень) — у 5, плохой (5-я степень) — у 2 детей.
Повторные внутричерепные СИК отмечены у 2 детей через 7 лет. Однако они протекали без выраженного неврологического дефицита.
Изучен катамнез 25 детей после иссечения АВМ. В данной группе детей отличные и хорошие результаты наблюдались у всех больных (0-3-я степень по RS). Важно отметить, что 4 больных создали семьи, у 2 из них родились здоровые дети.
У 14 больных проанализированы отдаленные результаты после радиохирургии. Можно отметить, что отличный результат (0-я степень по RS) выявлен у 4 детей, хороший (1-2-я степень по RS) — у 6 больных, удовлетворительный (3-4-я степень по RS) — у 4 пациентов.
Проанализированы результаты комбинированного лечения АВМ у 12 больных. Все детям первым этапом проводилась субтотальная или частичная эмболизация АВМ; 8 детям вторым этапом проводилась радиохирургия, в 4 наблюдениях — иссечение мальформации. В сроки от 2,6 до 3,5 лет 4 детям проведена церебральная ангиография, подтвердившая тотальную облитерацию АВМ. У остальных больных говорить о функционирующей мальформации можно было только по данным МРТ. В данной группе больных отмечены отличные и хорошие результаты в отдаленном периоде (0-3-я степень по RS).
В отдаленном периоде скончались 3 (1%) детей: 2 больных от повторных внутричерепных кровоизлияний, и в 1 наблюдении (ребенок 7 мес с множественными АВМ) причиной смерти явились осложнения после перенесенного ОРВИ (табл. 2).
Группа неоперированных больных
Операции не проводились30 детям в возрасте от 1 года до 18 лет. В данной группе с АВМ больших полушарий головного мозга были 23 больных. Следует подчеркнуть, что у этих детей преобладали мальформации крупных и гигантских размеров — SM IV-V. Глубинно расположенными АВМ были у 7 больных. В этой группе преобладали гигантские АВМ — более 5 см.
У 15 больных (без СИК) оперативное вмешательство не требовалось, так как клинические симптомы либо отсутствовали, либо были минимальными, а АВМ диагностированы после проведения МРТ в виде случайной находки. У 10 больных АВМ были признаны неоперабельными из-за больших размеров и локализации в функционально важных зонах. В 5 наблюдениях родители детей отказались от предложенных операций.
Катамнез прослежен у 7 неоперированных больных. Сроки наблюдения составили от 6 мес до 15 лет. У 2 больных отмечалось учащение эпилептических приступов, но после проведенной коррекции противосудорожными препаратами приступы прекратились. У 5 больных в настоящее время нет нарастания неврологической симптоматики; дети адаптированы социально и в быту. Лишь у 1 ребенка с сочетанной патологией сосудов головного мозга (АВМ SM V, гипоплазия позвоночных артерий) сохраняется эпилептиформный синдром, резистентный к противосудорожной терапии, с грубой задержкой психомоторного развития. Важно отметить, что у больных данной группы за период наблюдения не было внутричерепных кровоизлияний.
Дифференциальная диагностика АВМ
Лучшие специалисты отделения сосудистой хирургии в нашем центре организуют оптимальные диагностические мероприятия, позволяющие распознать заболевание в любой форме. Дифференциальная диагностика в нашем отделении выполняется соответственно высшим медицинским стандартам.
Сосудистые мальформации определяются при помощи таких исследований:
1. Оценка текущего состояния пациента, анализ его жалоб, углубленное изучение анамнеза;
2. Первичный неврологический осмотр, в ходе которого выявляются признаки конкретного местоположения АВМ в соответствии с клинической картиной поражения определенных участков головного или спинного мозга;
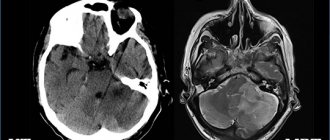
3. Компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), позволяющие послойно изучить структуру мозга, наглядно увидеть местоположение АВМ и ее объем, оценить общее состояние исследуемого органа;
4. Ультразвуковая допплерография, дающая возможность наблюдать пространственное положение кровеносных сосудов в пораженной области в режиме реального времени, а также дифференцировать патологию с иными видоизменениями их анатомической структуры;
5. Ангиография, выполняемая при помощи контрастного вещества, которое вводится в сосудистое русло; помогает оценить состояние вен и артерий с помощью рентгеновского снимка.
При затруднении в постановке диагноза, вам может потребоваться дополнительная консультация невролога и нейрохирурга. Обычно сосудистая мальформация (если она имеется у пациента) диагностируется сразу.
Ишемические поражения головного мозга
Основной причиной ишемического инсульта является снижение мозгового кровотока вследствие стенозирующих и окклюзивных поражений магистральных сосудов шеи и артерий головного мозга.
В развитии ишемического инсульта (инфаркта мозга) важная роль принадлежит закупорке мозговых сосудов микротромбами, которые образуются вследствие отрыва атеросклеротических бляшек и перемещения их по сосудам.
К основным этиологическим факторам, ведущим к поражению как внечерепных, так и внутричерепных сосудов, относятся атеросклероз, гипертоническая болезнь, ревматизм. Значительно реже причиной нарушения проходимости сонных артерий становятся рубцовые травматические и воспалительные внесосудистые поражения, фиброзно-мышечные дисплазии, возникшие в результате лучевой терапии, а также патологические изгибы сосудов.
Клиническая картина при инфаркте мозга зависит от локализации очага поражения, а выраженность и устойчивость симптомов — от размеров и состояния коллатеральных систем. Для тромбоза внутренней сонной артерии характерны снижение остроты зрения или слепота на стороне поражения и гемипарез либо гемиплегия на противоположной стороне. При стенозе артерии эти расстройства могут быть временными,
Методы лечения заболевания
Полноценная терапия больных с сосудистыми мальформациями требует возможности проведения основных вариантов лечения – эмболизации, радиохирургического и хирургического. Тактика подбирается опытным специалистом. При этом оценивается потенциальный риск осложнений от выбранного способа терапии в соотношении с риском спонтанного прогрессирования и течения заболевания.
Лечение направлено строго на облитерацию мальформации для исключения угрозы кровоизлияний. Каким способом будет достигнута эта цель, решает специалист, основываясь на результатах диагностики, индивидуальных особенностях и возрастной категории больного.
Хирургическое лечение представляет собой довольно сложную процедуру, в ходе которой АВМ удаляется из мозга через трепанационное отверстие (механическое раскрытие черепной полости).
Радикальная экстирпация применяется в случаях крупного объема клубков АВМ.
Радиохирургическое лечение (где мальформация иссекается гамма-ножом при помощи специфических излучений) пригодно только в случае малых размеров сосудистого клубка.
Эндоваскулярный метод не является столь агрессивным и подразумевает перекрытие просвета АВМ через сосуд.
При игнорировании лечения, сосудистая мальформация может спровоцировать тяжелые осложнения:
• Кровоизлияние в головной или спинной мозг на фоне разрыва очага АВМ;
• Стойкие двигательные расстройства (парезы конечностей и иных частей тела);
• Тяжелые неврологические нарушения.
Если лечение оказалось невозможным ввиду большого размера АВМ, следует заняться профилактикой ее разрыва.
Список литературы
1. Астахова Л.С. Клиника и диагностика внутричерепных артериовенозных мальформаций и аневризм у детей и подростков: Автореф. дис. канд . мед. наук. СПб,1995. 2. Белоусова О.Б. , Филатов Ю.М., Сазонова О.Б. и др. Ш съезд нейрохирургов России: Материалы съезда. СПб., 2002. С. 303-3-4. 3. Вознесенская Н.Н., Свистов Д.В., Максимец В.А. и др. III съезд нейрохирургов России: Материалы съезда СПб., 2002. С. 310-311. 4. Дзяк Л.А. Артериальные аневризмы и артериовенозные мальформации головного мозга. 2003. 5. Загородний В., Щеглов В. Особенности артериовенозных мальформаций головного мозга у детей. Материалы 4 съезда нейрохирургов России. М., 2006. С.261. 6. Зубков Ю.Н., Хилько В.А., Янкин В.Ф. Внутрисосудистая нейрохирургия. М.: Медицина, 1982. С. 200. 7. Злотник Э.И., Набежко И.И. Вопросы нейрохирургии. 1977. № 2. С. 11 – 13. 8. Никитин Ю. М., Труханов А. И. Ультразвуковая допплеровская диагностика сосудистых заболеваний. – М., 1998. 9. Коновалов А.Н. Хирургическое лечение артериальных аневризм головного мозга. М.: Медицина , 1973. С. 326. 10. Крылов В.В., Ткачев В.В., Добровольский Г.Ф. Микрохирургия аневризм виллизиева многоугольника. М.: Медицина , 2004. С. 159. 11. Лебедева Б. В. Справочник по неврологии детского возраста. М. Медицина. 1995г. С. 22-23. 12. Лебедев В.В. Крылов В.В. Щелковский В.Н. Клиника, диагностика и лечение внутричерепных артериальных аневризм в остром периоде кровоизлияния. М.: Медицина, 1996. С.189. 13. Луговский А.Г., Шаверский А.В., Цимейко О.А., Вербова Л.Н. Гигантская мешотчатая аневризма бифуркацииосновной артерии Вопросы нейрохирургии. 2001. №1. С.27–28. 14. Медведев Ю.А., Забродская Ю.М. Коррективы к классификации аневризм головного мозга. 1991 г. Новая классификация. Нейрохирургия. 2001. №3. С.20–26. 15. Олешкевич Ф.В., Скороход А.А. Успешное лечение больной с гигантской аневри змой офтальмического сегмента внутренней сонной артерии. Нейрохирургия. 2005. №2. С.42–44. 16. Орлов М.Ю. Артериовенозные мальформации головного мозга у детей. Український нейрохірургі чний журнал , №1, 2007. 17. Рамешвили Т.Е., Свистов Д.В., Труфанов Г.Е., Фокин В.А. Лучевая диагностика сосудистых мальформаций и артериальных аневризм головного мозга. Второе издание. 2008. 18. Смеянович В.А., Смеянович А.Ф. Артериовенозные мальформации задней черепной ямки (диагностика, хирургическое лечение). ГУ НИИ неврологии, нейрохирургии и физиотерапии МЗ РБ, РБ ГУ ЛП СКУ УД Президента РБ, г. Минск. Материалы конференции 2002, том 2: С.179-182 19. Филатов Ю.М., Элиава М.М. Вопр. нейрохирургии. 1985. № 6. С. 19 – 27. 20. Batjer., Samson D. J. Neurosurg. 1986. Vol. 64 P. 849 – 856. 21. Giller C.A. Acta neurochir. (Wien). – 1991. – Vol.108, N1. – P. 7-14. 22. Krivoshapkin A., Golub A., Jacobson M. Proceedings Intern. Cong. On Advances in Brain Revascularization, Eilat. 1993. P.47 23. Hansen P. A., Knudsen F., Jacobsen M., Haase J., Bartholdy N. J. Neurosurg. Anesthesiol. 1995. Vol. 7, №2. Р. 117-20. 24. Morgan M. K., Day M. J., Little N., Grinnell V., Sorby W. J. Neurosurg. 1995. Vol. 82, №2.Р. 296-9. 25. Kader A., Young W. L. Neurosurg. Clin. N.Am.1996. Vol. 7, №4. Р. 767-81. 26. Miyasaka Y., Yada K., Ohwada T., Kitahara T., Endon M., Saito M., Kurata A., Ohtaka H. J. Neurosurgery. 1990. Vol. 72. P. 540-545. 27. Hademenos G. J., Massoud T. F., Stroke. 1996. Vol. 27. P. 1072-83. 28. Sekhon L. H. S., Morgan M. K., Spence I. J. Neurosurg. 1997. Vol. 86, N 3. P. 519-524.
Коллектив авторов: Кудакова А. М., Литвинов Н. И., Каленова И. Е., Казанцева И.В., Зубанов А.Г.