Почему не действует антидепрессант? Типичные ошибки.
Что такое антидепрессанты?
Антидепрессанты нового поколения – это особая группа психотропных средств, которые никогда и ни при каких условиях не вызывают ни медикаментозной зависимости (данный риск существует только при неправильном использовании транквилизаторов), ни длительной заторможенности, эмоциональной уплощенности или снижения ясности сознания, памяти, внимания, мыслительной активности (данные негативные эффекты возможны при использовании нейролептиков и трициклических антидепрессантов прошлого поколения). Подавляющее большинство невротических психоэмоциональных расстройств, с которыми обращаются к врачу-психотерапевту, успешно лечатся одним грамотно назначенным антидепрессантом. Причиной неудач, как показывает практика, является не сам препарат, а ошибки, допущенные при его применении.
Что такое антидепрессанты нового поколения?
Антидепрессанты нового поколения, или серотонин-селективные антидепрессанты, относятся к группе СИОЗС – селективных ингибиторов обратного захвата серотонина. Они идеально переносятся, не имеют кардио-, нефро- и гепатотоксичных эффектов, т.е. не оказывают негативного влияния на печень, почки, сердце и прочие органы, многие из них широко применяются в детском и пожилом возрасте, при сопутствующих физических заболеваниях, в постинфарктном и постинсультном периодах, в сочетании с другими лечебными средствами. В западных странах современные антидепрессанты все чаще позиционируют, как препараты, повышающие качество жизни, поскольку они позволяют длительно и стабильно сохранять чувство внутреннего комфорта, устойчивость к стрессам и позитивный жизненный настрой.
Как действует антидепрессант?
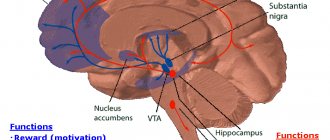
Упрощенно говоря, эффект антидепрессанта проявляется тем, что мозг выходит из стрессового режима функционирования — снижается тревожность, снимается внутреннее напряжение, улучшается настроение, проходят раздражительность и нервозность, нормализуется ночной сон, стабилизируется вегетативная нервная система — например, прекращаются сердцебиения, головокружения, головная боль, колебания артериального давления, эмоционально обусловленные расстройства желудка, кишечника и пр. Это достигается восстановлением должной работы нейромедиаторов головного мозга — серотонина, норадреналина, дофамина и других белковых молекул, обеспечивающих передачу электрических импульсов между нейронами. На это требуется время, поэтому эффект современных антидепрессантов развивается очень постепенно, проявляя себя не раньше 3-5 недели от начала приема препарата. Полный окончательный эффект в высокой степени зависит от: 1) правильного выбора препарата, 2) правильного подбора дозировки, 3) правильно определенной длительности лечения; 4) правильной отмены. Нарушение даже одного из пунктов способно привести к неэффективности всего лечения, и подобные случаи широко обсуждаются пациентами, неоправданно считающими причиной неудачи сам препарат.
Как правильно принимать антидепрессант?
Лечение антидепрессантами складывается из двух основных этапов:
1) основного, за время которого должны пройти все симптомы депрессии, тревожного невроза или вегетативной дисфункции (применение антидепрессанта вовсе не означает, что проблемой пациента является именно или только депрессия);
2) поддерживающего, профилактического (или контрольного), на протяжении которого совершенно необходимо продолжать лечение при полном отсутствии симптомов и идеальном самочувствии пациента. Причем только при таком условии поддерживающее лечение и имеет смысл, в противном случае выбор препарата и/или его дозировки необходимо пересматривать.
Таким образом, если полный эффект отсутствует на первом этапе лечения, то продолжать его в поддерживающем режиме бессмысленно и не правильно, так как это может стать причиной снижения восприимчивости организма к действию препарата (резистентности, толерантности) и его дальнейшей неэффективности.
Сколько времени нужно принимать антидепрессант?
При грамотном подходе для составления окончательного плана терапии обычно требуется всего 2-3 консультации врача-психотерапевта в первые 2-3 месяца лечения. Основной период лечения до устранения всех симптомов психоэмоционального расстройства обычно занимает 2-5 месяцев. После этого терапия ни в коем случае не прекращается, а переходит на поддерживающий этап, который при отсутствии внешних отягчающих факторов (не прекращающиеся или новые непредвиденные эмоциональные стрессы, эндокринные расстройства, соматические заболевания и т.п.) обычно составляет 6-12 месяцев, в гораздо более редких, но требующих того случаев – может длиться годами.
Данную ситуацию уместно сравнить, например, с лечением гипертонической болезни, когда необходим длительный или даже постоянный прием препарата, нормализующего артериальное давление. Никому в голову не придет мысль, что гипертоник «подсел» или «привык» к препарату, позволяющему ему жить с нормальным артериальным давлением, все понимают, что длительное лечение необходимо исходя из особенностей заболевания. Однако даже это преувеличение: курс приема антидепрессанта в подавляющем большинстве случаев лишь длительный, а не пожизненный.
Еще раз подчеркну, что продолжительный курс лечения антидепрессантом имеет смысл никак не в ожидании результата, а уже после его достижения, т.е. проводится при идеальном самочувствии пациента.
Когда можно отменять антидепрессант?
Прекращение лечения антидепрессантом, так же как и его начало, обязательно должно быть согласовано с лечащим врачом и производится не столько по медицинским (тем более, дата отмены не определяется каким-либо календарным сроком), сколько по социально-психологическим показаниям, т.е. тогда, когда положительные изменения стабильно проявят себя не только в самочувствии пациента, но и положительно отразятся на событиях его жизни, например, приведут к реальному выходу из той негативной психотравмирующей ситуации, в которой возник невроз.
Как правильно отменять антидепрессант?
Отмена антидепрессанта должна производиться постепенно по плану, предложенному лечащим врачом, и не должна быть резкой или внезапной, но также и чрезмерно затянутой. Чем выше была дозировка препарата, тем дольше производится отмена, но в любом случае этот период занимает не больше месяца, в противном случае создается ситуация, описанная в п.6 раздела «Синдром отмены антидепрессанта».
Во время лечения нежелательны непредвиденные перерывы (дома всегда должен быть запас из 1-2 упаковок), т.к. на 3-4 день после внезапного прекращения приема антидепрессанта возможен ничем не опасный, но субъективно неприятный синдром отмены, вызванный не зависимостью или привыканием к препарату, а «неожиданным» для мозговых рецепторов прекращением его поступления в кровь, что нередко случается также при резкой отмене других лекарственных средств, не являющихся психотропными.
В случае непредвиденного перерыва в приеме антидепрессанта все проявления синдрома отмены проходят в ближайшие часы после возобновления его приема, а если прием так и не возобновится, то они полностью исчезают в течение 5-10 дней.
При грамотно спланированной отмене антидепрессанта, какой бы ни была длительность его приема, синдром отмены, если и ощущается, то не причиняет никаких серьезных неудобств. Некоторые антидепрессанты (например, флуоксетин, вортиоксетин) в подавляющем большинстве случаев вообще не вызывают синдром отмены.
Что бывает после прекращения приема антидепрессанта?
При правильном лечении после прекращения приема антидепрессанта в обозримом будущем сохраняется тот эффект, который был достигнут на основном и закреплен на поддерживающем этапах лечения.
Синдром отмены антидепрессанта
Широко обсуждаемые в народе «последствия» приема антидепрессантов (чаще всего говорят о якобы «подсаживании» на препарат или невозможности прекратить его прием из-за тяжелого «синдрома отмены») действительно могут напугать пациента в следующих случаях:
1) препарат и/или его дозировка были подобраны неверно, в результате полный лечебный эффект вообще не был достигнут, произошла лишь маскировка симптомов психоэмоционального расстройства, улучшение было частичным, самочувствие пациента стало «несколько легче», а не изменилось кардинально и качественно;
2) поддерживающее лечение проводилось при неполном лечебном эффекте, пациент не был осведомлен о том, какого результата следует добиваться, и балансировал между плохим и «приемлемым» самочувствием, от чего после отмены препарата самочувствие, естественно, снова стало устойчиво плохим;
3) поддерживающее лечение не проводилось вообще, антидепрессант был отменен сразу после достижения эффекта, т.е. явно преждевременно;
4) пациент не был предупрежден врачом о возможном временном, длящемся 5-10 дней дискомфорте (незначительные тошнота, головокружение, вялость, головная боль, нарушение сна) при отмене антидепрессанта, приняв эти ощущения за возобновление невроза (подробное описание ощущений, возникающих при синдроме отмены — см. здесь);
5) отмена препарата производилась грубо, резко, внезапно, без согласования с врачом, в результате чего пациент столкнулся с выраженным синдромом отмены, приняв его симптомы за возобновление невроза, или даже решив, что он «привык», «подсел на препарат» и переживает «ломку»;
6) отмена препарата была затянутой, производилась неоправданно долго: столкнувшись с первыми проявлениями синдрома отмены при снижении дозировки, пациент испугался и прекратил ее дальнейшее снижение (например, принимая «четвертинки», «половинки» таблетки в день или через день, или в зависимости от самочувствия на протяжении длительного времени), тем самым искусственно удерживая себя в состоянии синдрома отмены, не позволяя ему завершиться, при этом, как правило, жалуясь на крайне тяжелое «отвыкание» от препарата; в некоторых случаях такая ситуация может длиться месяцами.
Подробнее о проблемах отмены антидепрессанта
Какие именно препараты относятся к антидепрессантам нового поколения?
СИОЗС — селективные ингибиторы обратного захвата серотонина: флуоксетин (прозак, флуоксетин-ланнахер, апофлуоксетин, продеп, профлузак, флувал), флувоксамин (феварин, рокона), циталопрам (ципрамил, прам, опра, сиозам), эсциталопрам (ципралекс, лексапро, селектра, элицея, ленуксин), сертралин (золофт, асентра, стимулотон, серлифт, алевал, серената, торин), пароксетин (паксил, рексетин, адепресс, плизил, актапароксетин).
СИОЗС — селективный ингибитор обратного захвата серотонина мультимодального действия — антогонист 5-НТ3-, 5-НТ7-, 5-НТ1D-рецепторов, парциальный агонист 5-НТ1В— и агонист 5-НТ1А-рецепторов: вортиоксетин (бринтелликс).
СИОЗС — селективный ингибитор обратного захвата серотонина, парциальный агонист 5-НТ1А-рецепторов: вилазодон (виибрид). Вилазодон в РФ в настоящее время отсутствует.
СИОЗСиН — селективные ингибиторы обратного захвата серотонина и норадреналина: дулоксетин (симбалта, дулоксента), милнаципран (иксел).
СИОЗСНиД — селективный ингибитор обратного захвата серотонина, норадреналина и дофамина: венлафаксин (эффексор, велаксин, венлаксор, велафакс, ньювелонг, эфевелон).
СИОЗНиД — селективный ингибитор обратного захвата норадреналина и дофамина: бупропион (веллбутрин, зибан). Бупропион в РФ в настоящее время отсутствует.
СИОЗН — селективный ингибитор обратного захвата норадреналина: ребоксетин (эндронакс). Ребоксетин в РФ в настоящее время отсутствует.
ИОЗС — ингибиторы обратного захвата серотонина, антогонисты 5-НТ2-рецепторов: тразодон (дезирел, олептро, триттико, азона), нефазодон (серзон). Нефазодон в РФ в настоящее время отсутствует.
Тетрациклический антогонист центральных пресинаптических α2-адренорецепторов: миртазапин (ремерон, каликста, мирзатен, миртазонал).
Стимулятор мелатониновых рецепторов — агомелатин (вальдоксан).
Примечание: жирным шрифтом выделены международные названия (действующие вещества) антидепрессантов нового поколения; курсивом — торговые названия оригинальных препаратов; прочие приведенные в скобках — торговые названия некоторых дженериков/аналогов, производимых различными фармкомпаниями. Голубым фоном выделены торговые названия антидепрессантов нового поколения, продающиеся в настоящее время в аптеках РФ (строго по рецептам). Последний в списке антидепрессант — агомелатин (вальдоксан) по некоторым данным не обладает доказанной заявленной производителем эффективностью и не исключает гепатотоксичности.
Детальные механизмы мозговой активности антидепрессантов (включая, их прежние поколения), на мой взгляд, наиболее адекватно и популярно освещены в цикле видеолекций по психофармакологии Никиты Викторовича Кудряшова — доцента Первого МГМУ им. И.М. Сеченова, старшего научного сотрудника НИИ фармакологии им. В.В. Закусова:
«Базисная фармакология антидепрессантов: основы патофизиология депрессии. Часть 1. (Начало)
«Базисная фармакология классических антидепрессантов. Часть 2.«
«Базисная фармакология антидепрессантов: ингибиторы обратного захвата моноаминов. Часть 3.«
«Базисная фармакология антидепрессантов со смешанным механизмом действия. Часть 4. (Окончание)»
PsyAndNeuro.ru
Согласно номенклатуре психотропных препаратов, основанной на нейронауках, к селективным ингибиторам обратного захвата серотонина (СИОЗС) относятся 6 антидепрессантов: флуоксетин, пароксетин, сертралин, флувоксамин, циталопрам и эсциталопрам. Основной механизм антидепрессивного действия данной группы заключается в блокировании обратного захвата серотонина из синаптической щели, в результате чего увеличивается концентрация данного медиатора в ЦНС. При этом антидепрессанты группы СИОЗС практически не блокируют обратный захват норадреналина и дофамина.
СИОЗС являются наиболее популярными антидепрессантами. Несмотря на это, имеется множество особенностей данных препаратов, которые, порой, остаются в неведении врача. На основе базы по нейропсихофармакологии, мы подготовили TOP-10 самых интересных характеристик СИОЗС, которые будет полезно использовать в клинической практике:
1. Флуоксетин в комбинации с оланзапином рассматривается как довольно эффективный вариант лечения терапевтически резистентных депрессий. Кроме того, флуоксетин считается лучшим антидепрессантом для лечения атипичной депрессии и может off-label назначаться при селективном мутизме, лёгкой ажитации при деменции и даже болезни Рейно.
2. Хотя пароксетин противопоказан при беременности, большинство авторитетных рецензентов считают пароксетин одним из самых предпочтительных антидепрессантов во время грудного вскармливания.
3. Сертралин off-label может назначаться при зуде, что можно учитывать при выборе терапии депрессивных и ипохондрических расстройств с подобными жалобами.
4. Эсциталопрам, в сравнении с другими СИОЗС, имеет самое слабое воздействие на сексуальную сферу, что необходимо учитывать при наличие подобных жалоб у пациентов, выявленных ранее при применение других антидепрессантов или в силу физиологических способностей.
5. В отличии от большинства СИОЗС, способных вызывать вначале терапии диарею, пароксетини из-за своей выраженной м-холинолитической активности может вызвать запоры.
6. Сертралин считается антидепрессантом с самой доказанной кардиологической безопасностью, что необходимо учитывать при назначении терапии лицам пожилого возраста.
7. В высоких дозах сертралин способен блокировать также обратный захват дофамина, в то время как другие антидепрессанты СИОЗС в высоких дозах начинают блокировать обратный захват норадреналина. Из-за этих свойств сертралин в меньшей степени способен вызывать СИОЗС-ассоциированную апатию и ангедонию и повышать пролактин.
8. Пароксетин является препаратом выбора при лечени постинсультных депрессий из-за хорошей клинической эффективности и переносимости среди пациентов, ранее перенёсших инсульт.
9. Такие специфические побочные эффекты СИОЗС, как апатия/снижение эмоциональной реактивности и снижение либидо/задержка эякуляции, могут быть использованы в первом случае при повышенной эмоциональной лабильности и импульсивности, во втором – при преждевременной эякуляции у депрессивных пациентов.
10 Наверное, самыми известными фактами для практикующих врачей являются более выраженное седативное действие флувоксамина и пароксетина, а также более активизирующее действие флуоксетина, что можно использовать при разных подтипах депрессии. При этом флувоксамин зарегистрирован FDA только для лечения ОКР и социальной тревожности, и официально не может использоваться в США как антидепрессант.
Автор: Касьянов Е.Д.
Источник: База по нейропсихофармакологии
ПОБОЧНЫЕ ЭФФЕКТЫ АНТИДЕПРЕССАНТОВ (СИОЗС)
Наиболее часто назначаемыми антидепрессантами в настоящее время являются препараты из группы селективных ингибиторов обратного захвата серотонина(СИОЗС). Для большинства эти медикаменты безопасны и эффективны, но, как любые лекарства, они могут вызывать побочные эффекты. Согласно статистике, около 40% пациентов, принимающих антидепрессанты, испытывают и побочные эффекты, примерно в 25 % случаев они достаточно неприятные. Два из наиболее распространённых эффекта(сексуальные дисфункции и набор веса) нередко являются причиной отказа от приема этих лекарств.
Ниже перечислены 7 наиболее часто встречаемых побочных эффекта при приеме антидепрессантов, о которых пациент должны знать:
1. СОМАТИЧЕСКИЕ СИМПТОМЫ.
Когда впервые назначаются медикаменты для лечения депрессии, наиболее частыми соматическими симптомами являются головная боль, тошнота, боль в суставах, мышцах, сыпь и диарея. Эти симптомы , чаще всего , выражены незначительно и носят временный характер. Результаты проведённых клинических исследований показали, что наиболее часто встречаются тошнота и головная боль. Как правило, эти симптомы носят адаптивных характер, как правило, проходят самостоятельно, не требуя отмены препарата.
2. НАРУШЕНИЕ СНА.
Многие пациенты, когда им впервые назначают антидепрессанты, отмечают проблемы со сном: трудности с засыпанием или поверхностный сон с частыми пробуждениями. Также на фоне приёма СИОЗС могут наблюдаться кошмарные сновидения и снохождение. Проведённые исследования показали, что около 22% людей, принимающих антидепрессанты, испытывают проблемы со сном.
3. ДНЕВНАЯ СОНЛИВОСТЬ.
Сонливость в течения дня может быть результатом плохого ночного сна, или же непосредственным седативным эффектом антидепрессанта. В случае, когда это седативный эффект, проблему можно решить, перенеся приём препарата на вечернее время.
4. МИГРЕНИ
В связи с тем, что люди, склонные к депрессии, также часто страдают мигренями, нужно быть осторожными при комбинированном приеме медикаментов. Лекарства; используемые для лечения мигреней, триптаны , так же как и СИОЗСы повышают уровень серотонина в головном мозге. Если использовать эти препараты совместно, это может привести к развитию серотонинового синдрома, который проявляется в виде головной боли, учащённого сердцебиения, приливов. Обязательно нужно оговаривать с врачом, как избежать развитие серотонинового синдрома, если назначается приём препаратов обеих групп.
5. НАБОР ВЕСА.
Набор веса относится к поздним побочным эффектам при приеме антидепрессантов и это одна из наиболее частых причин отказа от дальнейшего приема или показание к смене препарата. Хорошей профилактикой этого побочного эффекта является умеренная физическая нагрузка ( например, 30-минутная тренировка через день). Вероятность набора веса также зависит от лекарственного вещества, который назначен. Согласно клиническим испытаниям, при приеме пароксетина, около 25% пациентов набирают 7% от их веса.
6. СУИЦИД.
Риск суицида на фоне приема антидепрессантов широко исследуется в настоящее время. Согласно большинству исследований, в сравнении с плацебо, приём СИОЗС или других антидепрессантов повышает вероятность суицидальных мыслей вдвое. Общий риск этого побочного эффекта при приеме антидепрессантов у подростков и взрослых составляет от 2 до 4 процентов. Одной из причин суицидов на фоне приема антидепрессантов является то, что медикаменты повышают активность, давая энергию для реализации суицидального плана. Регулярное наблюдение врача может снизить риск этого побочного эффекта.
7. СЕКСУАЛЬНАЯ ДИСФУНКЦИЯ.
Сексуальные дисфункции один из самых частых долговременных побочных эффектов от СИОЗС. Они включают снижение сексуального желания, задержка эякуляции у мужчин и невозможность достижения оргазма у женщин. До 60% людей, принимающих СИОЗС, испытывают один из этих побочных эффектов. И это те побочные эффекты, которые пациенты не готовы терпеть.
Если Вас беспокоят какие-либо побочные эффекты, обсудите их со своим доктором. Как правило, можно найти решение для любого из них. Не рекомендуется самостоятельно прекращать приём медикаментов.
Современные антидепрессанты. Обзор
На пути поиска эффективных средств от депрессии были перепробованы многие методы и вещества — от опиатов и до маляриотерапии нобелевского лауреата по медицине Юлиуса Вагнер-Яурегга [1]. Но настоящая борьба началась только с 1950-х годов. В 1952 году был изобретён ипрониазид. Вообще-то он предназначался для борьбы с туберкулёзом, но побочный эффект в виде улучшения настроения больных депрессией заставил взглянуть на препарат по-новому.
От чего должны лечить антидепрессанты. Теории возникновения депрессий
Сейчас существует несколько биологических теорий возникновения депрессий.
Наиболее распространёнными до недавнего времени были те, которые связывали появление депрессии и недостаток производства нейромедиаторов-моноаминов в мозге человека: серотонина, норэпинефрина, дофамина. Самой популярной была серотониновая гипотеза. Она утверждала следующее: у больных депрессией нарушено производство серотонина, если это исправить — это позволит побороть депрессию и многообразные тревожные расстройства (которых у человека не просто много, а очень много).
Однако наука на месте не стояла, учёные всё дальше и глубже лезли в человеческий мозг и всё больше узнавали о биологической подоплёке человеческих эмоций. А чем больше узнавали, тем больше вопросов возникало к «моноаминовой теории» [2].
Например, препараты, блокирующие серотониновые рецепторы, могут относиться к совершенно различным классам и оказывать разнообразное воздействие на человеческий организм: блокатор 5НТ2- и 5НТ3-рецепторов миртазапин является антидепрессантом, блокатор 5НТ2 кветиапин — антипсихотик. С другой стороны, агонисты блокаторов — условные депрессанты — таковыми не являются. Те же LSD, мескалин или псилоцибин не являются веществами, вызывающими депрессивное состояние. К тому же выяснилось, что такое вещество как глутамат играет большую роль не только как нейротрансмиттер, но также и существенную роль при развитии и функционировании мозга вообще [3] Появились теории, объясняющие его роль в формировании человеческих эмоций, процессов обучения и старения мозга [4].
А потом вспомнили, что у мозга есть такая вещь как «нейропластичность». Теория, согласно которой за формирование эмоционального фона человека ответственен не какой-то отдельный нейромедиатор, а результат совместной деятельности различных отделов мозга, быстро стала набирать популярность [5]. Её основное отличие от предшествующих теорий — падение или повышение концентрации серотонина (или любого другого моноамина) в синаптической щели (имеется в виду щель между двумя нервными клетками) само по себе не приводит к формированию настроения, а значит и не может быть ответственно за улучшение/ухудшение настроения. Больше внимания стали уделять факторам истончения серого вещества при депрессии, сокращению ветвления нервных клеток и другим, например, отвечающим за рост нейронов и связей между ними. [6]
Типы антидепрессантов
Хотя развитие науки оказывает непосредственное действие на разработку антидепрессантов, многие, из выпускающихся в настоящий момент, были разработаны ещё в то время, когда ни о какой «нейропластичности» речь просто не шла.
Первые в своём роде
Первыми массовыми «настоящими» синтетическими антидепрессантами, разработанными фармацевтическими компаниями, были трициклические препараты — имипрамин (впервые синтезирован в 1948 году, массово начал применяться с 1960-х годов) и др. Название они получили из-за структуры молекулы — у них три кольца в молекуле, хотя их структура и присоединённые радикалы отличаются.
Тримипрамин, представитель класса трициклических антидепрессантов.
Действие трициклических антидепрессантов основано на блокировании обратного захвата нейромедиаторов (в основном это норадреналин и серотонин) пресинаптической мембраной. В результате повышается их концентрация и, как следствие, должно улучшаться настроение.
Особенно активно препараты данной группы применялись для лечения тяжёлых депрессий. Однако сопровождающие лечение тяжёлые же побочные эффекты — от увеличенного риска схлопотать инфаркт до провоцирования эпилептических припадков, серьёзных неврологических расстройств, параноидных состояний, общего ухудшения когнитивных функций и состояния организма — вместе с разработкой менее токсичных и сильнодействующих препаратов, фактически вывели эти препараты из мейнстрима на обочину. Например, в США и ЕС они больше не используются как основные антидепрессанты при лечении тяжёлых депрессивных состояний.
Хотя из-за своей небольшой цены кое-где они могут до сих пор активно применяться. В России препараты этого типа всё ещё находят применение. Это, например, лекарства на базе амитриптилина (коммерческие названия — Амитриптилин Никомед) или кломипрамина (коммерческое название — Анафранил).
Мощь и токсичность первых ингибиторов
В 1952 году был изобретён антидепрессант ипрониазид — ингибитор моноаминоксидазы (МАО), который также относится к антидепрессантам первого поколения (вместе с трициклическими).
Действие антидепрессантов этого типа основано на ингибировании МАО, которая содержится в нервных окончаниях, и препятствовании тем самым разрушению ею моноаминов — серотонина, дофамина, триптаминов, норадреналина и других. Таким образом, препараты способствует повышению концентрации моноаминов в синаптической щели.
Работа ингибитора МАО (норадренергический синапс). Из книги
Drugs The Straight Facts, Antidepressants, 2004.
Проблема почти всех антидепрессантов — токсичность и многообразные побочные эффекты. Особенно у неселективных ингибиторов, которые действуют одновременно на МАО-А и МАО-Б. Ипрониазид, из-за побочных эффектов и высокой токсичности практически перестал использоваться как ИМАО.
Помимо того, проблемой является необходимость соблюдения специфической тираминовой диеты. Особенно жёстко её стоит придерживаться в случае приёма неселективных необратимых ИМАО. Дело в том, что одновременный приём ИМАО и продуктов, «богатых тирамином», может привести к «тираминовому синдрому» — быстрому развитию гипертонического криза. При диете стоит избегать употреблять такие продукты как сыры, молоко, копчёности (включая рыбу), бобовые, вино, водка, пиво и продукты, содержащие пивные дрожжи, а также пряности и печенье.
Но и это не последние сложности. ИМАО плохо сочетаются с рядом лекарственных средств из-за подавления ряда ферментов печени, а это и обезболивающие, и препараты против кашля и простуды, и антиастматические, и антигистаминные и другие. [7]
В тоже время современные ИМАО — моклобемид, пиразидол, инказан, бефол, селегилин — не требуют соблюдения диеты (впрочем, перебарщивать с пищей, содержащей тирамины, не рекомендуется), у них меньше побочных эффектов, переносятся они лучше, а применение у них — шире. Однако, до самых массовых антидепрессантов — селективных ингибиторов обратного захвата серотонина (СИОЗС) им всё же далеко.
Антидепрессанты захватывают массы
Вот мы и дошли до самых массовых на данный момент в мире антидепрессантов — СИОЗС. Их относят ко второму поколению, а самым известным из них является, без сомнения «Прозак» (флуоксетин) компании Eli Lilly
.
Действие препаратов этого типа (СИОЗС) основано, как уже ясно из названия, на ингибировании обратного захвата серотонина, которое приводит к увеличению его концентрации в синаптической щели, со всеми вытекающими.
Работа флуоксетина (коммерческое название «Прозак»). Из книги Drugs The Straight Facts, Antidepressants, 2004.
По мере изучения действия препаратов типа СИОЗС выяснилось, что у них есть побочные, так называемые вторичные фармакологические качества. Они влияют на захват норадреналина и дофамина, стимулируют серотониновые рецепторы типа 5-HT2С и т. д. Причём каждый из СИОЗС обладает своими особыми вторичными фармакологическими качествами.
Среди популярных препаратов этой группы: флуоксетин, пароксетин, циталопрам, эсциталопрам, сертралин и другие. На рынке они присутствуют под коммерческими (торговыми) названиями — сертралин более известен под именем «Золофт», флуоксетин — «Прозак», а эсциталопрам — «Ципралекс». В отличие от антидепрессантов первого поколения, СИОЗС относительно неплохо переносятся, у них меньше побочных эффектов, при том, что по воздействию они вполне сопоставимы с препаратами предыдущего поколения.
Дальнейшее развитие и новые типы селективных ингибиторов обратного захвата
Дальнейшее развитие препаратов, основанных на ингибировании нескольких нейромедиаторов (или отличных от серотонина), привело к созданию современных антидепрессантов. К таким относятся селективные ингибиторы обратного захвата норадреналина (СИОЗН), серотонина и норадреналина (СИОЗСиН), норадреналина и дофамина (СИОЗНиД).
Смысл действия схож с СИОЗС — увеличение концентрации нейромедиатора (-ов) в синаптической щели. Но препараты легче переносятся и показывают лучшие результаты при лечении депрессий, включая тяжёлые. Например, ряд исследований показали, что атомоксетин и ребоксетин (СИОЗН) эффективней препаратов СИОЗС при лечении тяжёлых депрессий. А препараты группы СИОЗСиН по эффективности сходны с трициклическими, при этом легко переносимы и не такие токсичные, как последние. Наиболее известные из этой группы — венлафаксин, дулоксетин, милнаципран.
Если сравнивать между собой группы СИОЗСиН и СИОЗС, то, по ряду исследований, у первых более выражены побочные эффекты: проблемы с сердечно-сосудистой системой, с желудочно-кишечным трактом, с нервной системой. Приём венлафаксина и милнаципрана влияет на мочеполовую систему — например, проблемы с либидо и эякуляцией. [8]
К группе СИОЗНиД относится бупропион, который активно применяется в лечении апатических депрессий и расстройств. Связано это с особенностями препарата, который одно время рассматривался рядом специалистов не как антидепрессант, а как психостимулятор.
Упор на специфичность действия новых средств
Помимо этих типов антидепрессантов, есть и специфические (миртазапин, миансерин), которые, увеличивая концентрацию норадреналина и серотонина, блокируют α2-адренорецепторы. Одновременно, они блокируют серотониновые рецепторы типа 5-HT2 и 5-HT3, тем самым резко снижая побочные эффекты, за которые те ответственны, как то: сексуальные расстройства, тошноту, рвоту, бессонницу и др.
Работа миртазапина по блокировке α2-адренорецепторов. Из книги Drugs The Straight Facts, Antidepressants, 2004.
Другие же препараты, такие как тразодон, подавляют обратный захват и блокируют серотониновые рецепторы 5-HT2. Как и в предыдущем случае, это ведёт к снижению проявления побочных эффектов от применения препарата — сексуальных расстройства, тревоги, бессонницы и других.
Некоторые антидепрессанты вообще не воздействуют на моноамины, в смысле ингибирования обратного захвата. Препарат агомелатин блокирует серотониновые рецепторы типа 5-HT2C и стимулирует мелатониновые (MT1 и MT2). Блокировка серотониновых рецепторов приводит к высвобождению дофамина и норадреналина, а стимуляция мелатониновых восстанавливает функцию сна, часто нарушенную при депрессии, и устраняет бессонницу. Так как препарат не влияет на другие серотониновые рецепторы, не стимулирует захват нейромедиаторов, он фактически лишён побочных действий большинства антидепрессантов. Но некоторые всё же есть: головокружения, головная боль, тошнота.
Проблемы антидепрессантов и попытки найти их решения
Серьёзная научная проблема, касающаяся современных антидепрессантов, о которой в последнее время всё чаще говорят — эффективность их воздействия и многообразные побочные эффекты.
Ряд анализов исследований антидепрессантов выявил, что, если учитывать все имеющиеся данные, включая неопубликованные, эффективность многих препаратов можно поставить под сомнение: в некоторых случаях результат их применения не лучше, чем полученный в контрольной группе, получавшей плацебо [9]. Некоторые исследования утверждают, что антидепрессанты типа СИОЗС могут увеличить риск суицида у подростков [10].
Эффективность разных антидепрессантов по сравнению с плацебо. В среднем воздействие было эффективнее изменений, наблюдавшихся в группах, получавших плацебо, на 42% [9].
По мере исследования депрессии и способов её лечения стало выясняться, что при слабых или средних её формах самые обычные физические упражнения были способны улучшить состояния заболевших, пусть и краткосрочно. Переоценивать их не стоит, физические упражнения оказывают в лучшем случае умеренный эффект [11]. Кроме того, страдающего депрессией не так просто побудить делать упражнения.
Поиск и изобретение новых антидепрессантов подогревается не только новыми данными, например, обнаруженным влиянием интерлейкинов (или цитокинов), образовывающихся при воспалительном процессе, на протекании депрессии [12], но и снижение показателя эффективности антидепрессантов при масштабных исследованиях. Так, масштабное исследование STAR*D, в котором изучались преимущественно новейшие препараты — бупропион, циталопрам, миртазапин, сертралин и другие — выявило практически полное отсутствие разницы эффективности лечения депрессии между ними [13]. А последующие показали, что 30—50% пациентов, принимавших антидепрессанты, последние практически никак не помогали в лечении [14]. За время курса приёма антидепрессанта снижалась его эффективность [15]. В целом же, согласно клиническим исследованиям, примерно треть принимающих антидепрессанты достигали полной ремиссии, трети — они помогали, при том, что постоянно оставалась вероятность рецидива, а оставшейся трети — нет [16].
В экспериментальной практике лечения депрессии и депрессивных состояний, например, в США, в последние годы стали активно использовать такие психостимуляторы, как кетамин и его производные — одни из самых распространённых наркотиков в ЮВА [17]. А при разработке новых лекарств уже экспериментируют с псилоцибином (галлюциноген) [18]. Наверное, можно осторожно сказать, что психофармакология, сделав круг, вернулась к «основам» и опять хочет попытаться лечить депрессию наркотическими средствами и их производными. Впрочем, это в США, а не в России, и пока только экспериментально.
Заключение
Несмотря на активный поиск эффективного и универсального лекарства от депрессии, его пока что нет, и есть определённые сомнения, что оно будет создано. Особенно учитывая всё чаще обсуждаемый последнее время факт: под термином «депрессия» скрываются разные расстройства различной этиологии. Тем не менее, даже имеющиеся препараты, сочетаемые, возможно, с физической нагрузкой, способны улучшить качество жизни пациента и привести — в большинстве случаев — к ремиссии.
Вам может быть интересно:
Антидепрессанты способны изменить чувства влюблённых.
Литература
[1] Inflammatory illness: Why the next wave of antidepressants may target the immune system, Nature Medicine 23, 1009—1011 (2017), doi:10.1038/nm0917-1009 [2] From Stress to Inflammation and Major Depressive Disorder: A Social Signal Transduction Theory of Depression, Psychol Bull. 2014 May; 140(3): 774—815. doi: 10.1037/a0035302 ; PATHOPHYSIOLOGY OF DEPRESSION: DO WE HAVE ANY SOLID EVIDENCE OF INTEREST TO CLINICIANS? World Psychiatry. 2010 Oct; 9(3): 155—161. [3] Imaging extrasynaptic glutamate dynamics in the brain, PNAS 2010 April, 107 (14) 6526-6531. https://doi.org/10.1073/pnas.0913154107 [4] Glutamate: its role in learning, memory, and the aging brain, July 1993, Volume 111, Issue 4, pp 391—401 [5] Neuronal plasticity: A link between stress and mood disorders, Psychoneuroendocrinology (2009) 34S, S208—S216 [6] Effects of Acute Tryptophan Depletion on Mood and Facial Emotion Perception Related Brain Activation and Performance in Healthy Women with and without a Family History of Depression, Neuropsychopharmacology (2007) 32, 216—224 ; Role of Brain-Derived Neurotrophic Factor in the Aetiology of Depression, CNS Drugs 2010; 24 (1): 1-7 ; The role of BDNF and its receptors in depression and antidepressant drug action: Reactivation of developmental plasticity. Dev.Neurobiol 2010 Apr;70(5):289-97. doi: 10.1002/dneu.20758. [7] Маркова И. В., Михайлов И. Б., Неженцев М. В. Фармакалогия 2-е. — СПб.: Фолиант, 2001.; Джордж Арана, Джеральд Розенбаум. Руководство по психофармакотерапии. Пер. с англ. — Москва: Издательство БИНОМ, 2004 (George Arana, Jerrold Rosenbaum «Handbook of Psychiatric Drug Therapy», 4th ed., 2001) [8] Ингибиторы обратного захвата серотонина и норадреналина: фармакологические свойства, клиническая эффективность и переносимость по сравнению с другими классами антидепрессантов. Часть 2, Consilium Medicum, 2007, Т. 2, № 3. [9] Antidepressants versus placebo in major depression: an overview. World Psychiatry. 2015 Oct;14(3):294-300. doi: 10.1002/wps.20241. Другие данные, см. Randomized, placebo-controlled trials of antidepressants for acute major depression: thirty-year meta-analytic review. Neuropsychopharmacology. 2012 Mar;37(4):851-64. doi: 10.1038/npp.2011.306. [10] Selective serotonin reuptake inhibitors and risk of suicide: a systematic review of observational studies. CMAJ. 2009 Feb 3; 180(3): 291—297. doi: 10.1503/cmaj.081514 [11] Exercise for depression. Cochrane Database of Systematic Revies.Editorial Group: Cochrane Common Mental Disorders Group DOI: 10.1002/14651858.CD004366.pub6 ; Benefits from aerobic exercise in patients with major depression: a pilot study. British Journal of Sports Medicine 2001;35:114-117. ; [12] Inflammatory mechanisms in major depressive disorder. Curr Opin Psychiatry. 2011 Nov;24(6) : 519-25. doi: 10.1097/YCO.0b013e32834b9db6. ; Antidepressants and Neuroinflammation: Can Antidepressants Calm Glial Rage Down? Mini Rev Med Chem. 2011 Jun;11(7):555-64. [13] The STAR*D project results: A comprehensive review of findings. Current Psychiatry Reports December 2007, Volume 9, Issue 6, pp 449—459 [14] Recent Progress in Pharmacological and Non-Pharmacological Treatment Options of Major Depression. Current Pharmaceutical Designб Volume 12 , Issue 4 , 2006. DOI : 10.2174/138161206775474422 ; [15] Early Onset of Selective Serotonin Reuptake Inhibitor Antidepressant Action. Arch Gen Psychiatry. 2006 Nov; 63(11): 1217—1223. doi: 10.1001/archpsyc.63.11.1217 [16] Acute and Longer-Term Outcomes in Depressed Outpatients Requiring One or Several Treatment Steps: A STAR*D Report. THE AMERICAN JOURNAL OF PSYCHIATRY. Volume 163, Issue 11, November, 2006, pp. 1905-1917 [17] New Hope for Depression, https://time.com/4876098/new-hope-for-depression/ [18] Novel psychopharmacological therapies for psychiatric disorders: psilocybin and MDMA, Lancet Psychiatry Volume 3, No. 5, p481—488, May 2021.
В настоящее время на мировом фармацевтическом рынке находится около 50 антидепрессантов различных фармакологических групп, позволяющих осуществлять рациональный выбор препарата конкретному больному.
Классификация антидепрессантов
Существует несколько классификаций антидепрессантов:
- по поколениям;
- химической структуре;
- механизму;
- направленности психотропного действия.
Общепринятой классификации по поколениям нет: разные авторы выделяют от двух до пяти поколений антидепрессантов. Чаще используют термины “старые антидепрессанты”, к которым относят ингибиторы моноаминооксидазы (МАО) необратимого действия и трициклические антидепрессанты (ТЦА), и “новые антидепрессанты” – ингибиторы МАО обратимого действия, селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы обратного захвата норадреналина (ИОЗН), препараты “двойного” действия (например, ингибиторы обратного захвата серотонина и норадреналина – ИОЗСН) и др. Наиболее широкое распространение получила классификация, основанная на механизме действия (табл. 1). Последствия блокады основных рецепторов представлены в табл. 2.
Кроме того, практическое значение имеет подразделение антидепрессантов на препараты с седативным (тримипрамин, доксепин, амитриптилин, пипофезин, миансерин, миртазапин, тразодон, флувоксамин), стимулирующим (имипрамин, дезипрамин, нортриптилин, флуоксетин, моклобемид) или сбалансированным (кломипрамин, мапротилин, сертралин, пиразидол) действием.
Ингибиторы моноаминооксидазы
Неселективные ингибиторы МАО (типов А и В) необратимого действия были первыми антидепрессантами, введенными в медицинскую практику. В настоящее время их применяют редко из–за частого развития побочных эффектов, необходимости соблюдения “бестираминовой” диеты, сложности дозирования и высокого риска летальных исходов при передозировке. По антидепрессантной активности ингибиторы МАО в целом аналогичны ТЦА, однако могут превосходить последние по эффективности при депрессии с выраженным симптомом усталости и у больных с высокой психологической чувствительностью к отверженности или неудаче межличностных отношений [3]. Они могут быть также полезны пациентам, не ответившим на лечение ТЦА [4].
Новые представители этой группы препаратов – селективные ингибиторы МАО–А (пиразидол, моклобемид) отличаются от предшественников значительно меньшей токсичностью и лучшей переносимостью. В ряде клинических исследований показаны их эффективность и безопасность при применении в общесоматической практике.
Мета–анализы клинических исследований моклобемида показали, что по эффективности при тяжелой депрессии, “двойной” депрессии (большое депрессивное расстройство [БДР], накладывающееся на дистимию) и депрессии, сопровождающейся симптомами тревоги и ажитации, он не уступает ТЦА [5, 6]. Особенно хороший ответ на лечение моклобемидом наблюдался у пациентов с БДР, имеющим меланхолический компонент.
Селегилин, обладающий в низких дозах (до 10 мг/сут) селективностью в отношении МАО типа В, преимущественно применяют для лечения болезни Паркинсона. В более высоких дозах, необходимых для лечения депрессии, селективность препарата в отношении МАО–В утрачивается и его свойства приближаются к свойствам “старых” ингибиторов МАО. При пероральном применении препарата в этих дозах необходимо исключение из питания продуктов, содержащих тирамин. Однако этот недостаток можно преодолеть, по крайней мере частично, при использовании трансдермальной лекарственной формы селегилина, одобренной FDA в конце февраля 2006 г. Основанием для ее разрешения стали результаты двух двойных слепых рандомизированных исследований с участием более 440 пациентов, в которых было показано, что пластырь, предназначенный для однократного применения в сутки и содержащий селегилин в дозе 6 мг, обладает выраженным антидепрессивным действием и не вызывает угнетения МАО в пищеварительной системе [7, 8]. При применении пластырей, содержащих более высокие дозы препарата (9 и 12 мг/сут), рекомендуется соблюдение тех же предосторожностей, что и при использовании пероральных неселективных ингибиторов МАО, включая “бестираминовую” диету.
Трициклические антидепрессанты
В группу ТЦА входит ряд препаратов, различающихся по химической структуре (вторичные и третичные амины), механизмам и направленности психотропного действия. ТЦА оказывают сильный антидепрессивный эффект и по эффективности при тяжелой депрессии превосходят некоторые более новые группы препаратов, в частности СИОЗС. Однако ТЦА значительно уступают антидепрессантам последующих поколений по безопасности и переносимости. Относительно неблагоприятный профиль побочных эффектов ТЦА обусловлен главным образом их антихолинергическими, антиадренергическими и антигистаминными свойствами. Антихолинергические и седативные свойства выражены у вторичных аминов (нортриптилин, дезипрамин) меньше, чем у третичных, поэтому они обычно лучше переносятся больными.
ТЦА могут вызывать разнообразные нежелательные эффекты со стороны сердечно–сосудистой системы: тахикардию, нарушения проводимости, ортостатическую гипотензию. Уже в терапевтических дозах они могут приводить к удлинению интервалов PQ, QRS и QT, особенно у пациентов с исходными нарушениями проводимости [9]. Удлинение интервала QT способствует развитию желудочковой аритмии по типу пируэта (torsades de pointes). Ее риск значительно возрастает при одновременном применении ТЦА с другими препаратами, удлиняющими QT. ТЦА могут вызывать атриовентрикулярную блокаду I и II степеней, асистолию и внезапную кардиальную смерть, риск которой повышается при применении доз, эквивалентных более 100 мг амитриптилина [10].
У больных ИБС применение ТЦА ассоциируется с повышением риска заболеваемости, включая инфаркт миокарда, и смертности [11, 12]. Поэтому препараты этой группы не рекомендуют назначать пациентам с выраженной кардиоваскулярной патологией [11–13]. Применения ТЦА также рекомендуется избегать у больных со склонностью к ортостатической гипотонии и у пациентов, получающих антигипертензивную терапию. Опасность для кардиологических больных могут представлять и последствия лекарственных взаимодействий ТЦА, например с клонидином, антиаритмическими препаратами, варфарином и ацетилсалициловой кислотой. В период лечения ТЦА рекомендуется мониторировать концентрации препаратов в крови, артериальное давление и ЭКГ [14].
Выраженная холинолитическая активность обусловливает неблагоприятное влияние ТЦА на когнитивные функции (ухудшение памяти, снижение концентрации внимания, затруднение интеллектуальной деятельности), что особенно опасно для лиц пожилого возраста и больных с исходными когнитивными нарушениями. ТЦА противопоказаны пациентам с глаукомой, гипертрофией предстательной железы, непроходимостью кишечника, судорожными припадками и делирием в анамнезе.
К недостаткам ТЦА относятся также узкий терапевтический индекс, высокий риск летальности при передозировке и необходимость титрации дозы. Угрожающие жизни кардиотоксические эффекты, в т. ч. с летальным исходом, могут возникать уже при десятикратном превышении терапевтической дозы ТЦА. Этим обусловлена нежелательность применения препаратов этой группы у больных с суицидальными мыслями.
Плохая переносимость ТЦА зачастую вынуждает снижать их дозы или отменять лечение. На практике только 20–25 % пациентов получают адекватные дозы ТЦА, что в свою очередь способствует снижению эффективности терапии [15].
С учетом плохой переносимости ТЦА и наличия на рынке более безопасных альтернатив их применение в настоящее время рекомендуют резервировать для тяжелых, рефрактерных и резистентных случаев депрессии.
Селективные ингибиторы обратного захвата серотонина
СИОЗС обладают широким спектром фармакологической активности, оказывая выраженные антидепрессивный, анксиолитический, антипанический и анальгетический эффекты.
СИОЗС несколько менее эффективны, чем ТЦА, при тяжелой депрессии и депрессии с меланхолическим компонентом, но равно эффективны с ними при легких и среднетяжелых депрессиях. У больных с выраженными физическими симптомами или болью СИОЗС могут уступать ТЦА и селективным ИОЗН [16]. Однако они более эффективны, чем селективные ИОЗН, у лиц молодого возраста (18–24 года) [17], а флуоксетин является единственным антидепрессантом с доказанной эффективностью у детей и подростков [18].
СИОЗС рекомендуют отдавать предпочтение перед ТЦА у лиц с биполярной депрессией, т. к. ТЦА могут индуцировать у этой категории больных манию или гипоманию. Благоприятное соотношение эффективность/безопасность, подтвержденное в многочисленных адекватных клинических исследованиях, позволяет рассматривать СИОЗС в качестве препаратов первого ряда в общесоматической практике, в т. ч. у кардиологических больных [14, 19], лиц пожилого возраста [20], беременных и кормящих грудью женщин [21, 22].
На сегодняшний день они являются наиболее широкоприменяемыми антидепрессантами в первичном звене оказания медицинской помощи во всем мире [23].
Более низкий риск кардиотоксичности СИОЗС по сравнению с ТЦА обусловлен практически полным отсутствием антихилинергического, антиадренергического и антигистаминного действий. Более того, результаты клинических исследований позволяют предположить наличие кардиопротективного эффекта у пароксетина, флуоксетина и сертралина, которое связывают с истощением под их влиянием запасов серотонина в тромбоцитах и блокадой внутриклеточной мобилизации кальция. В самом большом (n = 369) исследовании СИОЗС в кардиологии – The Sertraline Antidepressant Heart Randomized Trial (SADHART) – прослеживалась тенденция к снижению смертности больных острым инфарктом миокарда или нестабильной стенокардией с БДР, получавших сертралин [24]. Частота неблагоприятных кардиоваскулярных явлений составила в группе сертралина 14,5 против 22,4 % в группе плацебо.
К достоинствам СИОЗС относятся отсутствие у них выраженной поведенческой токсичности, возможность проведения лечения фиксированными дозами или минимальная потребность в титрации, а также высокая безопасность при передозировке. Превышение суточной дозы СИОЗС до 30 раз ассоциируется с минимальным количеством неблагоприятных симптомов или их полным отсутствием, более высокая передозировка обычно приводит к сонливости, тремору, тошноте и рвоте. При превышении суточной дозы более чем в 75 раз возможно развитие таких осложнений, как судороги, изменения на ЭКГ и нарушение сознания. Описан случай превышения дозы сертралина в 270 раз без серьезных последствий. Летальные исходы при применении СИОЗС почти во всех случаях обусловлены их взаимодействиями с алкоголем или другими лекарственными средствами [25, 26].
Несмотря на более высокую цену СИОЗС по сравнению с ТЦА, стоимость лечения препаратами этих групп аналогична. Это обусловлено тем, что применение СИОЗС сопряжено с меньшим количеством побочных эффектов, требующих медикаментозной коррекции, и меньшей частотой переключения на антидепрессанты других групп [27].
Препараты группы СИОЗС в целом обладают сходной эффективностью при депрессии. В мета–анализе клинических исследований было выявлено лишь небольшое, но достоверное превосходство сертралина над флуоксетином [28]. Для СИОЗС характерен и сходный спектр безопасности, хотя частота отдельных побочных эффектов при применении разных препаратов может различаться [29]. Так, флуоксетин чаще вызывает нервозность, беспокойство, дерматологические реакции, снижение аппетита и массы тела, сертралин – диарею, а пароксетин – сухость во рту [30]. Для пароксетина характерен также более тяжелый синдром отмены, чем для других СИОЗС [31].
Различия в частоте и выраженности побочных эффектов СИОЗС обусловлены как фармакодинамическими, так и фармакокинетическими особенностями этих препаратов. Наряду с основным механизмом действия, связанным с угнетением обратного захвата серотонина, практически все препараты имеют дополнительные механизмы: пароксетин обладает антихолинергическими свойствами и угнетает кальцийзависимую синтетазу NO (NOS), флуоксетин является агонистом 5–HT2–рецепторов, сертралин ингибирует обратный захват дофамина. Большинство СИОЗС имеют достаточно длительный период полувыведения (около суток), позволяющий применять их 1 раз в день, что благоприятно влияет на аккуратность соблюдения пациентом назначенного режима лечения. Исключение составляет флувоксамин, который необходимо принимать 2 раза в сутки. Самый длительный период полувыведения характерен для флуоксетина (T½ препарата – 2–3 суток, активного метаболита – 5–21 сутки). Длительный период полувыведения флуоксетина обусловливает меньший риск развития синдрома отмены в случае резкого прекращения лечения и полезен недисциплинированным пациентам, плохо соблюдающим назначенный режим терапии [32]. Кроме того, после отмены флуоксетина требуется более продолжительный (5 недель) период “отмывания” перед назначением других лекарственных средств, влияющих на серотонинергические процессы, например ингибиторов МАО или суматриптана, а побочные эффекты флуоксетина могут персистировать в течение более длительного времени, чем таковые других СИОЗС [33].
Флуоксетин является мощным ингибитором CYP2 D62 и 2C9/10, а также взаимодействует с другими изоферментами цитохрома Р450 – 2C19 и 3A¾, что обусловливает высокий риск неблагоприятных последствий лекарственных взаимодействий, включая серотониновый синдром [33]. Минимальный риск лекарственных взаимодействий характерен для сертралина, циталопрама и эсциталопрама, оказывающих слабое действие на изоферменты цитохрома Р450.
Ко многим побочным эффектам СИОЗС в течение нескольких недель развивается толерантность. Например, в начале лечения достаточно частым побочным эффектом, связанным с повышением серотонинергической активности в желудочно–кишечном тракте является тошнота, однако она, как правило, проходит в течение первой недели лечения [29].
Благодаря благоприятному соотношению польза/риск, доказанному в многочисленных клинических исследованиях, мета–анализах и при многолетнем широком практическом применении, СИОЗС рассматриваются в качестве препаратов выбора у большинства больных с нетяжелой депрессией, особенно в общесоматической практике.
Игибиторы обратного захвата норадреналина
К антидепрессантам, преимущественно угнетающим обратный захват норадреналина, относятся препараты из группы ТЦА, – нортриптилин, мапротилин и дезипрамин, а также селективный ИОЗН – ребоксетин.
При БДР ребоксетин в целом сходен по эффективности с ТЦА и СИОЗС [34]. В клинических исследованиях он превосходил имипрамин у больных депрессией с меланхолическим компонентом и флуоксетин – при тяжелых БДР [35]. Ребоксетин демонстрировал также существенные преимущества перед флуоксетином в отношении улучшения социального функционирования больных. Результаты небольших исследований позволяют предположить, что клинический эффект ребоксетина развивается быстрее (начало – в среднем через 10 дней), чем у антидепрессантов других групп. Возможно, он лучше СИОЗС устраняет симптомы тревоги у больных БДР [36].
Ребоксетин значительно превосходит ТЦА по переносимости. Он обладает слабым антихолинергическим действием, поэтому значительно реже ТЦА вызывает сухость во рту и запоры. В клинических исследованиях побочные эффекты ребоксетина носили преимущественно легкий или умеренный характер. Он не приводил к нарушению жизненно важных функций и лабораторных показателей. В исследованиях короткой продолжительности частота отмены препарата не отличалась от таковой плацебо. Ребоксетин не вызывает выраженной тошноты, диареи, гипотензии и седативного эффекта. Нарушения сексуальной функции наблюдаются у небольшой части пациентов, преимущественно при применении дозы выше 8 мг/сут. Ребоксетин не обладает кардиотоксичностью, не нарушает когнитивных функций и не ассоциируется с повышенным риском судорог или ортостатической гипотензии. В сравнительном исследовании с флуоксетином он превосходил последний по желудочно–кишечной и центральной (ажитация/нервозность/тревога) переносимости [37].
Достоинствами ребокситина являются низкий потенциал лекарственных взаимодействий и отсутствие синдрома отмены.
При депрессивных расстройствах ребоксетин рассматривается в качестве эффективной и безопасной альтернативы СИОЗС и ТЦА. Кроме того, он может быть новой опцией для лечения булимии [38].
Антидепрессанты “двойного” действия
К препаратам, примерно в равной степени угнетающим обратный захват серотонина и норадреналина, относятся некоторые ТЦА, в частности имипрамин и амитриптилин. Новыми ИОЗСН являются венлафаксин, дулоксетин и милнаципран. Они блокируют переносчики моноаминов более избирательно, чем ТЦА, в связи с чем не влияют на сердечную проводимость [34]. Между собой эти препараты различаются селективностью действия: милнаципран в равной степени блокирует обратный захват серотонина и норадреналина, а дулоксетин (в 10 раз) и венлафаксин (в 30 раз) сильнее блокируют захват серотонина, чем норадреналина [39].
В клинических исследованиях венлафаксин превосходил ТЦА и флуоксетин по эффективности лечения острого эпизода тяжелой депрессии, способности предупреждать рецидивы заболевания [40–42]. Он также превосходил СИОЗС у пациентов с тяжелыми БДР и резистентной депрессией. Дулоксетин проявлял сходную эффективность с пароксетином [43], милнаципран – с СИОЗС и имипрамином [44–46]. Помимо депрессии новые ИОЗСН также эффективны при тревожных расстройствах.
Результаты клинических исследований позволяют предположить, что терапевтический эффект ИОЗСН развивается быстрее, чем СИОЗС [47].
По переносимости новые ИОЗСН превосходят ТЦА, что связано прежде всего с отсутствием у них влияния на вегетативную нервную систему. Венлафаксин, по–видимому, переносится хуже, чем дулоксетин и милнаципран [48]. Он вызывает седативный эффект, тошноту, нарушение сексуальной функции, дозозависимое (> 200 мг/сут) повышение АД и синдром отмены. В открытом сравнительном исследовании с четырьмя СИОЗС переносимость венлафаксина при длительном применении в максимально переносимых дозах не отличалась от таковой препаратов сравнения [49]. Однако риск летальных исходов при передозировке венлафаксина выше, чем при применении других серотонинергических препаратов, поэтому его надо с осторожностью назначать больным с суицидальными намерениями [50]. При применении венлафаксина следует соблюдать также бдительность в отношении серотонинового синдрома. Для предупреждения синдрома отмены дозы венлафаксина надо снижать постепенно.
Профиль побочных эффектов дулоксетина сходен с таковым СИОЗС [51]. В клинических исследованиях он вызывал побочные эффекты легкой и средней тяжести, которые носили преимущественно транзиторный характер [52]. Основной причиной отмены дулоксетина была тошнота. Он вызывал также небольшое повышение АД и частоты сердечных сокращений, которое, по мнению некоторых авторов, не имеет клинического значения [52]. Тем не менее гипертоникам его следует назначать с осторожностью [51]. Применение дулоксетина не рекомендовано больным с клиренсом креатинина < 30 мл/мин и/или нарушением функции печени [51].
Милнаципран отличается благоприятными фармакокинетическими свойствами. Он быстро всасывается в желудочно–кишечном тракте, имеет высокую биодоступность и низкую степень связывания с белками плазмы. Препарат быстро выводится из организма, подвергаясь глюкуронированию в печени и на 90 % выделяясь в неизмененном виде с мочой. Благоприятная фармакокинетика способствует повышению безопасности препарата. Фармакокинетическими преимуществами милнаципрана перед большинством других антидепрессантов являются небольшие межиндивидуальные колебания концентраций в крови, слабое влияние на систему цитохрома Р450 и низкий потенциал лекарственных взаимодействий [53]. Возможно, по переносимости милнаципран несколько превосходит СИОЗС [54]. В частности, он реже СИОЗС вызывает желудочно–кишечные побочные эффекты и тревогу, но чаще – головную боль, сухость во рту и дизурию [55]. Дизурия наблюдается примерно у 7 % мужчин, получающих милнаципран [56]. Отсутствие кардиотоксичности при передозировке обусловливает значительно более высокую безопасность милнаципрана по сравнению с ТЦА [57].
Антидепрессанты “двойного” действия, угнетающие обратный захват серотонина и норадреналина, могут быть рекомендованы больным с выраженной соматизированной тревогой и патологическим аффектом. Преимуществом новых ИОЗСН перед СИОЗС является более высокая эффективность в облегчении хронической боли, как ассоциированной с депрессией, так и не зависимой от нее [58]. Показана эффективность венлафаксина и дулоксетина при боли, обусловленной диабетической нейропатией, и боли при первичной или вторичной депрессии [59–61]. Дулоксетин официально одобрен FDA для лечения боли, ассоциированной с диабетической периферической нейропатией у взрослых [62]. Дулоксетин и милнаципран представляются перспективными препаратами для лечения фибромиалгии. В клинических исследованиях они устраняли не только боль, но и другие симптомы фибромиалгии у 60 % пациентов [63].
К препаратам с двойным механизмом действия относят и бупропион, угнетающий обратный захват норадреналина и дофамина [1]. По эффективности он близок ТЦА [34] и СИОЗС [64]. Отсутствие у бупропиона влияния на серотонинергические процессы обусловливает отличия в профиле его побочных эффектов от СИОЗС. Он реже вызывает тошноту, диарею, сонливость и ухудшение сексуальной функции. Напротив, препарат может стимулировать сексуальную активность. Это позволяет применять бупропион для усиления эффектов СИОЗС или профилактики их побочных эффектов. Бупропион может быть эффективной альтернативой СИОЗС, в т. ч. у больных, не ответивших на лечение этими препаратами [65, 66]. Он нашел широкое применение для облегчения отвыкания от табакокурения.
В дозах, не превышающих 450 мг/сут, бупропион способствует инверсии фазы у больных с биполярной депрессией в меньшей степени, чем другие антидепрессанты [67].
К числу серьезных побочных эффектов бупропиона при применении в высоких дозах (однократная доза более 200 мг или суточная более 450 мг) и/или у пациентов с припадками в анамнезе относятся судороги. Риск их развития уменьшается при делении суточной дозы на несколько приемов [30], однако такой режим применения может привести к снижению приверженности пациентов лечению.
Стимуляторы обратного захвата серотонина
В группу стимуляторов обратного захвата серотонина входит один препарат – тианептин. По химической структуре он является трициклическим соединением дибензотиазепинового типа. Механизм действия тианептина остается не до конца ясным. Показано, что он стимулирует обратный захват серотонина при однократном и длительном введении, но не влияет на постсинаптические серотониновые рецепторы. В последнее время широко обсуждается влияние тианептина на нейропластические процессы в головном мозге, в частности в гиппокампе. У животных с экспериментальной моделью депрессии на фоне хронического стресса он приводил к нормализации различных параметров пластичности гиппокампа, а также повышал устойчивость к стрессу [68, 69].
В краткосрочных исследованиях (продолжительностью от 4 недель до 3 месяцев) тианептин проявлял сходную эффективность с ТЦА и СИОЗС. Он не уступал амитриптилину, импрамину и флуоксетину по устранению тревоги у больных БДР, биполярными расстройствами и дистимией, превосходя в этом отношении мапротилин [70]. Следует отметить, что амитриптилин и мапротилин применялись в этих исследованиях в субмаксимальных дозах.
Длительная терапия тианептином позволяла эффективно предупреждать рецидивы депрессии. Препарат эффективен у больных эндогенной депрессией и у лиц с синдромом отмены алкоголя [71].
Тианептин не влияет на альфа1–адренергические Н1–гистаминовые рецепторы, в значительной мере определяющие седативные свойства антидепрессантов, а также на М–холинорецепторы. Он оказывает сбалансированное действие на ЦНС, обладая при этом анксиолитическими свойствами [72]. Препарат не оказывает существенного влияния на сердечно–сосудистую систему. В клинических исследованиях при его применении наблюдалось небольшое уменьшение частоты сердечных сокращений, не сопровождавшееся изменениями проводимости [73], и в редких случаях – ортостатическая гипотензия [70]. Производитель указывает, что при применении препарата возможны тахикардия, экстрасистолия, стенокардия и загрудинная боль, однако в большом фармакоэпидемиологическом исследовании КОМПАС, проведенном в России в 2002 г., тианептин зарекомендовал себя безопасным средством лечения депрессивных состояний у больных с сопутствующими соматическими заболеваниями, включая сердечно–сосудистые [74].
Тианептин не оказывает негативного влияния на когнитивные функции. Напротив, есть сведения, что он может способствовать улучшению памяти, концентрации внимания и улучшению ориентации. Он не изменяет психомоторную активность и в отличие от большинства других антидепрессантов мало влияет на сексуальную функцию [75].
Тианептин хорошо переносится больными при кратковременном и длительном применении. В клинических исследованиях он реже амитриптилина вызывал такие побочные эффекты, как сухость во рту (20 против 38 %), запор (15 против 19 %), головокружение/синкопе (13 против 23 %), сонливость (10 против 17 %), и ортостатическую гипотензию (3 против 8 %), но чаще – бессонницу и кошмарные сновидения (20 против 7 %) [70]. Препарат редко вызывает гепатотоксические реакции. Прием тианептина может сопровождаться небольшим увеличением массы тела [76].
Тианептин имеет достаточно благоприятный фармакокинетический профиль (высокая биодоступность, отсутствие метаболизма при первом проходе через печень, ограниченное распределение и быстрое выведение), обеспечивающий ему существенные преимущества перед типичными ТЦА. Однако его быстрое выведение из организма повышает значение строгого соблюдения назначенного режима лечения и ограничивает применение тианептина у недисциплинированных больных [71]. После прекращения лечения тианептином синдром отмены развивается очень редко [77].
Тианептин рекомендуют для лечения невротических, соматоформных расстройств, депрессии у лиц пожилого возраста или тревожных и депрессивных расстройств в период абстиненции у больных хроническим алкоголизмом [70, 71, 78].
Антидепрессанты со смешанным механизмом действия
Митразапин блокирует центральные пресинаптические альфа2–адренергические ауто– и гетерорецепторы и усиливает адрено– и серотонинергическую передачу в ЦНС. Стимулируя передачу импульсов через серотониновые 5–HT1–рецепторы, он угнетает 5–HT2– и 5–HT3–рецепторы [79]. Препарат слабо влияет на альфа1–адренорецепторы и холинорецепторы, умеренно блокирует гистаминовые H1–рецепторы. Он угнетает также альфа–адренорецепторы и М–холинорецепторы на периферии, что приводит к развитию ортостатической гипотензии и антихолинергических побочных эффектов.
Эффективность миртазапина у больных БДР была установлена в плацебо–контролируемых и сравнительных исследованиях с амитриптилином, кломипрамином, доксепином, флуоксетином, пароксетином, циталопрамом и венлафаксином. Показана его эффективность при депрессиях, резистентных к СИОЗС и ТЦА, и у больных с непереносимостью препаратов этих групп [80, 81]. Миртазапин эффективен при депрессии с сопутствующими симптомами тревоги и нарушениями сна. Он показан также пациентам с пониженной массой тела [82].
Клинический эффект препарата развивается достаточно быстро – через 1–2 недели, что может объясняться его двойным механизмом действия [83].
Наиболее частыми побочными эффектами миртазапина являются дозозависимая сонливость (54 %), сухость во рту (25 %), головокружение (7 %), повышение аппетита (17 %) и массы тела (12 %) [84]. Выраженность некоторых побочных эффектов, например сонливости и прибавки веса, имеет тенденцию к уменьшению при длительном применении препарата и повышении дозы. Миртазапин обладает низкой кардиотоксичностью и редко вызывает ортостатическую гипотензию [85]. В отличие от СИОЗС он крайне редко вызывает сексуальную дисфункцию. В период лечения миртазапином может наблюдаться умеренное повышение уровня холестерина, триглицеридов и аланиноаминотрансферазы. Самым серьезным побочным эффектом препарата является агранулоцитоз, который встречается с частотой 1 : 1000 и носит обратимый характер [84]. Митразапин подвергается интенсивному метаболизму в печени с участием CYP 1A2, 2D6 и 3A4, однако обладает низким риском лекарственных взаимодействий.
Место миртазапина в клинической практике окончательно не установлено, хотя в большинстве случаев его рассматривают как препарат второго ряда. В качестве препарата первого ряда он может применяться у пациентов с тяжелой тревогой или бессонницей [84].
Миансерин является тетрациклическим антидепрессантом, оказывающим антагонистический эффект по отношению к постсинаптическим
5–НТ2–рецепторам, а также угнетающим альфа1– и альфа2–адренорецепторы.
Препарат обладает антидепрессивными и седативными свойствами и рекомендован для лечения депрессивных расстройств, в т. ч. сопровождающихся тревогой. Он может применяться совместно с СИОЗС для усиления их эффекта [86].
По эффективности миансерин сопоставим с ТЦА, но оказывает значительно более слабое антихолинергическое действие, не обладает кардиотоксичностью и относительно безопасен при передозировке [87, 88]. Его применение ассоциируется с повышением риска лейкопении и агранулоцитоза [89].
В целом миансерин хорошо переносится больными с сердечно–сосудистыми заболеваниями, в т. ч. перенесшими инфаркт миокарда, и пожилыми пациентами [87]. В клинических исследованиях частота отмены миансерина у соматических больных с депрессией была достоверно ниже, чем при применении плацебо [90]. Тем не менее при использовании препарата у пожилых следует помнить о возможном неблагоприятном влиянии на когнитивные функции – ухудшении внимания и способности концентрироваться [91].
Нефазодон помимо антагонизма с 5–HT2–рецепторами умеренно угнетает также обратный захват серотонина, норадреналина и дофамина. По эффективности он близок СИОЗС, но реже вызывает сексуальную дисфункцию и расстройства сна [92, 93]. Нефазодон обладает анксиолитическими свойствами и оказывает благоприятное влияние на структуру сна. Наиболее частый побочный эффект препарата – седация. Он может вызывать также головную боль, сухость во рту, тошноту, головокружение, ортостатическую гипотензию и повышение массы тела.
Нефазодон особенно показан женщинам с послеродовой депрессией, пациентам с тяжелой депрессией и с резистентными к лечению БДР с тревогой [1]. Однако его применение ограничивают редкие случаи тяжелой гепатотоксичности, ставшие причиной добровольного отзыва производителем с мирового фармацевтического рынка оригинального препарата нефазодон.
Близкий по химической структуре нефазодону тразодон угнетает 5–HT2–рецепторы и альфа1–адренорецепторы. Он имеет ограниченное самостоятельное применение в качестве антидепрессанта. Чаще его назначают в сочетании с СИОЗС при депрессиях, в структуре которых существенное место занимают тревога и нарушение сна. В низких дозах (50–100 мг) препарат используют для лечения бессонницы. Однако соотношение риск/польза при применении тразодона в качестве снотворного средства у лиц, не страдающих депрессией, особенно пожилого возраста, не определено [94]. Его выраженные седативные свойства способствуют сонливости, снижению активности пациентов и затруднению выполнения ими повседневных обязанностей и профессиональной деятельности. Помимо седации тразодон вызывает головокружение и психомоторные нарушения, часто являющиеся причиной его отмены. У пожилых пациентов он может снижать способность к концентрации внимания [91]. В редких случаях тразодон вызывает приапизм. Недавно описан случай приапизма, потребовавший урологического вмешательства после однократного приема тразодона в дозе 100 мг [95]. При применении в более высоких дозах (300–600 мг), необходимых для лечения депрессии, переносимость препарата еще в большей степени ухудшается. В этих дозах он часто вызывает чрезмерную седацию или гипотензию. При постмаркетинговом фармаконадзоре получены сообщения о развитии сердечных аритмий при лечении тразодоном, чаще возникающих на фоне его передозировки [96]. Этот эффект связывают с ингибирующим действием тразодона на быстрые калиевые каналы.
Другие антидепрессанты
Во многих европейских странах к антидепрессантам первого ряда при легкой и умеренной депрессии относят препараты, действующим веществом которых является Hypericum perforatum (зверобой) [97]. Данные ряда клинических исследований позволяют предположить, что у больных легкой и умеренной депрессией Hypericum perforatum превосходит по эффективности плацебо и, возможно, не уступает стандартным антидепрессантам, значительно превосходя последние по переносимости [98]. Показано, что механизм действия Hypericum perforatum связан с нарушением обратного захвата серотонина, а не блокадой МАО, как предполагали раньше. Желудочно–кишечные побочные эффекты зверобоя, как правило, можно предупреждать путем деления суточной дозы (900 мг) на три приема. Осторожность следует соблюдать в отношении многочисленных лекарственных взаимодействий Hypericum perforatum. В случае отсутствия эффекта в течение 3–6 месяцев рекомендуется перевод больного на стандартный антидепрессант.
Заключение
В целом эксперты приходят к мнению, что существующие в настоящее время антидепрессанты у большинства больных обладают сходной эффективностью и различаются преимущественно профилем побочных эффектов [30]. Выбор препарата конкретному больному определяется потенциальной безопасностью и переносимостью, предполагаемой приверженностью лечению и эффективностью терапии в анамнезе (при наличии такого опыта). Для проявления клинического эффекта антидепрессантов обычно требуется 2–6 недель. Неудачи лечения чаще бывают обусловлены не резистентностью к терапии, а несоблюдением режима лечения, неадекватной дозой антидепрессанта или неадекватной продолжительностью лечения [97].