Введение
Наступление беременности у женщины, больной эпилепсией, это не только желаемый, но и весьма ответственный этап жизни. Поэтому пациентке фертильного возраста необходимо сразу же при ее первом обращении к эпилептологу объяснить, что данное мероприятие, как и всякий хороший экспромт, должно быть запланированным.
Способность иметь детей при эпилепсии у женщин снижена в среднем в 2 раза по сравнению с общей популяцией. Это объясняется как социальными, так и органическими причинами. Антиэпилептические препараты (АЭП) могут нарушать функции эндокринной системы и провоцировать развитие сексуальных нарушений (гипо- или гиперсексуальности), ожирения, гипотиреоза, поликистоза яичников, задержки полового развития, менструальной дисфункции и нарушений овуляции.
Беременность противопоказана только женщинам с тяжелой эпилепсией, когда прием АЭП не позволяет избежать частых генерализованных приступов, кроме того, у женщины имеются выраженные психические отклонения.
Эпилепсия не является противопоказанием к ЭКО, хотя не следует забывать о том, что для стимуляции выработки яйцеклетки женщинам — кандидатам на ЭКО — проводят массивное введение гормональных препаратов. Это может иногда провоцировать приступы.
Соматическое и неврологическое здоровье детей, родившихся у матерей, страдающих эпилепсией
Доля женщин, страдающих эпилепсией, среди общего числа беременностей составляет от 0,3% до 0,5%. Проблема эпилепсии и беременности неоднократно рассматривалась в работах C. L. Harden (2014), A. S. Laganà и соавт. (2016), а также M. O. Kinney и J. J. Craig (2017) [1–3]. S. F. Reiter и соавт. (2016) отмечают сниженную «удовлетворенность жизнью» среди женщин с эпилепсией как во время беременности, так и по ее завершении [4].
В изучении проблемы эпилепсии у беременных можно выделить следующие основные направления: 1) влияние антиэпилептических препаратов (АЭП) на плод (тератогенный эффект); 2) влияние АЭП на детей при грудном вскармливании; 3) влияние материнской эпилепсии (и АЭП?) на когнитивные функции детей.
Исходы беременности у женщин с эпилепсией
В обзорных работах M. Artama и соавт. (2017), а также I. Borthen и N. E. Gilhus (2012) подробно описан весь спектр осложнений беременности у женщин с эпилепсией [5, 6].
L. Sveberg и соавт. (2015) рассматривают проблему послеродовых кровотечений у женщин с эпилепсией [7]. Как известно, существующие в настоящее время рекомендации предусматривают для беременных, принимающих энзим-индуцирующие АЭП, назначение витамина К на протяжении последнего месяца гестации. После обследования 109 рожениц, страдающих эпилепсией, норвежские исследователи пришли к заключению, что риск послеродовых кровотечений у этого контингента пациентов по частоте возникновения не имеет достоверных отличий от такового у женщин контрольной группы (без эпилепсии). Более того, отличия отсутствовали как среди принимавших, так и не принимавших с профилактической целью витамин К [7].
A. H. Farmen и соавт. (2015) привлекают внимание к нередкому феномену задержки внутриутробного развития (ЗВУР) плодов у женщин с эпилепсией [8]. В частности, были проанализированы проспективно зарегистрированные данные, касающиеся беременности, а также пре- и перинатальных факторов по округу Оппланд (Норвегия); окончательный анализ включал информацию по 166 женщинам с эпилепсией и их 287 детям (в контрольную группу были включены 40 553 случая беременности у женщин без эпилепсии, зарегистрированных в той же базе данных). Риск нахождения массового индекса в зоне ниже 10-го перцентиля и принадлежности детей к категории «маленьких к сроку гестации» (SGA) был существенно выше в первой группе, а экспозиция АЭП увеличивала этот риск (особенно при приеме женщинами ламотриджина); окружность головы была значительно меньшей у тех детей, чьи матери принимали карбамазепин [8].
T. Tomson и соавт. (2015) среди основных (наиболее широко распространенных) врожденных мальформаций, регистрируемых у детей, матери которых страдают эпилепсией, на первое место ставит врожденные пороки сердца, за которыми следуют орофациальные дефекты (расщелины неба/верхней губы), а также дефекты нервной трубки и гипоспадии [9]. При этом предполагается, что описываемые врожденные мальформации являются результатом воздействия на плод различных АЭП, принимаемых его будущей матерью для контроля эпилептических приступов.
J. Weston и cоавт. (2016) представили систематический обзор, посвященный монотерапии эпилепсии в периоде беременности с акцентом на исходы в виде врожденных аномалий развития у потомства матерей с описываемой патологией [10].
F. J. Vajda и соавт. (2017) склонны увязывать АЭП-индуцированные мальформации плодов со спонтанными абортами (выкидышами). Так, по данным австралийских исследователей получавшие АЭП женщины, у которых в предшествующую беременность отмечались мальформации плода или спонтанный выкидыш, при последующих беременностях имели 2–3-кратно повышенный риск возникновения аномалии плода (по сравнению с женщинами, получавшими аналогичную терапию, но без осложнений в виде мальформации плода) [11]. Вообще среди беременных женщин, получавших АЭП, вероятность спонтанных выкидышей была выше, чем в предшествующие беременности (без приема АЭП). Не исключено, что спонтанные выкидыши были сопряжены c АЭП-зависимыми мальформациями, не совместимыми с дальнейшим выживанием плода [11].
Влияние антиэпилептических препаратов на плод
У детей, подвергшихся влиянию АЭП, возникают проблемы различного плана, но основное внимание среди них принято уделять двум принципиальным моментам — врожденным мальформациям и отставанию в развитии. Принято считать, что риск врожденных аномалий (мальформаций), ассоциированных с терапией АЭП, варьирует от 2% до 10%. Почти полвека назад S. R. Meadow (1968) сообщил о взаимосвязи приема примидона, фенитоина и фенобарбитала с врожденными мальформациями.
E. Campbell и соавт. (2013) продемонстрировали, что рекуррентный (повторный) риск врожденных мальформаций у детей, подвергшихся в периоде внутриутробного развития воздействию АЭП (при наличии врожденной мальформации у ранее родившегося ребенка), составил 16,8% (по сравнению с 9,8% у женщин, ранее родивших ребенка без мальформаций), а относительный риск равнялся 1,73 при 95% доверительном интервале от 1,01 до 2,96 [12]. Риск повторного рождения ребенка с мальформациями достигал 50% у женщин, которые ранее родили двух детей с врожденными мальформациями. По данным английских исследователей, наблюдалась тенденция к более высокому риску повторных мальформаций у беременных женщин, получавших вальпроаты (21,9%, относительный риск 1,47 при 95% доверительном интервале 0,68–3,20) и топирамат (50%, относительный риск 4,50 при 95% доверительном интервале 0,97–20,82), но не карбамазепин или ламотриджин [12].
Представляя соответствующие данные Бостонского медицинского центра за период с 2003 по 2010 гг., G. M. Deck и соавт. (2015) указывают, что среди младенцев, подвергшихся воздействию АЭП в периоде внутриутробного развития (при наличии у их матерей эпилепсии), частота встречаемости больших врожденных мальформаций (заячья губа и/или волчья пасть, септальные дефекты желудочков или предсердий, другие аномалии сердечно-сосудистой системы, дефекты урогенитальной системы) составила порядка 4,7% [13]. Представляет интерес то обстоятельство, что в тех случаях, когда матери принимали АЭП по другим показаниям (не для лечения эпилепсии), частота встречаемости больших врожденных мальформаций была еще выше (5,0%). Самый же высокий уровень описываемых мальформаций (10,6%) отмечен у младенцев, чьи матери на протяжении беременности получали монотерапию бензодиазепинами [13].
Признавая отсутствие точного понимания воздействия на системы и органы фетального организма, в качестве потенциальных механизмов патологического влияния АЭП на развитие плода L. Etemad и соавт. (2012) перечисляют следующие (основные): фолат-ассоциированные реакции, ишемию, реактивные интермедиарные субстанции (например, свободные радикалы), а также генетическую подверженность [14].
Что касается фолат-ассоциированных реакций, по данным популяционного когортного исследования L. Ban и соавт. (2015), посвященного изучению частоты врожденных аномалий у детей при наличии/отсутствии приема фолиевой кислоты (в высоких дозах) их матерями на фоне использования АЭП, получены следующие результаты [15]. Авторы приходят к заключению, что потомство женщин с эпилепсией в первом триместре беременности подвергается в 2 раза большему риску значительных врожденных аномалий развития (по сравнению с контингентом, матери которых не страдают эпилепсией); при этом никаких свидетельств тому, что высокодозная дотация фолиевой кислоты снижает риск АЭП-ассоциированных последствий, не было получено [15].
Основываясь на данных популяционного когортного исследования, J. Christensen и соавт. (2015) указывают, что оценка по шкале APGAR у детей, пренатально подвергшихся воздействию АЭП, оказывается ниже, чем у новорожденных, чьи матери в период беременности не принимали препаратов этой группы [16]. К такому заключению авторы пришли на основании данных, основанных на результатах анализа регистров здоровья в Дании (677 021 случай одноплодных родов за период с 1997 по 2008 гг.). Скорригированный относительный риск (aRR) низкой оценки по шкале APGAR (< 7 баллов) по сравнению с группой контроля составил 1,34 (95% доверительный интервал 0,90–2,01). При рассмотрении в этом аспекте отдельных АЭП оказалось, что не корригированный относительный риск (RR) составил для карбамазепина 1,86 (95% доверительный интервал 1,01–3,42), 1,85 для вальпроатов (95% доверительный интервал 1,04–3,30), 2,97 для топирамата (95% доверительный интервал 1,26–7,01) [16].
H. Mutlu-Albayrak и соавт. (2016) представили серию случаев так называемого «фетального вальпроатного синдрома» (fetal valproate syndrome) у детей различного возраста [17]. При этом у наблюдаемых пациентов отмечался не только лицевой дизморфизм, но и другие признаки (аномалии развития пальцев верхних конечностей, деформация грудины, двусторонний крипторхизм, недоразвитие речи и т. д.). Турецкие исследователи приходят к выводу, что при внутриутробной экспозиции плодов препаратам вальпроевой кислоты могут формироваться не только черты лицевого дизморфизма, но и ряд малых скелетных аномалий, причем это не зависит от дозы вальпроатов, принимаемых матерями [17].
В дополнение к этому H. Ozkan и соавт. (2011) описали случай тяжелого фетального вальпроатного синдрома в виде комбинации сочетанного порока сердца, мультикистозной дисплазии почек и тригоноцефалии (вариант краниостеноза, при котором отмечается преждевременное закрытие лобного шва) [18].
Исследование, выполненное M. W. Green и соавт. (2012), было посвящено изучению риска возникновения орофациальных дефектов и больших врожденных мальформаций у плодов, подвергшихся действию топирамата, принимаемого беременными женщинами с эпилепсией [19]. Риск описываемых врожденных мальформаций при использовании топирамата в периоде гестации не превышал таковой для других АЭП [19]. R. Castilla-Puentes и соавт. (2014) выявили преобладающее количество больших врожденных аномалий плода/новорожденного в случаях приема топирамата по поводу имеющейся эпилепсии (в сравнении с приемом этого АЭП по иным показаниям) [20].
M. Сarrasco и соавт. (2015) впервые описали случай развития синдрома отмены габапентина у новорожденного, мать которого на протяжении беременности длительно принимала этот препарат; ранее габапентин считался абсолютно безопасным для использования в периоде гестации [21].
Влияние АЭП на детей при грудном вскармливании
Хотя АЭП, поступающие в организм ребенка с грудным молоком при естественном вскармливании, потенциально могут вызывать побочные эффекты и нежелательные события, а также оказывать негативное влияние на его развитие, большинство фармакологических средств считаются безопасными или «сравнительно безопасными». На это обстоятельство указывают G. Veiby и соавт. (2016) [22]. Наименее безопасными считаются такие АЭП, как барбитураты, бензодиазепины, ламотриджин и этосуксимид [22].
Речь идет не только о таком традиционном АЭП, как вальпроевая кислота (вальпроаты) и карбамазепин, но и о новых АЭП — ламотриджине, топирамате, габапентине, леветирацетаме и т. д.
В свое время B. Frey и соавт. (2002) описали случай транзиторного холестатического гепатита у новорожденного/грудного ребенка, вызванного поступлением в его организм с грудным молоком карбамазепина, который мать пациента принимала в качестве антиэпилептического лечения [23].
E. Nordmo и соавт. (2009) представили клиническую ситуацию с развитием у младенца тяжелого апноэ при поступлении с грудным молоком ламотриджина [24].
T. Westergren и соавт. (2014) наблюдали 2-месячного ребенка, получавшего грудное вскармливание у матери с эпилепсией, у которого при этом развилась топирамат-индуцированная диарея [25].
R. Davanzo и соавт. (2013) подчеркивают, что при естественном вскармливании этосуксимид, зонисамид, а также повторные назначения клоназепама и диазепама кормящим матерям являются абсолютно противопоказанными [26].
Ламотриджин считается безопасным АЭП при использовании беременными и кормящими женщинами [27]. Тем не менее среди неблагоприятных эффектов ламотриджина, оказываемых на получающих грудное вскармливание младенцев, H. Dalili и соавт. (2015) перечисляют тромбоцитоз и тяжелое апноэ [27]. В этой связи авторы подчеркивают необходимость мониторирования концентрации ламотриджина в крови у младенцев, вскармливаемых грудным молоком матерями, получающими этот АЭП [27].
Влияние материнской эпилепсии на когнитивные функции детей
О дефиците когнитивных функций, свойственных детям, подвергшихся влиянию АЭП в фетальном периоде развития, сообщается в многочисленных публикациях R. L. Bromley и соавт. (2010), D. McCorry и R. Bromley (2015), S. Kasradze и соавт. (2017), R. L. Bromley и G. A. Baker (2017) и других исследователей [28–31].
В частности, N. Gopinath и соавт. (2015) прямо указывают, что дети матерей, страдающих эпилепсией, характеризуются не только сниженным интеллектом, но и нарушениями внимания и памяти [32].
M. Videman и соавт. (2016) в своих работах демонстрируют влияние пренатального действия АЭП на активность головного мозга в периоде новорожденности (c оценкой неврологического статуса по Hammersmith Neonatal Neurological Examination, а также ЭЭГ-исследованием для оценки ранней кортикальной активности), а затем описывают относительную сохранность внимания к лицам в 7-месячном возрасте у детей, матери которых принимали препараты указанной фармакологической группы в периоде беременности [33, 34]. Тем не менее финские авторы подчеркивают, что применение в периоде гестации карбамазепина, окскарбазепина и препаратов вальпроевой кислоты (но не ламотриджина и не леветирацетама) было ассоциировано с нарушениями вербального развития в возрасте 7 месяцев [34].
В свою очередь, в работах S. Hunt и соавт. (2006) и D. W. Loring (2014) показано, что леветирацетам безопасен для плода при использовании в режиме монотерапии [35, 36]. R. Shallcross и соавт. (2014) показали, что речевое, моторное и когнитивное развитие детей, внутриутробно подвергшихся влиянию принимаемого их матерями леветирацетама, не страдает [37].
Эволюцию представлений о влиянии эпилепсии и АЭП на плод и ребенка можно проследить по публикациям последних лет, среди которых заслуживают особого внимания работы A. C. Tricco и соавт. (2014), E. E. Gerard и K. J. Meador (2015), Q. Niе и соавт. (2016), S. V. Thomas и соавт. (2017) [38–41].
Создание регистров беременности представляется важнейшим моментом в изучении потенциально тератогенных и прочих эффектов АЭП в отношении нервной системы, а также других органов и систем потомства матерей, страдающих эпилепсией.
Литература
- Harden C. L. Pregnancy and epilepsy // Continuum (Minneap. Minn). 2014; 20 (1 Neurology of Pregnancy): 60–79.
- Laganà A. S., Triolo O., D’Amico V., Cartella S. M. et al. Management of women with epilepsy: from preconception to post-partum // Arch. Gynecol. Obstet. 2016; 293 (3): 493–503.
- Kinney M. O., Craig J. J. Pregnancy and epilepsy; meeting the challenges over the last 25 years: The rise of the pregnancy registries // Seizure. 2017; 44: 162–168.
- Reiter S. F., Bjørk M. H., Daltveit A. K., Veiby G. et al. Life satisfaction in women with epilepsy during and after pregnancy // Epilepsy Behav. 2016; 62: 251–257.
- Artama M., Ahola J., Raitanen J., Uotila J. et al. Women treated for epilepsy during pregnancy: outcomes from a nationwide population-based cohort study // Acta Obstet. Gynecol. Scand. 2017; Feb 7. DOI: 10.1111/aogs.13109. .
- Borthen I., Gilhus N. E. Pregnancy complications in patients with epilepsy // Curr. Opin. Obstet. Gynecol. 2012; 24 (2): 78–83.
- Sveberg L., Vik K., Henriksen T., Taubøll E. Women with epilepsy and post partum bleeding: Is there a role for vitamin K supplementation? // Seizure. 2015; 28: 85–87.
- Farmen A. H., Grundt J., Tomson T., Nakken K. O. et al. Intrauterine growth retardation in foetuses of women with epilepsy // Seizure. 2015; 28: 76–80.
- Tomson T., Xue H., Battino D. Major congenital malformations in children of women with epilepsy // Seizure. 2015; 28: 46–50.
- Weston J., Bromley R., Jackson C. F., Adab N. et al. Monotherapy treatment of epilepsy in pregnancy: congenital malformation outcomes in the child // Cochrane Database Syst. Rev. 2016; 11: CD010224.
- Vajda F. J., O’Brien T. J., Graham J. E., Hitchcock A. A. et al. Antiepileptic drugs, foetal malformations and spontaneous abortions // Acta Neurol. Scand. 2017; 135 (3): 360–365.
- Campbell E., Devenney E., Morrow J., Russell A. et al. Recurrence risk of congenital malformations in infants exposed to antiepileptic drugs in utero // Epilepsia. 2013; 54 (1): 165–171.
- Deck G. M., Nadkarni N., Montouris G. D., Lovett A. Congenital malformations in infants exposed to antiepileptic medications in utero at Boston Medical Center from 2003 to 2010 // Epilepsy Behav. 2015; 51: 166–169.
- Etemad L., Moshiri M., Moallem S. A. Epilepsy drugs and effects on fetal development: Potential mechanisms // J. Res. Med. Sci. 2012; 17 (9): 876–881.
- Ban L., Fleming K. M., Doyle P., Smeeth L. et al. Congenital anomalies in children of mothers taking antiepileptic drugs with and without periconceptional high dose folic acid use: A population-based cohort study // PLoS One. 2015; 10 (7): e0131130.
- Christensen J., Pedersen H. S., Kjaersgaard M. I., Parner E. T. et al. Apgar-score in children prenatally exposed to antiepileptic drugs: a population-based cohort study // BMJ Open. 2015; 5 (9): e007425.
- Mutlu-Albayrak H., Bulut C., Caksen H. Fetal valproate syndrome // Pediatr. Neonatol. 2016; Jun 17. pii: S1875–9572 (16)30072–9. DOI: 10.1016/j.pedneo.2016.01.009. .
- Ozkan H., Cetinkaya M., Köksal N., Yapici S. Severe fetal valproate syndrome: combination of complex cardiac defect, multicystic dysplastic kidney, and trigonocephaly // J. Matern. Fetal Neonatal Med. 2011; 24 (3): 521–524.
- Green M. W., Seeger J. D., Peterson C., Bhattacharyya A. Utilization of topiramate during pregnancy and risk of birth defects // Headache. 2012; 52 (7): 1070–1084.
- Castilla-Puentes R., Ford L., Manera L., Kwarta R. F. Jr et al. Topiramate monotherapy use in women with and without epilepsy: pregnancy and neonatal outcomes // Epilepsy Res. 2014; 108 (4): 717–724.
- Carrasco M., Rao S. C., Bearer C. F., Sundararajan S. Neonatal gabapentin withdrawal syndrome // Pediatr. Neurol. 2015; 53 (5): 445–447.
- Veiby G., Bjørk M., Engelsen B. A., Gilhus N. E. Epilepsy and recommendations for breastfeeding // Seizure. 2015; 28: 57–65.
- Frey B., Braegger C. P., Ghelfi D. Neonatal cholestatic hepatitis from carbamazepine exposure during pregnancy and breastfeeding // Ann. Pharmacother. 2002; 36 (4): 644–647.
- Nordmo E., Aronsen L., Wasland K., Småbrekke L. et al. Severe apnea in an infant exposed to lamotrigine in breast milk // Ann. Pharmacother. 2009; 43 (11): 1893–1897.
- Westergren T., Hjelmeland K., Kristoffersen B., Johannessen S. I. et al. Probable topiramate-induced diarrhea in a 2-month-old breast-fed child — A case report // Epilepsy Behav. Case Rep. 2014; 2: 22–23.
- Davanzo R., Dal Bo S., Bua J., Copertino M. et al. Antiepileptic drugs and breastfeeding // Ital. J. Pediatr. 2013; 39: 50.
- Dalili H., Nayeri F., Shariat M., Asgarzadeh L. Lamotrigine effects on breastfed infants // Acta Med. Iran. 2015; 53 (7): 393–394.
- Bromley R. L., Mawer G., Love J., Kelly J. et al. Early cognitive development in children born to women with epilepsy: a prospective report // Epilepsia. 2010; 51 (10): 2058–2065.
- McCorry D., Bromley R. Does in utero exposure of antiepileptic drugs lead to failure to reach full cognitive potential? // Seizure. 2015; 28: 51–56.
- Kasradze S., Gogatishvili N., Lomidze G., Ediberidze T. et al. Cognitive functions in children exposed to antiepileptic drugs in utero — Study in Georgia // Epilepsy Behav. 2017; 66: 105–112.
- Bromley R. L., Baker G. A. Fetal antiepileptic drug exposure and cognitive outcomes // Seizure. 2017; 44: 225–231.
- Gopinath N., Muneer A. K., Unnikrishnan S., Varma R. P. et al. Children (10–12 years age) of women with epilepsy have lower intelligence, attention and memory: Observations from a prospective cohort case control study // Epilepsy Res. 2015; 117: 58–62.
- Videman M., Tokariev A., Stjerna S., Roivainen R. et al. Effects of prenatal antiepileptic drug exposure on newborn brain activity // Epilepsia. 2016; 57 (2): 252–262.
- Videman M., Stjerna S., Roivainen R., Nybo T. et al. Evidence for spared attention to faces in 7-month-old infants after prenatal exposure to antiepileptic drugs // Epilepsy Behav. 2016; 64 (Pt A): 62–68.
- Hunt S., Craig J., Russell A., Guthrie E. et al. Levetiracetam in pregnancy: preliminary experience from the UK Epilepsy and Pregnancy Register // Neurology. 2006; 67 (10): 1876–1879.
- Loring D. W. First-degree relative risk: in utero levetiracetam and valproate exposure // Epilepsy Curr. 2014; 14 (4): 186–188.
- Shallcross R., Bromley R. L., Cheyne C. P., García-Fiñana M. et al. In utero exposure to levetiracetam vs valproate: development and language at 3 years of age // Neurology. 2014; 82 (3): 213–221.
- Tricco A. C., Cogo E., Angeliki V. A., Soobiah C. et al. Comparative safety of anti-epileptic drugs among infants and children exposed in utero or during breastfeeding: protocol for a systematic review and network meta-analysis // Syst. Rev. 2014; 3: 68.
- Gerard E. E., Meador K. J. An update on maternal use of antiepileptic medications in pregnancy and neurodevelopment outcomes // J. Pediatr. Genet. 2015; 4 (2): 94–110.
- Niе Q., Su B., Wei J. Neurological teratogenic effects of antiepileptic drugs during pregnancy // Exp. Ther. Med. 2016; 12 (4): 2400–2404.
- Thomas S. V., Jose M., Divakaran S., Sankara Sarma P. Malformation risk of antiepileptic drug exposure during pregnancy in women with epilepsy: Results from a pregnancy registry in South India // Epilepsia. 2017; 58 (2): 274–281.
В. М. Студеникин*, 1, доктор медицинских наук, профессор, академик РАЕ С. Ш. Турсунхужаева**, кандидат медицинских наук
* ФГАУ ННПЦЗД Минздрава России, Москва ** Городская детская клиническая больница № 5, Ташкент
1 Контактная информация
Прегравидарная подготовка женщин с эпилепсией
Прегравидарная (от лат. gravida
— беременная) подготовка — комплекс профилактических, диагностических и лечебных мероприятий, результатом которых является готовность будущих родителей к полноценному зачатию, вынашиванию и рождению здорового ребенка. Планирование беременности не сводится к тому, чтобы попринимать витамины, бросить пить и курить за 1–2 мес. до зачатия. Прегравидарная подготовка начинается за 6–10 мес. до желаемой беременности и включает определенный перечень процедур.
Прегравидарная подготовка проходит в несколько этапов:
Медицинское обследование супругов.
Подготовка пары к зачатию, женщины — к вынашиванию ребенка.
Определение благоприятных дней для зачатия.
Количество и объем исследований до планируемой беременности определяются для каждой пациентки индивидуально терапевтом, гинекологом, генетиком. С точки зрения эпилептолога, необходимо определить концентрации АЭП в плазме крови; выполнить общий анализ крови с определением уровня тромбоцитов; биохимический анализ крови с определением уровня АЛТ, АСТ, билирубина, щелочной фосфатазы; сделать электроэнцефалограмму (ЭЭГ) или провести видео-ЭЭГ-мониторинг. В некоторых случаях при планировании беременности целесообразным является проведение ультразвукового исследования матки и ее придатков, а также ряда гормональных исследований, отражающих функцию репродуктивной системы женщины. Для подбора дозы АЭП показано регулярное исследование концентрации препарата в крови, а для поддержания постоянной концентрации желательно использовать лекарственные формы с замедленным высвобождением (дюрантные формы).
Показанием к внеплановому определению концентрации АЭП в крови до беременности служит учащение/утяжеление приступов или появление симптомов интоксикации.
В прегравидарный период рекомендуется провести консультацию генетика для определения риска возникновения эпилепсии у будущего ребенка. Эпилепсия не является наследственным заболеванием, но в некоторых случаях может передаваться по наследству. Риск передачи эпилепсии ребенку от матери при генетических эпилепсиях составляет в среднем 10%, при неизвестной этиологии и структурной эпилепсии — 3%. Риск передачи эпилепсии от отца составляет в среднем 2,5%. Если эпилепсией страдают оба родителя, то риск наследования эпилепсии ребенком увеличивается до 10–12%. Если женщина страдает структурной или эпилепсией неизвестной этиологии, риск для будущего ребенка возрастает втрое по сравнению с общей популяцией, в случае же генетической генерализованной или фокальной эпилепсии — в 10 раз.
Пройти генетическое обследование нужно, если:
в паре больны эпилепсией оба партнера;
в паре уже есть ребенок с эпилепсией;
в роду у одного или у обоих родителей были случаи эпилепсии, пороков развития (врожденная расщелина верхнего неба или «заячья губа», деформации пальцев и др.) и наследственных заболеваний;
у пациентки было 2 и более самопроизвольных выкидыша, случаи гибели плода или новорожденного.
Основной задачей врача является достижение полного контроля над приступами до наступления желаемой беременности. Важным показателем является длительность отсутствия приступов у пациентки до беременности: если на протяжении 9 мес. приступы отсутствуют, то очень высока вероятность того, что во время беременности приступов также не будет. Однако предсказать течение каждой конкретной беременности затруднительно.
Отменять прием АЭП на период зачатия нецелесообразно. Женщину следует предупредить о том, что риск развития врожденных аномалий плода на фоне приема АЭП у нее повышается втрое, но что отказ от приема препарата чреват еще более серьезными последствиями — травмированием или гибелью плода в случае развития эпилептического приступа. Необходимо объяснить пациентке, что внезапное прекращение приема АЭП резко повышает риск возникновения приступов, может привести к срыву ремиссии, увеличить частоту имеющихся приступов.
Назначение фолиевой кислоты показано с целью профилактики патологического влияния на плод и снижения риска невынашивания беременности (самопроизвольных выкидышей). Препараты фолиевой кислоты необходимо назначать еще до того, как пациентка забеременеет, т. к. для большинства женщин сама беременность является неожиданностью. Рекомендуется начать прием препаратов фолиевой кислоты за 3 мес. до предполагаемой беременности в дозировке 3–5 мг/сут и продолжать прием до 14 нед. беременности. Помимо фолиевой кислоты, также показано применение комплексных витаминных препаратов, рекомендуемых беременным. Терапия анемии проводится до беременности с применением препаратов, содержащих железо и фолиевую кислоту.
Поскольку вальпроат натрия чаще, чем карбамазепин, оказывает тератогенный эффект, а комбинация вальпроата и ламотриджина особенно опасна, то препаратом выбора является карбамазепин, однако лишь в том случае, если отсутствуют противопоказания к его применению (большинство форм генетической генерализованной эпилепсии, вторичная билатеральная синхронизация на ЭЭГ у больных фокальными эпилепсиями). Сведения о влиянии «новых» АЭП на внутриутробное развитие плода пока недостаточны, поэтому без острой необходимости от их введения в терапию в период подготовки к беременности лучше воздержаться.
Врач находится в очень невыгодном положении. Разрешая женщине забеременеть и родить ребенка, он берет на себя дополнительную ответственность и новые риски. При возникновении тератогенных последствий больная и ее родственники отнесут это на счет АЭП, назначенных доктором; при экзацербации болезни причиной страданий будет считаться неправильно подобранная терапия, а не долгожданная беременность. К тому же вопрос о рождении ребенка у больных эпилепсией, в силу разных причин, возникает не в самом юном возрасте.
Особенности ведения беременных с эпилепсией
На данный период жизни ведущим врачом является акушер-гинеколог, у которого пациентка должна регулярно наблюдаться. До 28-й нед. осмотры проводят 1 р./мес., с 28-й по 36-ю нед.— 1 раз в 2 нед., а после 36-й нед. — каждую неделю. В течение всего срока беременности женщина должна наблюдаться у эпилептолога: при полном контроле приступов — 1 раз в 2 мес., при повторяющихся парциальных приступах — 1 р./мес. Следует предупредить пациентку о необходимости обращаться к врачу при учащении приступов. Если имеется какая-то сопутствующая патология: сахарный диабет, анемия, артериальная гипертензия, заболевания почек и др., — требуется наблюдение смежных специалистов. Большинство гинекологов, неонатологов и педиатров очень опасаются негативного воздействия АЭП на организм матери и плода, в то же время не придают такого значения назначаемым ими самими препаратам. Однако назначение АЭП — компетенция эпилептолога, изменение схемы лечения возможно только при согласовании с ним. Если другие специалисты вносят коррективы в терапию или настаивают на отмене АЭП, то нужно сообщить об этом эпилептологу.
В настоящее время нет достоверных данных о повышении частоты осложнений беременности (преэклампсии, артериальной гипертензии, спонтанных абортов, изменения частоты приступов, эпилептического статуса) у больных эпилепсией женщин, принимающих АЭП, по сравнению с общей популяцией.
В период беременности следует использовать минимальные эффективные дозы АЭП, желательно в монотерапии [1]. Прием одного препарата снижает риск возможных дефектов развития плода. Доза АЭП должна быть как можно ниже, однако такой, на которой не возникают генерализованные судорожные приступы. Смена препарата на аналог может приводить к учащению приступов. Рекомендуется продолжать прием одного и того же препарата одного и того же производителя.
Немаловажным фактором безопасности является применение препаратов с контролируемым высвобождением активного вещества, которые можно применять 2 р./сут. Это позволяет исключить пики концентрации, особенно неблагоприятно влияющие на плод.
Тошнота и рвота при токсикозе могут существенно затруднять прием АЭП. Чтобы избежать снижения концентрации препаратов в крови, можно воспользоваться внутривенными или ректальными их формами. При частой рвоте (до 20 и более раз в сутки) показана госпитализация.
К сожалению, в России не зарегистрирован ни один из препаратов «скорой помощи при приступах». Единственным доступным способом предотвратить приступ в российских условиях является применение таблеток диазепама под язык при предчувствии приступов. Прием дополнительных доз АЭП, как правило, не имеет смысла, т. к. период всасывания у них достаточно длительный.
Беременным противопоказан прием психотропных препаратов и сильных снотворных. Расстройства сна нужно лечить немедикаментозными методами: фитотерапией (отвар аира, иван-чая, душицы, ромашки, мяты, липы, пиона и др.); психотерапией (прослушивание перед сном негромкой расслабляющей музыки); ароматерапией; соблюдением гигиены сна, а также режима труда и отдыха.
Фторхинолоны противопоказаны при эпилепсии. Применения некоторых других групп антибиотиков и противомикробных препаратов: макролидов, высоких доз пенициллинов также следует по возможности избегать. Однако если имеется воспаление, польза от антибактериальной терапии может превышать риск.
Беременным с эпилепсией противопоказано проведение физиотерапии в области головы и шеи.
Прием вальпроатов ассоциируется с увеличением массы тела. Однако увеличение массы тела происходит и при беременности. Однозначно сказать, чем объясняется прибавка в весе — приемом вальпроатов или неправильным течением беременности — в большинстве случаев невозможно. Для коррекции массы тела показано наблюдение у гинеколога-эндокринолога и соблюдение диеты. Замена вальпроатов на другой АЭП во время беременности не обоснована, может привести к появлению/учащению приступов и допустима только в случае крайней необходимости.
У 15–20% женщин может увеличиваться количество приступов, чаще в I или III триместре беременности. Увеличение частоты приступов нельзя прогнозировать исходя из типа приступов, длительности эпилепсии или учащения приступов во время предыдущей беременности. Даже наличие гормонально-зависимой эпилепсии не является прогностическим фактором учащения эпилептических приступов во время беременности. Возобновление приступов может быть обусловлено особенностями фармакокинетики АЭП во время беременности.
Самыми частыми провокаторами приступов во время беременности являются эмоциональный стресс и депривация сна. Повышение температуры тела может провоцировать приступы и ускорять выведение АЭП. Гипогликемия (снижение уровня глюкозы в крови) и употребление алкоголя также могут привести к появлению/учащению приступов. Приступы могут участиться после черепно-мозговой травмы. Поэтому нужно вести правильный образ жизни, тщательно следить за состоянием здоровья, соблюдать режим труда и отдыха. Однако достаточно часто приступы происходят совершенно непредсказуемо, и «здоровый образ жизни» не позволяет их предотвратить. Поэтому надо принимать достаточную дозу АЭП, а не только исключить провоцирующие факторы.
Тяжелые и среднетяжелые формы ОРВИ или гриппа отягощают течение эпилепсии и могут спровоцировать появление/учащение судорог. Несмотря на это, проведение специфической профилактики (вакцинации) не рекомендуется, т. к., во‑первых, влияние ряда вакцин на плод не изучено в должной мере, а значит, они потенциально опасны для плода, а во‑вторых, побочной реакцией на их введение является повышение температуры. Для профилактики гриппа у беременных применяют природные иммуномодуляторы («народные средства»), а также гигиенические мероприятия (избегать мест большого скопления людей, мыть руки и лицо, промывать нос и глаза после возвращения с улицы).
Генерализованные судорожные приступы считаются наиболее опасными как для матери, так и для ребенка. При их развитии очень многие факторы оказывают отрицательное влияние на организм матери и ребенка. Фокальные приступы условно можно считать не оказывающими влияния, но важно помнить, что они могут принимать генерализованную форму.
Исследование концентрации АЭП в крови в течение беременности следует проводить неоднократно, не менее 1 раза в 2 мес., а в случае повторяющихся приступов — ежемесячно. Это необходимо делать не только потому, что в процессе течения беременности возможно изменение метаболизма АЭП или концентрации препарата в связи с прибавкой веса, но и для контроля комплаентности.
Концентрация в плазме ламотриджина может существенно снижаться во время беременности. Также в конце I триместра в связи с повышением клиренса может возникнуть необходимость в повышении суточной дозировки леветирацетама.
Для оценки полноценности функционирования плаценты и ранней диагностики фетоплацентарной недостаточности целесообразно исследование гормонов фетоплацентарного комплекса (плацентарный лактоген, прогестерон, эстриол, кортизол) ежемесячно с конца I триместра беременности.
Особое внимание уделяется исследованию альфа-фетопротеина. В конце прошлого века было установлено, что при дефектах нервной трубки у плода (анэнцефалия и позвоночная расщелина) в сыворотке крови матери повышается содержание альфа-фетопротеина, белка, который синтезируется в печени плода. При дефектах нервной трубки альфа-фетопротеин проникает сквозь стенку капилляров в области дефекта в околоплодные воды, а оттуда в кровоток матери. С внедрением в клиническую практику методики определения уровня альфа-фетопротеина в сыворотке крови матери удалось повысить точность диагностики дефектов нервной трубки плода. Так, с помощью этого метода выявляется до 97–98% случаев анэнцефалии. Определение уровня альфа-фетопротеина в сыворотке также используют для диагностики многоплодной беременности, дефектов передней брюшной стенки и других пороков развития плода. Установлено, что при синдроме Дауна у плода содержание альфа-фетопротеина в сыворотке крови матери снижается. Определение уровня альфа-фетопротеина проводят на 15–20-й нед. беременности, наиболее информативно исследование на 16–18-й нед., повторно оно проводится при обнаружении изменений при УЗИ.
УЗИ плода проводят на 19–21-й нед. беременности для исключения аномалий развития. Высокий уровень альфа фетопротеина в сыворотке крови матери является абсолютным показанием к проведению УЗИ плода.
Важным диагностическим методом является кардиотокография. Этот метод позволяет получать более объективную информацию о состоянии сердечно-сосудистой системы плода по сравнению с аускультацией сердцебиений. При кардиотокографии оценивают сердечный ритм плода, его вариабельность, наличие акцелераций (учащение сердцебиений на 15–25 ударов в минуту при движениях плода) и децелераций (урежение сердцебиений не более чем на 30 секунд в период схваток). Нормальному состоянию плода соответствует частота сердечных сокращений 120–160 в минуту, хорошая вариабельность сердечного ритма (в основном за счет акцелераций) и отсутствие высокоамплитудных децелераций. Ценность данного метода исследования заключается в одновременном определении сердцебиений плода и моторики матки. Метод позволяет диагностировать внутриутробную гипоксию плода вследствие фетоплацентарной недостаточности.
Пациентка должна предупредить акушера, что ряд лекарственных препаратов ей противопоказан: ноотропные, аналептики, психотропные препараты (за исключением дробного введения малых доз бензодиазепинов с целью потенцирования обезболивания в родах).
В связи с потенциальной возможностью возникновения дефицита витамина К при приеме энзим-индуцирующих АЭП (карбамазепин) в последние недели беременности целесообразно назначить женщине, использующей эти АЭП, витамин К в дозе 10–15 мг/сут.
Беременность и эпилепсия: приступы и как их минимизировать
Джоан Роджин, директор Центра пароксизмальных нарушений, клиника неврологии, Миннеаполис, Миннесота, США.
Эпилепсия является одним из наиболее распространенных неврологических заболеваний женщин в репродуктивном периоде. В США зарегистрировано 1.1 миллиона женщин детородного возраста с эпилепсией. При уровне рождаемости 3-5 на 1000 родов, ежегодно у матерей, страдающих эпилепсией, рождается около 24.000 детей. У женщин с эпилепсией во время беременности могут возникать определенные специфические жалобы, но несмотря на это, подавляющее большинство таких женщин, рожают нормальных детей, а беременность почти не влияет на течение эпилепсии.
Формирование единой стратегии для минимизации риска развития осложнений при протекании беременности у женщин с эпилепсией способствует улучшению прогноза для матери и ребенка.
Частота приступов во время беременности.
К счастью, у большинства женщин во время беременности частота приступов снижается или остается неизменной. Однако, у 15%- 30% женщин может отмечаться увеличение количества припадков, чаще в первом или третьем триместре беременности. Увеличение частоты приступов нельзя прогнозировать исходя из типа приступов, наблюдающихся у женщины, длительности эпилепсии или даже наличия учащения приступов в предыдущую беременность. Даже наличие катамениальной эпилепсии, т.е. эпилепсии, при которой возникновение приступов тесно связано с определенными фазами менструального цикла, не является прогностическим фактором учащения эпилептических приступов во время беременности. К числу вероятных пусковых факторов такого учащения относят гормональные изменения, нарушения водно-солевого обмена, стресс и снижение уровня антиэпилептических препаратов в крови. Неадекватный сон и несоблюдение предписанного приема препаратов, очевидно, важнейшие факторы, которые женщины с эпилепсией могут контролировать сами, равно как и регулярные посещения невролога — эпилептолога в течение всего периода беременности.
Риск в результате развития приступов и приема антиэпилептических препаратов.
И приступы, возникающие во время беременности, и прием, антиэпилептических препаратов сопряжены с определенным риском. Риск при развитии приступа непосредственно связан с типом приступа. Возможно, фокальные приступы не несут за собой такой опасности, но они могут генерализоваться, а генерализованные тонико-клонические приступы сопряжены с высоким риском как для матери, так и для ребенка. К такому риску относятся травмы в результате падений или ожогов, повышенный риск преждевременных родов, выкидышей и подавление сердечного ритма плода. Контроль приступов необходим, т. к. по мнению эпилептологов, риск в результате развития приступов превышает риск при приеме антиэпилептических препаратов, прием которых может быть минимизирован при применении специфических подходов.
К риску развития у ребенка различных осложнений при применении антиэпилептических препаратов во время беременности, относят формирование врожденных мальформаций или дефектов развития. В общей популяции наблюдается появление врожденных мальформаций в 2-3% случаев. При этом их не всегда можно прогнозировать или предотвратить. У женщин с эпилепсией риск рождения ребенка с врожденным дефектом удваивается до 4-6%, но, в общем и целом остается низким. Повышенный риск имеется при применении политерапии, т.е. использование более одного типа препарата и при высокой дозе медикамента. Здесь также четко прослеживается роль генетического фактора. Наличие врожденных мальформаций при предыдущей беременности или в семейном анамнезе повышает риск их развития в текущую беременность. В таком случае необходимо генетическое консультирование. К наиболее частым мальформациям относятся такие дефекты лицевого черепа как заячья губа, волчья пасть, которые в большинстве случаев лечатся хирургически. Могут возникать также пороки сердца и дефекты мочеполовой системы.
Информация о безопасности новых антиэпилептических препаратов при беременности очень ограничена. Несколько больше данных имеется по классическим антиэпилептическим медикаментам. По имеющимся рекомендациям, должен использоваться наиболее эффективный препарат с минимальным побочным действием.
В то время как большинство наших антиэпилептических препаратов могут применяться и применяются безопасно, некоторые из них обладают специфическим повышенным риском. Вальпроат, применяемый в первые 28 дней беременности в 1-2% случаев вызывает развитие дефектов нервной трубки. В общей популяции этот риск уменьшается при приеме фолатов в период закрытия нервной трубки в раннем первом триместре. Несмотря на то, что это может и не обладать настолько же защитным эффектом у женщин с эпилепсией, фолаты должны применяться ежедневно еще до того как они забеременели, так как большинство женщин не знают, что они беременны до времени закрытия нервной трубки (24-28 дней после зачатия). Ежедневный мультивитамин, содержащий 0,4 мг фолатов, равно как дополнительная 1- до 4-мг добавка фолатов рекомендуется всем женщинам детородного возраста. Селениум и цинк, содержащиеся в мультивитаминах с минералами, также принесут определенную пользу. Витамин К1 должен применяться в последний месяц беременности, чтобы предотвратить редкие кровоизлияния у новорожденных.
Стратегии для минимизации риска.
Наиболее важно, чтобы женщины получали точную информацию до и во время беременности. Рекомендуется самая низкая возможная доза антиэпилептического препарата, при приеме которой приступы не возникают.
Прием одного препарата, монотерапия, снизит риск врожденных дефектов, уменьшит лекарственные взаимодействия, уменьшит побочные эффекты и улучшит взаимодействие между врачом и пациентом (комплаентность).
Очень важен мониторинг уровня препаратов в крови. Уровень антиэпилептических препаратов нужно проверять в течение всей беременности и после беременности. Уровни всех антиэпилептических препаратов снижаются во время беременности, при этом некоторые больше остальных. Возможно, нужно будет заново подбирать дозу. Так как уровень поднимается после родов, лекарственный мониторинг в периоде post partum так же нужен для уменьшения побочных эффектов. Акушером — гинекологом должен осуществляться мониторинг ребенка при определении материнского сывороточного альфа-фетопротеина и проведении ультразвукового обследования высокого разрешения или 2 уровня. Сама по себе эпилепсия не является показанием для кесарева сечения и большинство женщин рожает естественным путем.
Несмотря на то, что антиэпилептические препараты проникают в грудное молоко, грудное вскармливание поощряется. В большинстве случаев грудное вскармливание безопасно, так как ребенок подвергался действию антиэпилептических препаратов во время беременности, а абсолютное количество препарата в молоке невелико. Такие стратегии как прием антиэпилептических препаратов сразу после кормления рассчитаны на минимизацию количества препарата во время кормления. Грудное вскармливание обычно безопасно и рекомендовано в виду его высокой ценности для ребенка.
Рекомендуется планирование беременности вместе с врачом, регулярные консультации и лекарственный мониторинг антиэпилептических препаратов во время беременности. Очень важно соблюдение приема препаратов, а так же адекватный сон и отдых. Необходимо уделять внимание правильному питанию с контролем набора веса и прием витаминов с дополнительными фолатами до, во время и после беременности. Помня обо всех этих факторах, большинство женщин с эпилепсией родят нормального здорового ребенка.
Перевод с англ.: невролог, канд. мед. наук. Е. П. Тверская
Беременных с эпилепсией консультируют:
— доктор медицинских наук, профессор В. А. Карлов
— доктор медицинских наук, профессор И. А. Жидкова
Особенности родового периода у женщин с эпилепсией
У женщин, больных эпилепсией, выше риск кровотечений, слабости родовой деятельности и преэклампсии (риск последней в 2 раза выше, чем в популяции), отслойки плаценты, преждевременных родов, родовспоможение в 2 раза чаще осуществляется путем вакуум-экстракции плода или кесарева сечения. Для снижения риска осложнений необходимо установление полного контроля над приступами.
Вероятность эпилептического приступа во время родов и в течение 24 ч после родов выше, чем вероятность эпилептического приступа в другие периоды беременности. Прежде всего это связано с пропуском приема АЭП.
Эпилепсия не является противопоказанием для естественного родоразрешения, при этом медикаментозное ведение родов и обезболивание не отличаются от общепринятых стандартов. В большинстве случаев возможно применение длительной эпидуральной анальгезии.
Показаниями к кесареву сечению являются учащение эпилептических приступов, судорожные приступы чаще 1 р./нед. в последнем триместре беременности, серийное или статусное течение эпилепсии в предродовом периоде, гипоксия плода, слабость родовой деятельности, судорожный приступ во время родов.
Ведение послеродового периода у женщин с эпилепсией
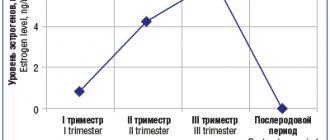
Следует предупредить пациентку о необходимости тщательно соблюдать режим приема АЭП в этот период, поскольку имеется риск декомпенсации эпилепсии в послеродовом периоде вследствие физического перенапряжения, стресса, возросшей лекарственной нагрузки, повышения активности эстрогенов.
Также после родоразрешения возможно появление симптомов передозировки АЭП вследствие снижения массы тела роженицы, кровопотери в родах, изменений метаболизма. В случае появления симптомов нейротоксичности — сонливости, диплопии, нистагма, атаксии необходимо срочное исследование концентрации АЭП в крови. Если дозировка препарата повышалась во время беременности, то целесообразно возвратиться к суточной дозе, применявшейся до беременности. Если у матери нет приступов, а у ребенка — побочных эффектов АЭП, изменение дозы нецелесообразно. Еще одна опасность кроется в учащении приступов вследствие ухода за ребенком, ночных пробуждений.
Грудное вскармливание новорожденного вполне возможно, поскольку доза АЭП, попадающая в организм ребенка с молоком, несравнима с количеством препарата, поступающим в организм плода через плаценту. Исключение следует сделать для фенобарбитала и ламотриджина. Механизмы их выведения из организма новорожденного несформированы, что может привести к аккумуляции препарата [1].
АЭП действовали на плод на протяжении всей беременности, а содержание их в грудном молоке значительно ниже, чем в крови беременной. Кроме того, можно снизить количество препарата в молоке, принимая АЭП после кормления.
Наиболее частым осложнением у новорожденных являются кожные проявления в виде аллергических реакций. Описаны случаи геморрагических осложнений (увеличение кровоточивости). Применение фенобарбитала во время беременности может приводить как к седативным проявлениям (сонливость, слабое сосание, мышечная слабость, вялость, заторможенность), так и к синдрому отмены (двигательное возбуждение, беспокойный сон, частый беспричинный плач), если по каким-либо причинам вскармливание грудным молоком прекращается.
Если у новорожденного обнаруживаются низкая активность, вялость при кормлении, желудочно-кишечные нарушения и другие симптомы, подозрительные на интоксикацию, то лучше перейти на искусственное вскармливание.
Определение концентрации препарата в грудном молоке не имеет практического смысла. Гораздо важнее наличие у ребенка клинических проявлений эффектов АЭП. Доза препарата, которая попадает ребенку с грудным молоком, зависит от количества высасываемого молока. У детей старше 6 мес., которым уже ввели прикорм, доза получаемого препарата уменьшается по мере роста ребенка.
Для детей с высоким риском судорожных приступов предусмотрен отвод от профилактических прививок. Вакцинация нежелательна в острой фазе инфекционных заболеваний, сопровождающихся повышением температуры тела. Плановая вакцинация откладывается до окончания острых проявлений заболевания. Возможен отвод от прививки АКДС или ее замена на АДСМ.
Женщинам с эпилепсией кормление грудью необходимо осуществлять в положении лежа на кровати или сидя на полу, желательно в присутствии родственников. Это позволит свести к минимуму риск травмы матери и/или ребенка во время приступа.
Эпилепсия (G-40) — хроническое заболевание головного мозга, характеризующееся повторными спонтанными приступами в виде нарушений двигательных, чувствительных, вегетативных, мыслительных или психических функций, возникающих вследствие чрезмерных нейрональных разрядов в коре больших полушарий [1].
Эпилепсия является одним из наиболее распространенных заболеваний нервной системы, встречающееся с одинаковой частотой во всем мире, независимо от расы. По всему миру от 0,5 до 1% населения страдают этой болезнью, что составляет около 40 млн человек [2]. Ежегодно регистрируемая заболеваемость эпилепсией, исключая фебрильные судороги и единичные пароксизмы, варьирует от 20 до 120 новых случаев в год на 100 000 населения, в среднем — 70 случаев на 100 000 населения. Среди общего количества больных от 25 до 40% составляют женщины репродуктивного возраста, при этом у 13% женщин манифестация заболевания приходится на период беременности, а у 14% припадки наблюдаются только во время беременности [3, 4]. По современным данным, заболевание может быть вызвано множеством экзогенных и эндогенных факторов. Различают идиопатическую, симптоматическую и криптогенную эпилепсию. Однако данное разделение эпилепсии на три формы не означает, что каждый случай болезни относится к одной из указанных групп — можно лишь предполагать вероятную причину заболевания. В настоящее время достижения в генетике позволили выделить много новых идиопатических форм, а в связи с развитием методов нейрорадиологии и визуализации мозга идет постепенное сокращение криптогенных форм эпилепсии. Общепризнанной остается концепция «цепного патогенеза эпилепсии» Г.Б. Абрамовича [5], согласно которой неблагоприятная наследственность способствует тому, что проблемы перинатального периода приобретают патогенную роль. Основным генетически детерминированным фактором развития эпилепсии является предрасположенность нейронов к избыточной синхронизации ритмической активности.
Данная проблема особенно актуальна в последнее десятилетие в связи с ростом числа беременностей и родов у женщин репродуктивного возраста. За последние 20 лет отмечено 4-кратное увеличение числа беременностей и родов у женщин с эпилепсией, у которых примерно 3—4 ребенка из 1000 рождаются матерями, принимающими противоэпилептическую терапию (ПЭТ) [1—3]. Эпилепсия представляет собой заболевание высокого риска: материнская смертность в 10 раз выше у женщин с эпилепсией, чем у пациенток без данного экстрагенитального заболевания, в экономически развитых странах от эпилепсии во время беременности умирает больше женщин, чем от преэклампсии [5].
Существует множество факторов риска (ФР) повреждения головного мозга: врожденные аномалии развития (пороки развития коры головного мозга), внутриутробные инфекции, хромосомные синдромы, наследственные болезни обмена веществ, родовые повреждения структур центральной нервной системы, опухоли, инфекции нервной системы, черепно-мозговые травмы, действие токсичных веществ, нарушения мозгового кровообращения, метаболические нарушения, лихорадки, дегенеративные заболевания мозга и наследственная предрасположенность [5, 6]. Замечено, что в семьях, в которых имеются родственники, страдающие эпилепсией, вероятность развития эпилепсии у ребенка выше, чем в семьях, в которых заболевание отсутствует. Если отец будущего ребенка страдает эпилепсией, то вероятность наследования не превышает общих показателей (1%) и большинство рождаются здоровыми [4].
С учетом факторов риска необходимо проведение прегравидарной подготовки для достижения компенсации заболевания предпочтительно с помощью монотерапии с использованием минимальной дозировки ПЭП. Неоспоримым также является назначение препаратов фолиевой кислоты всем женщинам с эпилепсией, планирующим беременность, так как все ПЭП дают тератогенный эффект [6, 7].
Учитывая высокий риск развития врожденной патологии ЦНС у плода (ВПР), в том числе связанной с тератогенным воздействием ПЭП, обязательным является консультация генетика до 17 нед беременности. При высоком риске развития ВПР и/или хромосомных мутаций необходимо применение инвазивных методов пренатальной диагностики (биопсия ворсин хориона, кордоцентез, амниоцентез с определением концентрации α-фетопротеина в амниотической жидкости и цитогенетическое исследование) [6, 8, 9].
Эпилепсия может быть проявлением многих сотен наследственных болезней (НБ) и нередко ведущим их проявлением [10, 11]. В настоящее время отсутствует классификация НБ, сопровождающихся эпилепсией, поэтому окончательная диагностика возможна только с помощью лабораторного подтверждения. Существующие Н.Б. можно разделить на три группы по субстрату «поломки» наследственного материала: хромосомные, генетические (обусловленные мутацией ядерной ДНК) и связанные с мутацией митохондриальной ДНК [10—12].
В современной эпилептологии в отношении перинатального исхода беременности обсуждаются три основных направления: влияние эпилептических приступов во время беременности на мать и плод; тератогенный риск при приеме ПЭП и риск наследования эпилепсии [12].
По данным наблюдений [5, 13], у 54—80% женщин частота припадков во время беременности не меняется, но приблизительно 5—32% отмечают учащение приступов. Вероятно, это связано тем, что беременность является ФР, способным оказывать влияние на головной мозг в связи с изменением соотношения прогестерона и эстрогена. Эстрогены провоцируют эпилептические приступы за счет изменения проницаемости клеточных мембран для кальция и снижения притока хлорида через рецепторы γ-аминомасляной кислоты (ГАМК), а прогестерон, наоборот, снижает возбудимость корковых нейронов путем повышения действия ГАМК [14]. Поэтому даже физиологическая беременность в 20—25% наблюдений способна приводить к учащению приступов во время беременности, в 30—35% — к учащению приступов в I триместре, в 5% — как во время, так и после беременности [6].
Другим ФР, оказывающим влияние на течение беременности и эпилепсии, является повышение активности цитохрома Р450, который способен усиливать синтез прокоагулянтов и жирных кислот, приводя к изменению метаболизма лекарственных препаратов и снижению концентрации ПЭП в крови [15]. Учащение приступов объясняется изменениями в организме женщины, вызванными беременностью: возрастанием объема распределения препарата и его более высокой элиминацией почками, измененной активностью печеночных ферментов, снижением уровня белков в плазме крови [16].
В настоящее время отсутствуют рекомендации по ведению беременности у больных с эпилепсией, но основной целью является контроль над приступами. Мнение исследователей по изучению влияния эпилепсии на беременность противоречиво, одни считают, что эпилепсия повышает риск развития акушерского кровотечения, задержки роста плода и гипертонических расстройств во время беременности [5, 8, 13], по данным других [1, 2, 17], показатели у беременных, больных эпилепсией, практически не отличаются от таковых у здоровых беременных по развитию гестоза, угрозы самопроизвольных абортов и преждевременных родов. При этом показатель перинатальной смертности превышает среднестатистические значения в 1,5—2 раза, чаще наблюдается рождение детей с низкой оценкой состояния по шкале Апгар и массой тела менее 2500 г — в 7—10% случаев [17]. Фокальные эпилептические приступы считаются относительно безопасными. В большей степени необходимо уделять внимание генерализованным тонико-клоническим судорогам (ГТКС), которые сопровождаются грубыми гипоксическими нарушениями и представляют серьезную опасность для здоровья матери и плода. При этом наблюдаются высокий риск травмы в результате падений или ожогов, повышенный риск преждевременных родов и выкидышей, подавление сердечного ритма плода [18]. Планирование, наблюдение и ведение беременности у больных с эпилепсией должны начинаться с прегравидарной подготовки (ПП) к беременности.
Планирование беременности возможно при стойкой медикаментозной ремиссии более 3 лет, наличие эпилепсии с редкими генерализованными и вторично генерализованными припадками — не более одного генерализованного тонико-клонического припадка (ГТКП) в год, с редкими комплексными фокальными эпилептическими припадками (ЭП) (без амбулаторных автоматизмов и падений) — не более одного в квартал.
При планировании беременности обязательным условием является предотвращение ВПР и аномалий у плода, связанных с тератогенным воздействием ПЭП. Для этого показано назначение фолиевой кислоты до зачатия (за 2—3 мес) и на протяжении I триместра беременности (до 13 нед) [9, 14, 19, 20], но при этом назначение препаратов фолиевой кислоты не должно быть бесконтрольным, поскольку высокий уровень фолатов в сыворотке крови (при явлениях передозировки витамина В5) является ФР провокации Э.П. Необходимо помнить, что у женщин, страдающих эпилепсией, при приеме ПЭП, обладающих энзиминдуцирующими свойствами (карбамазепин, барбитураты), возможно повышение уровня печеночных ферментов (ЛДГ, аспартатаминотрансфераза — АсАТ, аланинаминотрансфераза — АлАТ, ГГТ, ЩФ) в крови, поэтому необходима оценка уровня этих ферментов [16, 18, 21, 22].
Медицинскими показаниями к прерыванию беременности являются труднокурабельная эпилепсия, статусное течение эпилепсии и выраженные изменения личности (эпилептические психозы, проявление агрессии, эгоцентризм, злобность), представляющие угрозу для жизни матери и плода [19, 22], однако в современном акушерстве данные показания являются относительными, так как прерывание беременности можно осуществить только при согласии женщины. При этом врач должен сделать запись в амбулаторной карте о противопоказании к сохранению беременности и ознакомить пациентку с возможностью возникновения осложнений [14, 15, 18].
При наступлении беременности необходимо тщательное наблюдение за беременной. При компенсированном течении заболевания с ремиссией эпилептических приступов регулярность посещения невролога-эпилептолога составляет 1 раз в 2 мес, с консультацией невролога в сроки 33—35 нед для решения вопроса о родоразрешении [20, 21, 23]. Акушера-гинеколога беременные посещают в установленные сроки согласно принятым нормативам [24].
Диагностика эпилепсии у беременных не вызывает затруднений и не отличается от таковой у больных вне беременности, включает сбор анамнеза у больной и/или у лиц, наблюдавших судороги [25, 26].
Дифференциальную диагностику эпилепсии необходимо проводить с гипоксически-ишемическими состояниями, энцефалитом, синдромом отмены препаратов, метаболической энцефалопатией, структурными повреждениями мозга, психическими заболеваниями, токсическим эффектом лекарственных средств, с истерическими (конверсионными) приступами, синкопальными состояниями, эклампсией [22, 23, 27].
Акушеру-гинекологу важно уметь отличать ЭП от судорог при эклампсии. ЭП предшествует аура, после которой наблюдается кратковременное бессознательное состояние, отсутствуют изменения в анализе мочи, отмечается длительное сужение зрачков, возможно непроизвольное мочеиспускание, сухожильные рефлексы понижены [3, 4, 28], а при эклампсии — сухожильные рефлексы повышены, наблюдаются мелкие фибриллярные подергивания мышц лица с дальнейшим распространением на верхние конечности (при эпилепсии не бывают), тонические сокращения всей скелетной мускулатуры, потеря сознания, апноэ, цианоз, прикус языка, продолжительность судорог до 30 с, клонические судороги распространяются на нижние конечности, затем следуют глубокий вдох, восстановление дыхания, сознания и полная амнезия [22—24, 29].
Особое внимание следует обратить на лабораторные исследования — биохимический анализ крови: определение общего белка, белковых фракций, калия, натрия, билирубина, АлАТ, АсАТ, амилазы, креатинина, мочевины, кальция, магния. С учетом негативного влияния ПЭП на фолатный обмен рекомендуется определение уровня фолиевой кислоты, гомоцистеина, цианокобаламина в сыворотке крови за 3 мес до планируемой беременности и в I триместре беременности [30—32]. Новым методом является исследование фармакогенетических маркеров чувствительности к ПЭП, вальпроевой кислоте — определение полиморфизма генов изоферментов цитохрома Р450 печени CYP2C9*2, CYP2C9*3, CYP2A6, CYP2B6, CYP1A1, CYP2D6, CYP2E1 (1), CYP2E1 (2), к карбамазепину — определение полиморфизма генов цитохромов CYP3A4, CYP3A5, гена транспортера MDR1 (C3435T); к ламотриджину — полиморфизма гена глутатион-S-трансферазы (mGSTM1 и tGSTT1), гена глутатион-S-трансферазы n (1) и n (2), гена натриевого канала (SCN1VS5N
) и гена уридинфосфат-глюкуронозилтрансферазы (UGT1A4) [31—34]. Согласно приказу МЗ РФ № 572н от 01.11.12 «Об утверждении порядка оказания медицинской помощи по профилю «акушерство и гинекология» (за исключением использования вспомогательных репродуктивных технологий)» в сроке 11—14 нед гестации проводятся иммуноферментный анализ (ИФА) и ультразвуковое исследование (УЗИ) для обнаружения дефекта нервной трубки, а в 18—21 нед беременности выполняется УЗИ для исключения ВПР и ультразвуковых маркеров хромосомных мутаций у плода. Учитывая высокий риск развития фетоплацентарной недостаточности, необходимо выполнить допплерометрическое исследование кровотока плода [8, 9]. Проведение ЭЭГ и определение концентрации ПЭП в крови носят рекомендательный характер, так как не регламентируются данным приказом, если же наблюдаются приступы во время беременности, то выполняют эти исследования при каждом обращении пациентки к неврологу.
По данным Европейского регистра эпилепсии и беременности [35], ГТКП регистрируются у 15,2% беременных. Ухудшение контроля над ЭП в течение I и II триместров беременности отмечается в 15,8% наблюдений, риск ЭП во время родов составляет примерно 2,5%, при этом вероятность его наступления выше при наличии ГТКС в течение беременности [33, 36—39].
ПЭП согласно классификации категорий риска для плода (FDA) разделяются на три категории: C — риск не исключен, D — риск доказан и X — противопоказаны при беременности. Препараты, категории С — представители второго поколения ПЭП (ламотриджин, этосуксимид, леветирацетам, окскарбазепин, лакосамид, зонисамид, перампанел, тиагабин) [30, 34, 40, 41]. Они не дают выраженный тератогенный эффект, но могут вызывать различные дефекты развития плода, задержку внутриутробного развития, пороки развития сердечно-сосудистой системы (дефект межжелудочковой перегородки, клапанные аномалии), висцеральные аномалии (перампанел), задержку оссификации (ламотриджин) и прочее. Препараты первого поколения (вальпроевая кислота, карбамазепин, фенобарбитал, клоназепам) могут вызывать более грубые врожденные дефекты и пороки в виде расщелин твердого неба, краниофациальные дефекты, скелетные аномалии, дефекты коагуляции, дефекты развития нервной трубки, spina bifida [38, 42—44].
Риск развития врожденных пороков и аномалий в 2—3 раза выше у детей, рожденных матерями, которые лечились от эпилепсии во время беременности [3, 39, 40]. Все ПЭП проникают через плаценту и имеют определенный тератогенный потенциал, но концентрация препарата в разные сроки беременности варьирует в результате связывания с белками плазмы и метаболизма. При этом наблюдается снижение концентрации препарата по мере увеличения срока беременности. К моменту родов она падает до минимального уровня и в течение последующих 8 нед возвращается к исходному уровню [34, 40, 45, 46].
Эпилепсия не является противопоказанием к родам через естественные родовые пути. Выполнение кесарева сечения возможно только при возникновении эпилептического статуса, учащении эпилептических припадков в предродовом периоде и при отрицательной динамике в состоянии плода. Однако в настоящее время данные противопоказания являются относительными, и прерывание беременности можно осуществлять только при согласии женщины. Досрочное родоразрешение проводится при серийных эпилептических приступах или при эпилептическом статусе [7—10, 39].
При выборе обезболивания родов предпочтение отдается эпидуральной анестезии, но при нарушении циркуляции спинномозговой жидкости с вовлечением ликвороциркуляторных пространств ее проведение противопоказано. Возможно применение общих (центральных) анестетиков с низким эпилептогенным потенциалом. Не рекомендуется использование диссоциативных анестетиков — кетамина и его аналогов, а также галогенсодержащих ингаляционных анестетиков (галотана, севофлюрана, десфлюрана и др.) в связи с имеющимся у них проконвульсантным эффектом и высоким риском срыва ремиссии эпилепсии в раннем послеродовом периоде [37, 38, 43, 44].
В раннем (7 дней) и позднем (3 мес) послеродовом периоде женщинам рекомендуется регулярно продолжать принимать ПЭП, так как существует риск декомпенсации эпилепсии. Стоит опасаться интоксикации ПЭП вследствие кровопотери в родах и возникающего после родов снижения общей массы тела родильницы. При появлении сонливости, нистагма и атаксии следует срочно проверить концентрацию ПЭП в крови и рекомендовать больной возвратиться к суточной дозе препарата, применявшейся до беременности [21, 22, 45].
Решение о грудном вскармливании принимается в индивидуальном порядке. Прием ПЭП не является абсолютным противопоказанием к грудному вскармливанию, но если женщина принимает препараты с седативным эффектом (фенобарбитал или бензодиазепин), то обязательно следует следить за состоянием ребенка для исключения чрезмерной седации. Кормление осуществляется в положении лежа, чтобы избежать возможного падения во время припадка [20, 21, 45, 46]. Организация режима сна и бодрствования, избежание сокращения продолжительности ночного сна становятся важными шагами для предотвращения ЭП [26, 46, 47].
Таким образом, эпилепсия может оказать негативное влияние на исход беременности, и беременность может ухудшать течение заболевания; фармакотерапия может влиять на здоровье новорожденного. Женщинам репродуктивного возраста следует рекомендовать планировать беременность только после тщательного консультирования эпилептологом, взвешивания степени риска вынашивания беременности.
Сведения об авторах
Зиганшин А.М. — к.м.н., доцент; е-mail; https://orcid.org/0000-0001-5474-1080;
Кулавский В.А. — д.м.н., проф.; е-mail; https://orcid.org/0000-0001-5438-6633;
Вашкевич А.Г. — e-mail
*e-mail; https://orcid.org/0000-0001-5474-1080
Преэклампсия и эклампсия у пациенток с эпилепсией
Эклампсия рассматривается как состояние, характеризующееся развитием одного и более генерализованного судорожного приступа у женщины с преэклампсией. В половине случаев эклампсия развивается до родов, частота ее появления в период родов и в послеродовом периоде примерно одинакова.
Преэклампсия характеризуется артериальной гипертонией с протеинурией и отеками во второй половине беременности. Диагноз тяжелой преэклампсии ставят при наличии одного из следующих критериев:
повышение систолического АД более 160 мм рт. ст. либо диастолического АД более 110 мм рт. ст., зарегистрированное дважды с интервалом более 6 ч;
потеря белка с мочой более 5 г/сут или резко положительный результат экспресс-анализа мочи на белок;
олигурия (количество мочи ниже 400 мл/сут);
сильная головная боль (вследствие отека мозга) или нарушение зрения (вследствие отека сетчатки или спазма артерий сетчатки);
признаки отека легких и цианоз.
Тяжелая преэклампсия — показание к немедленному родоразрешению. Судороги при эклампсии следует расценивать как спровоцированные, возникающие на фоне острого повреждения головного мозга. Энцефалопатия при эклампсии развивается вследствие нарушения ауторегуляции мозгового кровотока и повышения проницаемости капилляров. Это приводит к отеку головного мозга, развитию множественных микрогеморрагий и диссеминированного внутрисосудистого свертывания, что и служит причиной приступов. Риск эклампсии не всегда пропорционален тяжести артериальной гипертонии. У молодых первородящих с исходной артериальной гипотензией эклампсия может развиться при среднем АД 120–130 мм рт. ст. Поэтому во всех случаях преэклампсии требуется эффективная гипотензивная терапия, несмотря на то, что это не оказывает существенного влияния на переход в эклампсию. Из гипотензивных препаратов не следует назначать вазодилататоры, поскольку они обладают способностью усиливать нарастание перфузионного отека мозга.
Другое направление терапии — контроль над приступами. В прошлом с целью купирования приступов использовали бензодиазепины, фенитоин. В настоящее время наиболее эффективным средством считается раствор сульфата магния. В качестве профилактического средства при тяжелой преэклампсии в дородовом периоде сульфат магния можно вводить внутримышечно, при наличии судорог — внутривенно. Препарат вводят внутривенно струйно медленно в дозе 4 г (16 мл 25% раствора), а затем — по 1 г (4 мл 25% раствора) каждый час в течение суток. В первые сутки может понадобиться дополнительное введение 2–4 г сульфата магния при продолжении приступов. В дальнейшем переходят на внутримышечное введение препарата.
При проведении терапии следят за уровнем выделения мочи (более 100 мл/ч), частотой дыхательных движений (более 12 в мин) и сохранностью сухожильных рефлексов. Изменение этих показателей свидетельствует о токсическом действии сульфата магния. Для коррекции дозировки используют внутривенное струйное введение 10 мл 10% раствора глюконата кальция. Не следует вместе с сульфатом магния назначать блокаторы кальциевых каналов (нифедипин) в связи с общностью механизмов действия этих препаратов.
При неэффективности терапии сульфатом магния используют дополнительное введение раствора диазепама 10 мг 1–2 р./сут. Отсутствие эффекта такой терапии свидетельствует о необходимости применения внутривенного барбитурового наркоза.
Медицинские интернет-конференции
Введение.
Эпилепсия — хроническое заболевание головного мозга, характеризующееся наличием эпилептогенного очага и спонтанно наступающими судорожными или бессудорожными припадками. По статистике эпилепсией страдают до 3% населения, это одно из наиболее распространенных неврологических заболеваний.
Также у пациентов, страдающих эпилепсией, часто отмечают нарушение репродуктивной функции. Так, например, у мужчин с диагнозом эпилепсия нередко наблюдается снижение качества эрекции и субфертильность. Возможны различные комбинации факторов, которые в совокупности вызывают эректильную дисфункцию при эпилепсии. Эндокринные нарушения могут быть вызваны аномальным функционированием гипоталамо-гипофизарной системы при эпилептических разрядах головного мозга, а выделение противосудорожных препаратов и их метаболитов в семенную жидкость может привести к астенозооспермии.
Цель.
Оценка влияния эпилепсии на мужскуюрепродуктивную функцию.
Материалы и методы.
Было произведено обследование 30 пациентов мужского пола, страдающих эпилепсией, ввозрасте от 23 до 40 лет. Все отобранные для исследования пациенты были разделены на 2 группы. В группе I состояли 14 пациентов с врожденной аномалией центральной нервной системы. Во II группу вошли 16 пациентов с посттравматической эпилепсией. Наряду с этим была сформирована отдельная, сопоставимая по возрасту контрольная группа соматически и неврологически здоровых мужчин в количестве 15 человек.Информация об эректильной функции мужчин была получена при заполнении анкеты МИЭФ-5 (Международный индекс эректильной функции). Суррогатным критерием фертильности исследуемых мужчин служила спермограмма. При статистической обработке применялись тест Манна-Уитни и критерий хи-квадрат.
Результаты.
В группе I была отмечена статистически значимая разница с контрольной группой по двум оцениваемым параметрам (эректильная функция и качество спермы); в ней достоверно чаще встречалась астенозооспермия (71.4% против 20%, p< 0.05) и эректильная дисфункция (медиана МИЭФ-5 13.5 против 23.2, p< 0.01).В группе II статистически значимой разницы с контрольной группой не наблюдалось.
Заключение.
По результатам исследования удалось выяснить, что эректильная дисфункцияи нарушения фертильности встречаются чаще у людей, больных эпилепсией с детского или подросткового возраста, чтоможет быть обусловлено глубокими нарушениями нейроэндокринной регуляции под влиянием длительно существующего эпилептоидного очага и продолжительным воздействием противоэпилептических средств.