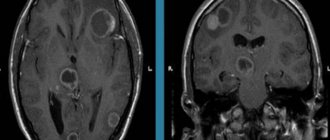
МРТ: Т1-взвешенный осевой вид. Красная стрелка (1) указывает на правое полушарие головного мозга, (2) — серое вещество, (3) — белое вещество
Изменения головного мозга на МРТ могут быть вызваны различными причинами. Специалисты уверены: чем раньше выявить болезнь и начать лечение — тем больше шансов на благополучный исход. Магнитно-резонансное сканирование сосудов головы может быть выполнено большинству людей без каких-либо серьезных побочных явлений и отдаленных последствий. Современные контрастные вещества на основе хелатов гадолиния в 98% случаев не вызывают осложнений. Единственное серьезное препятствие к диагностической процедуре — присутствие металла в теле человека, что требует другого способа исследования, например, КТ.
- При каких заболеваниях появляются очаги в головном мозге на МРТ?
- Цены на МРТ мозга
Какие патологии головного мозга показывает МРТ?
Распределение белого и серого вещества и патологические процессы внутри головного мозга подробно иллюстрирует МРТ. Магнитное сканирование — один из высокоточных неинвазивных способов инструментальной диагностики у нейрохирургов, неврологов, и реже — психиатров. Анализ изменений в двух основных составляющих мозга — сером и белом веществе — важен для клинической диагностики и терапии огромного количества заболеваний: эпилепсии и эписиндрома, инсульта, болезни Альцгеймера, злокачественных и доброкачественных новообразований, рассеянного склероза, инфекционно-воспалительных процессов, посттравматических повреждений и пр.
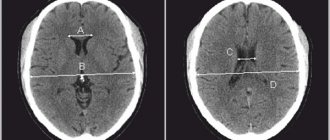
Распределение серого и белого вещества в головном мозге
Серое вещество
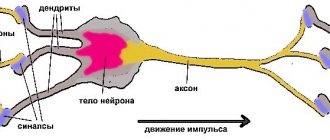
Серое вещество головного мозга отвечает за большинство функций высшей нервной деятельности и представлено телами нейронов, глиальными клетками, скоплением дендритов, тонкими мельчайшими кровеносными сосудами — капиллярами — и безмиелиновыми аксонами. Основные гистологические структуры — центры, каждый из которых контролирует какое-либо действие: акт мочеиспускания, дефекации, сердцебиение и пр. Нейрохирурги считают серый цвет условным, скорее, эта субстанция имеет землистый оттенок. Состав основных структур головного мозга четко различим, преимущественно из-за разницы содержания воды и белков. Это позволяет дифференцировать на томограммах одну зону от другой. Патологические процессы, локализованные в сером веществе, приводят к нарушению восприятия, речи, эмоций, памяти, сенсорной чувствительности, воли, мышечных движений и пр.
Белое вещество
Белый цвет обуславливают пучки нервных волокон, покрытых миелиновой оболочкой. Основное предназначение данной мозговой структуры — передача импульсов от главных центров к периферии (нижележащим звеньям нервной системы).
Диагностика
Реклама:
Поскольку дисциркуляторные очаговые изменения длительное время похожи на синдром хронической усталости, заболевание нуждается в точной диагностике. Диагноз устанавливается после тщательного обследования, а также полугодового наблюдения у невролога. Основанием для врачебного заключения о характере патологии является постоянное наличие основных симптомов.
При обращении врач назначает комплексное обследование, которое состоит из следующих методик:
- Лабораторные исследования. Проверяют состав крови, определяя наличие негативных факторов. Для этого необходимы общий и биохимический анализы крови, коагулограмма. Также определяют уровень холестерина и сахара.
- Постоянное мониторирование артериального давления.
- ЭКГ и ЭхоКГ.
- Эхограмма и электроэнцефалография мозга.
- МРТ.
- Обследование глазного дна.
Преимущества МРТ диагностики
В результате патологических дисциркуляторых изменений структурных тканей головного мозга, появляются характерные морфологические признаки. Диагностируются они с помощью магнитно-резонансных методов обследования: ядерный мр, магнитно-резонансная томография и ангиография.
МРТ обследование позволяет выявить очаги дисциркуляторной энцефалопатии, локализовать их точное местоположение и определить причину патологического изменения мозга.
Реклама:
- Диффузные преобразования коры больших полушарий. Провоцирующим фактором является врожденная или приобретенная патология церебральных или спинальных артерий (межпозвоночная грыжа шейного отдела, тромбоз артерий или сужение просвета).
- Множественное очаговое поражение тканей. Такая патология предшествует развитию инсульта. Это состояние характерно для старческой или патогенетической атрофии сосудов, сопровождающих деменцию, эпилепсию, атаксию.
- Возрастные микроочаговые изменения. Их появление характерно для тканей мозга после 55 лет, поскольку с возрастом структурные ткани все больше подвержены эндогенным изменениям. На МРТ диагностируются только те микроповреждения, которые возникают в результате негативных внешних воздействий.
- Дисциркуляторные очаги в белом структурном веществе теменных или лобных долей. Причиной подобных изменений является гипертоническая болезнь с стадии обострения, либо такое строение ткани обусловлено формированием в периоде пренатального развития (врожденное).
Наличие очаговых изменений в головном мозге является основанием для проведения периодического профилактического осмотра не реже, чем раз в три месяца.
Какие заболевания головного мозга выявляет МРТ?
Изменения белого вещества на МРТ при различных патологиях
МРТ головного мозга проводят для диагностики:
- опухолей. МРТ — один из высокоинформативных методов в выявлении онкологических процессов в головном мозге, позволяет установить взаимоотношение новообразования с окружающими тканями;
- метастатических поражений (отсевы опухоли). Для многих злокачественных новообразований головной мозг — орган мишень.
- очагов, появившихся на фоне различных ангиопатий, гипертонии, атеросклероза, мигрени, гипергомоцистеинемии;
- воспалительных процессов, в том числе, аутоиммунной природы: рассеянного склероза, саркоидоза и пр.;
- инфекций: ВИЧ, туберкулеза, герпеса, нейросифилиса, микоплазмоза и пр.;
- посттравматических изменений после получения прямого удара по голове или для выявления очагов после проведения лучевой терапии, которая также рассматривается радиорентгенологами как альтерирующий фактор;
- различных метаболических расстройств, токсического поражения;
- инфарктов и инсультов, очагов ишемии, дисциркуляторной энцефалопатии (нарушение микроциркуляции крови проявляется гипоксическими/дистрофическими изменениями в головном мозге);
- сосудистых мальформаций;
- аномалий и пороков развития.
При каких заболеваниях появляются очаги в головном мозге на МРТ?
Принцип построения изображения при МРТ головного мозга основан на объединении множества срезов, размерами от 1 мм в единое целое, но каждый слой врач может оценить отдельно
Примером поражения серого вещества с образованием очагов может служить гетеротопия и наиболее частый ее вариант — субэпендимальная, которая ассоциирована с эпилепсией и задержкой развития. В диагностике данной патологии магнитно-резонансное сканирование головного мозга — преимущественное исследование. Эпилептические припадки могут появиться в зрелом возрасте, что требует исключения опухоли. Изменения в сером веществе находят при шизофрении (потеря плотности ткани в верхней лобной дольке, левой верхней височной извилине), биполярном расстройстве и пр. Очаги в головном мозге у больного, страдающего психическими расстройствами, находят часто, но основным критерием диагноза служат симптомы.
Дифференциация патологий белого вещества включает целый спектр заболеваний, но МРТ мозга также показывает участки, которые не всегда свидетельствуют о болезни и являются вариантом нормы у возрастных людей. Последние входят в понятие “доброкачественного старения мозга”. Деструктивные зоны могут встречаться на фоне гипоксии, ишемии. На МРТ изменения белого вещества мозга, связанные с очаговыми поражениями, находят при:
На снимке МРТ изменение белого вещества мозга: зеленые стрелки указывают на множественные демиелизированные очаги при рассеянном склерозе
- Рассеянном склерозе. РС — воспалительное (аутоиммунное) заболевание, приводит к появлению пятен в белом веществе головного мозга. Патогенез доподлинно неизвестен. Аналогичные участки находят при герпесвирусной инфекции, лейкоэнцефалопатии, интоксикациях, поэтому перед установкой диагноза данные томограмм всегда оценивают после анализа клинической ситуации и тестирования ликвора. Часто требуется проведение МРТ спинного мозга.
МРТ: острый рассеянный энцефаломиелит
- Остром диссеминированном энцефаломиелите. Мультифокальные поражения на томограммах появляются через 1,5-2 недели после контакта с возбудителем или вакцинации. В процесс могут быть вовлечены и другие структуры нервной системы. Лучшую визуализацию очагов обеспечивает контрастирование. Размер демиелинизированных участков больше, чем при рассеянном склерозе, заболевание чаще диагностируют в молодом возрасте.
МРТ: Нейроборрелиоз (клещевой энцефалит)
- Болезни Лайма. Магнитно-резонансное сканирование демонстрирует точечные очаги, похожую картину можно наблюдать и при аутоиммунных заболеваниях. Но для данной нозологии также типичны специфическая сыпь на кожном покрове и недомогание, напоминающее простуду, артралгии. На томограммах имеет место гиперинтенсивный сигнал со стороны спинного мозга и накопление парамагнетика в области корневой зоны VII пары черепно-мозговых нервов.
Саркоидоз на МРТ: желтыми стрелками указаны поражения оболочек, черепных нервов, подобные изменения присутствуют в стволе
- Саркоидозе головного мозга. Диагноз сложно установить только при магнитном сканировании, иногда окончательная верификация происходит после выполнения биопсии. Картина на томограммах напоминает изменения, характерные для рассеянного склероза.
Отрицательная динамика на томограммах, выполненных с интервалом в месяц при лейкоэнцефалопатии
- Прогрессирующей мультиочаговой лейкоэнцефалопатии. Патогенетический фактор — инфицирование вирусом Каннингема, страдают люди с иммуносупрессией (выраженные нарушения работы иммунной системы). Имеет место поражение дугообразных волокон белого вещества, при контрастировании отсутствует эффект накопления. Патологические очаги чаще локализуются с одной стороны, иногда видны симметричные изменения.
Причины появления очаговых изменений в мозге
Пожалуй, главной причиной очаговых изменений вещества мозга у взрослых людей можно считать возрастной фактор, а также сопутствующие ему заболевания. С годами происходит естественное старение всех тканей организма, в том числе, и мозга, который несколько уменьшается в размерах, клетки его атрофируются, местами заметны структурные изменения нейронов вследствие недостаточного питания.
Возрастное ослабление кровотока, замедление метаболических процессов способствуют появлению микроскопических признаков дегенерации в ткани мозга — очаговые изменения вещества мозга дистрофического характера. Появление так называемых гематоксилиновых шаров (амилоидных телец) напрямую связывают с дегенеративными изменениями, а сами образования представляют собой некогда активные нейроны, потерявшие ядро и накопившие в себе продукты белкового обмена.
Амилоидные тельца не рассасываются, они существуют много лет и обнаруживаются после смерти диффузно по всему мозгу, но преимущественно — вокруг боковых желудочков и сосудов. Их считают одним из проявлений старческой энцефалопатии, и особенно много их при деменции.
Гематоксилиновые шары могут образовываться также в очагах некроза, то есть после перенесенных инфарктов мозга любой этиологии, или травм. В этом случае изменение носит локальный характер и выявляется там, где ткань мозга была наиболее повреждена.
амилоидные бляшки в мозге при естественном старении или болезни Альцгеймера
Помимо естественной дегенерации, у возрастных пациентов заметный отпечаток на структуру мозга накладывает сопутствующая патология в виде артериальной гипертензии и атеросклеротического поражения сосудов. Эти заболевания ведут к диффузной ишемии, дистрофии и гибели как отдельных нейронов, так и целых их групп, подчас весьма обширных. В основе очаговых изменений сосудистого генеза лежит тотальное или частичное нарушение кровотока в отдельных участках мозга.
На фоне гипертонии страдает прежде всего артериальное русло. Мелкие артерии и артериолы испытывают постоянное напряжение, спазмируются, стенки их утолщаются и уплотняются, а результатом становятся гипоксия и атрофия нервной ткани. При атеросклерозе также возможно диффузное поражение мозга с формированием рассеянных очагов атрофии, а в тяжелых случаях происходит инсульт по типу инфаркта, и очаговые изменения носят локальный характер.
Очаговые изменения вещества мозга дисциркуляторного характера как раз и связывают с гипертонией и атеросклерозом, которыми страдает едва ли не каждый пожилой житель планеты. Они выявляются на МРТ в виде рассеянных участков разрежения мозговой ткани в белом веществе.
Очаговые изменения постишемического характера вызваны предшествующей тяжелой ишемией с некрозом мозговой ткани. Такие изменения свойственны для инфарктов мозга и кровоизлияний на фоне гипертонии, атеросклероза, тромбоза или эмболии сосудистого русла мозга. Они носят локальный характер в зависимости от расположения участка гибели нейронов, могут быть едва заметными или довольно крупными.
Атеросклероз – причина снижения поступления крови в мозг. При хроническом процессе развиваются мелкоочаговые/диффузные изменения мозговой ткани. При острой закупорке может развивается ишемический инсульт с последующим формированием у выжившего пациента некротического очага
Помимо естественного старения и сосудистых изменений, к очаговому повреждению мозговой ткани могут приводить и другие причины:
- Сахарный диабет и амилоидоз — вызывают дегенерацию преимущественно сосудистого генеза вследствие гипоксии и метаболических расстройств;
примеры очагов демиелинизации при рассеянном склерозеВоспалительные процессы и иммунопатология — рассеянный склероз, саркоидоз, васкулиты при ревматических болезнях (системная красная волчанка, например) — возникает как демиелинизация (потеря оболочек отростками клеток), так и расстройство микроциркуляции с ишемией;
- Инфекционные поражения — токсоплазмоз, «медленные инфекции» (болезнь Крейтцфельда-Якоба, Куру), герпесвирусный энцефаломиелит, боррелиоз, клещевые вирусные энцефалиты, ВИЧ-инфекция и др. – в основе очаговых изменений лежит непосредственное цитопатическое действие возбудителей, гибель нейронов с формированием диффузных рассеянных очагов, воспаление и некроз;
- Остеохондроз и врожденная патология позвоночника и сосудов, влекущая ишемические изменения и снижение кровотока;
примеры очагов лейкоареоза мозгаОстрые и хронические интоксикации наркотическими веществами, алкоголем, угарным газом — происходит диффузная необратимая дистрофия и гибель нейронов;
- Травмы головного мозга — очаговые изменения локального характера в месте приложения травмирующего фактора либо диффузные участки демиелинизации и Микроинфарктов при тяжелых ушибах;
- Метастатическое поражение мозга при опухолях других органов;
- Врожденные изменения и перенесенная перинатальная тяжелая гипоксия — рассматриваются в разрезе патологии раннего детского возраста и представляют собой множественные очаговые изменения нервной ткани преимущественно вокруг боковых желудочков (лейкоареоз и лейкоэнцефаломаляция).
Дистрофические изменения головного мозга на МРТ
Церебральная ангиография
При нарушении кровоснабжения развивается кислородное и трофическое голодание клеток (ишемия). Это приводит к дегенеративным процессам и сопровождается дисфункцией. Степень выраженности последней вариативна, зависит от того, полностью ли не поступает кровь или сохраняется частичный ее приток. Дистрофические изменения могут быть локальными или диффузными. Тотальное поражение головного мозга регистрируют при менингите, энцефалите, очаговые изменения типичны для кист, небольших ишемических процессов, формировании посттравматических рубцов.
Клинические проявления могут включать:
- головную боль;
- высокое кровяное давление;
- появление парестезий (ощущение онемения или покалывания в конечностях), выпадение чувствительности;
- ухудшение зрения (вплоть до слепоты, что свидетельствует о поражении зрительного нерва), памяти, снижение интеллектуальных способностей;
- бессонницу;
- гиперкинезы (неконтролируемые сокращения мышц) и судороги.
При прогрессировании патологии ожидаемы парезы и параличи, поэтому важно при первых симптомах неблагополучия сделать МРТ сосудов головного мозга. Единичные очаги могут выявляться у молодых мужчин и женщин и не всегда свидетельствуют о патологии. Тактика врача- динамическое наблюдение и проведение повторного магнитного сканирования через 3-6 месяцев, что позволит не пропустить развитие какого-либо серьезного заболевания, например, рассеянного склероза. В возрасте старше 60-65 лет очаги находят практически у всех пациентов, что объясняют естественным старением. Эти изменения необратимы, но прогрессирование процесса можно замедлить при назначении адекватного лечения.
К провоцирующим факторам относят:
- хронические алкогольную и никотиновую интоксикацию;
- стрессовые ситуации;
- нерациональный режим труда и отдыха;
- ожирение;
- низкую двигательную активность;
- стойкое повышение артериального давления;
- сахарный диабет;
- гиперхолестеринемию.
Вид дистрофических нарушений в сером и белом веществе головного мозга на МРТ будут зависеть от характера патологического процесса.
Характер патологии
Весь головной мозг пронизан разветвленной системой кровоснабжения. Она состоит из четырех главных магистральных артерий, от которых расходятся мелкие сосуды, проникающие во все структуры мозга. Нарушение кровотока (дисциркуляция) в некоторых участках мозга приводит к его кислородному голоданию, стремительной очаговой деградации нейронов и клеток мозга.
Выделяют два типа патологии:
- Ишемический
(резидуального характера). В результате закупорки или сужения артерий и сосудов, происходит диффузное поражение структурных тканей мозга. Ишемию кровеносной системы, снабжающей головной мозг, может спровоцировать атеросклеротическая болезнь или тромбоз. Нарушения постишемического характера опасны внезапным стремительным развитием. Одно из проявлений этого типа патологии — болезнь Бинсвангера. - Мультиинфарктный
(сосудистого генеза). Перепады артериального давления провоцируют резкое сужение и расширение кровеносных магистралей. Это вызывает мелкие инфаркты (микроинсульты) сосудов, последствием которых является необратимое изменение мозгового вещества на небольшом участке. Виновником такого состояния являются артериальная гипертензия, мерцательная аритмия.
Группа риска
Реклама:
Раньше дисциркуляторная энцефалопатия являлась заболеванием, характерным для пожилых людей. Сейчас заболевание значительно помолодело, с 50 до 30 лет
. Оно может развиться у людей, ведущих малоактивный образ жизни, имеющих вредные пристрастия (курение, алкоголь, наркотические вещества, переедание).
Частые головные боли, головокружение и нарушение зрения — симптомы повышенного внутричерепного давления. Могут указывать на тяжелое структурное повреждение вещества мозговой ткани. Подробнее читайте в статье: «признаки внутричерепного давления у взрослых».
Лица, страдающие сахарным диабетом I и II типа, гиперхолестеринемией или имеющие генетическую предрасположенность, также подвержены риску возникновения очаговых деструктивных изменений структурных тканей мозга.
У мужчин чаще, чем у женщин, заболевание может появиться на фоне постоянного стресса или психоэмоционального перенапряжения.
Сосудистые изменения головного мозга на МРТ
МРТ: зона ишемии при инсульте (выделена красным овалом)
При подозрении на цереброваскулярную патологию особое внимание при МРТ головного мозга уделяют состоянию артерий. Исследование всегда подразумевает введение контраста, и оно носит название магнитно-резонансной ангиографии. В ургентных ситуациях при сосудистых катастрофах выполняют КТ, так как рентгенодиагностика занимает меньшее количество времени и четко демонстрирует зону повреждения при кровоизлияниях, но после стабилизации самочувствия проведение магнитно-резонансной ангиографии вполне обосновано. Исследование показывает атеросклеротические бляшки, тромбы и аневризмы (выпячивания), их локализацию, деформацию стенок.
При ишемическом инсульте практически сразу на магнитных томограммах видны затемненные и размытые зоны неправильной формы, появляющиеся на компьютерном сканировании лишь к концу первых суток. Поражение чаще одностороннее. Излитие крови из разорвавшегося сосуда дает интенсивную светлую окраску, но только в первый час-полтора с момента катастрофы, а далее на МРТ становится невидимым, хотя отчетливо визуализируется при использовании КТ. Последствием перенесенного инсульта формируется псевдокиста, заполненная жидкостью, проявляется деформация нервных тканей. МРА незаменима в диагностике ангиогенеза опухоли. Усиленная васкуляризация патологического очага всегда подозрительна на злокачественное новообразование, которое растет и питается за счет повышенного притока крови. Если сосуды не успевают за ростом опухоли, появляются участки ишемии, некроза.
Острая почечная недостаточность (ОПН) является тяжелым жизненно-опасным осложнением. В урологической практике ОПН может развиваться после операции на единственной почке по поводу мочекаменной болезни, злокачественной опухоли, вазоренальной гипертонии, а также при инфекционно-токсическом шоке. Одним из новых направлений, способных помочь в профилактике и лечении этого состояния, является применение современных клеточных технологий с использованием низкодифференцированных (стволовых, прогениторных) клеток, способных стимулировать регенерацию поврежденных клеточных структур и тем самым способствовать ускорению восстановления функциональной полноценности органа.
Показано, что внутривенное или интрапаренхиматозное введение культивированных мезенхимных стволовых клеток костного мозга, жировой ткани или плодной почки уменьшает смертность животных при ОПН, вызванной ишемическим повреждением и ускоряет восстановление ее функциональной активности [1-3]. При этом терапевтический эффект связывают с действием комплекса биологически активных веществ (факторы роста, цитокины, хемокины, ангиогенные факторы), секретируемых этими клетками, которые объединяют термином «секретом» [4,5], тогда как непосредственному замещению введенными клетками поврежденных собственных клеток органа придается небольшое значение, поскольку их включение в тканевые структуры не превышает 1% [6,7].
В связи с этим ведутся исследования по изучению возможности стимуляции регенерации поврежденных органов непосредственно гуморальными факторами, выделяемыми стволовыми клетками. Включение этих факторов в коллагеновые матрицы улучшают функциональные результаты заместительной пластики мочевых путей [812]. Комплекс «секретома» культивируемых мезенхимных стволовых клеток жировой ткани и коллагенового геля при инъекции в крипторхированное яичко способствует регенерации сперматогенного эпителия и восстановлению нарушенного сперматогенеза [13,14].
Другим возможным подходом к стимуляции регенерации поврежденных органов с использованием биологически активных веществ, продуцируемых стволовыми клетками является выделение комплекса биологически активных веществ из тканей эмбрионов животных, которые богаты стволовыми клетками. Имеются данные, что применение белково-пептидного комплекса (БПК), выделенного из головного мозга эмбрионов свиней (препарат Целлекс) способствует регенерации поврежденных нервных структур и ускорению восстановления функции ЦНС после инсульта или хронических заболеваний головного мозга [15-17], и это в значительной степени связано со способностью этого препарата стимулировать регенерацию [18].
Учитывая эти данные, а также органо-неспецифический характер действия секретома стволовых клеток, мы посчитали целесообразным изучить терапевтический эффект БПК мозговой ткани эмбрионов свиньи при экспериментально вызванной постишемической ОПН с оценкой влияния этой терапии на динамику восстановления функциональных показателей и выраженность морфологических признаков повреждения органа.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проведены на 46 белых беспородных крыса-самцах массой 300-360 г. Крыс вводили в наркоз внутрибрюшинным введении смеси препаратов Золетил и Ксилавет в соотношении 1:1 при расчетной дозе Золетила 15 мг/кг. После выполнения срединной лапаротомии выделяли из жировой капсулы левую почку и ее сосудистую ножку. С помощью микрохирургической зажима-клипсы пережимали почечную артерию и вену на 60 минут. Ишемизированную почку возвращали в брюшную полость. Производили правостороннюю нефрэктомию. На время ишемии брюшную полость закрывали, чтобы избежать охлаждения животного. После окончания срока ишемии восстанавливали кровоснабжение левой почки, удаляя микрососудистый зажим. После констатации возобновления кровоснабжения брюшную полость орошали водным раствором 0,06% хлоргексидина для профилактики инфекционных осложнений и ушивали ее двухрядным обвивным швом атравматической нитью Викрол 4/0 (на мышечную стенку) и 2/0 (на кожу).
В 1-й (контрольной) серии (20 крыс) терапевтических мероприятий не проводили, а во 2-й (опытной) серии (20 крыс) животным вводили БПК, выделенный из головного мозга эмбрионов свиньи, содержащий хроматографически выделенный комплекс сигнальных пептидов и белков с молекулярным весом от 10 до 250 кДа, относящихся к факторам роста и дифференцировки клеток (активный компонент препарата «Целлекс» производства АО «Фарм-Синтез»). БПК вводили ежедневно подкожно в дозе 0,1 мл/кг массы тела (0,1 мг/кг активного вещества) 5 дней в неделю, всего 10 инъекций. Шесть интактных крыс служили контролем для получения нормальных значений изучаемых биохимических и гистологических показателей.
Животных 1-й и 2-й групп обследовали на 3-й, 7-й и 14-й дни после моделирования ОПН. Для этого их помещали в обменные клетки на сутки для сбора суточной мочи. После этого брали пробы крови для биохимического исследования и на 14 сутки удаляли ишемизированную почку для гистологического исследования. При этом определяли степень ее гипертрофии взвешиванием.
Биохимическое исследование крови и мочи проводили на биохимическом анализаторе «ADVIA-2000» с определением следующих показателей: концентрация креатинина, мочевины, натрия, калия, кальция в крови и моче, белка в моче. На основании биохимических данных рассчитывали показатели функционального состояния ишемизированной почки – клубочковую фильтрацию (по клиренсу эндогенного креатинина), канальцевую реабсорбцию натрия и кальция, фильтрационный заряд, количество реабсорбированного натрия и кальция, суточную экскрецию креатинина.
Морфологическое исследование удаленной почки проводили по стандартной методике с окрашиванием парафиновых срезом гематоксилином и эозином.
Статистический анализ цифровых данных проводили с помощью программ MS Exel и Statistica 6.0. Определяли средние значения показателей в группах и ошибку средней (М±m), для определения достоверности различий между группами использовали критерий Стьюдента. Различия считали статистически значимыми при p<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Все животные обеих групп выжили в течение всего срока наблюдения.
Определение степени гипертрофии единственной ишемизированной почки показало, что ее масса к 14 суткам постишемического периода возросла в контрольной серии с 1,56±0,07 г (средняя масса одной интактной почки) до 1,80±0,05 г, тогда как в опытной серии (терапия БПК) масса почки увеличилась до 2,55±0,06 г. Различия между группами оказались статистически высокодостоверными при р<0,001. Таким образом, терапия БПК эмбриональных тканей способствует стимуляции компенсаторной гипертрофии единственной ишемизированной почки, причем ее масса к 14-м суткам достигает 81,8% от массы обеих почек в норме, тогда как в контроле гипертрофия почки составляет лишь 57,7% от массы обеих почек.
Анализ величины диуреза и основных биохимических показателей крови не выявил достоверных различий между группами по таким параметрам, как концентрация мочевины и креатинина, калия, натрия и кальция. В обеих группах через 3 суток после ишемического воздействия отмечалась умеренная полиурия (различия с нормальными значениями p<0,05), которая к 7 суткам имела тенденцию к нормализации, однако через 14 дней диурез вновь возрастал, превышая примерно в 2 раза нормальные значения (p<0,01) (табл. 1). Концентрация мочевины и креатинина в крови во все сроки наблюдения была достоверно выше нормальных значений, подтверждая развитие ОПН. В обеих группах выраженность подъема этих показателей была примерно одинаковой и с увеличением срока, прошедшего после ишемического воздействия, выявилась тенденция к их нормализации, однако, даже через 2 недели они оставались достоверно выше нормы. Динамика изменений уровня мочевины и креатинина в крови в 1-й и 2-й группах достоверно не различалась.
Таблица 1. Динамика диуреза и биохимических показателей крови в исследуемых группах Table 1. Dynamics of diuresis and biochemical blood parameters in studied groups
Примечание: достоверность различий по сравнению с нормальным значениями: *p<0,05, **p<0,01, ***p<0,001 Note: significance of differences compared to normal values: * p<0.05, ** p<0.01, *** p<0.001
В отношении концентрации натрия в крови в обеих группах выявилась тенденция к гипернатрийемии (p<0,05), но к концу периода наблюдения этот показатель полностью нормализовался в обеих группах. Концентрация кальция в крови в обеих группах достоверно не менялась на всех сроках исследования.
В то же время расчетные показатели функционального состояния почки оказались достоверно лучше в опытной серии (табл. 2).
Таблица 2. Показатели функционального состояния почек в сравниваемых группах Table 2. Indicators of the functional state of the kidneys in the compared groups
Примечание: Достоверность различий по сравнению с нормой: *p<0,05, **p<0,01, ***p<0,001. Достоверность различий между 1-й и 2-й группами: #p<0,05, ##p<0,01 Note: Significance of differences compared with the norm: * p<0.05, ** p<0.01, *** p<0.001. Significance of differences between the 1st and 2nd groups: #p<0.05, ## p<0.01
Клубочковая фильтрация в обеих группах на 3-и сутки после ишемии достоверно снижалась, но в серии с терапией БПК в меньшей степени, чем в контрольной группе, хотя различия не достигли статистически значимой достоверности. Через 7 и 14 суток в контрольной серии опытов значения клубочковой фильтрации оставались достоверно ниже нормальных значений с тенденцией к постепенному восстановлению. При этом в опытной группе (терапия БПК) уже к 7-м суткам этот показатель полностью нормализовался и сохранялся на нормальных значениях до конца периода наблюдения. Различия между 1-й и 2-й группами на 7-е и 14-е сутки оказались статистически достоверными при p<0,05.
Реабсорбция натрия в почечных канальцах после ишемии в обеих группах также ухудшалась, но позднее, чем клубочковая фильтрация. В контрольной серии наибольшее снижение этого показателя отмечено на 7-е сутки с некоторым улучшением к 2-недельному сроку. В опытной серии уже через 3 суток после ишемии значения этого показателя достоверно не отличались от нормы и были достоверно лучше, чем в контрольной группе (p<0,05). Через 7 суток нарушение реабсорбции натрия возросло у крыс этой группы, но все же реабсорбция оставалась лучше, чем в контроле (p<0,05), а через 2 недели значения этого показателя в обеих группах не различались.
В отношении канальцевой реабсорбции кальция достоверные различия между группами отмечены через 3 суток после ишемического воздействия, когда значения этого показателя в опытной группе были ближе к норме, чем в контрольных опытах. В более позднем периоде значения канальцевой реабсорбции кальция оставались сниженными в обеих группах.
Степень реабсорбции электролитов в почечных канальцах в условиях ишемического повреждения может зависеть от нагрузки на структуры канальцев, отвечающих за этот процесс, показателем чего является фильтрационный заряд, то есть, количество профильтрованного в почечных клубочках количества того или иного электролита – в нашем исследовании натрия и кальция. Расчет этого показателя показал, что в отношении натрия в контрольной серии через 3 суток после ишемии отмечено двукратное снижение этого показателя с постепенным его восстановлением к 14-м суткам. В опытной серии через 3 суток его снижение было достоверно менее выражено (p<0,05) уже через 7 дней он нормализовался. В отношении фильтрационного заряда кальция отмечалась такая же картина: менее выраженное снижение через 3 суток после ишемии и нормализация через 7 и 14 суток. На всех сроках исследования эти показатели были достоверно лучше у животных, леченых БПК эмбриональной ткани. Их динамика соответствует динамике восстановления клубочковой фильтрации в ишемизированной почке.
Учитывая потенциальное влияние количества профильтрованного в клубочках натрия и кальция на процентный показатель их реабсорбции в почечных канальцах в условиях ишемического повреждения органа, мы провели расчет абсолютных значений реабсорбированного количества этих катионов путем умножения фильтрационного заряда на процент реабсорбированного катиона. Оказалось, что в контрольной группе количество реабсорбированного натрия в минуту на 3-и и 7-е сутки существенно снизилось (почти в 2 раза по сравнению с нормой) с тенденцией к восстановлению к 14 суткам после ишемии (рис. 1).
Рис. 1. Абсолютные значения реабсорбированного натрия в почечных канальцах (мкмоль/мин) в сравниваемых группах. *различия между группами достоверны при p<0,05 Fig. 1. Absolute values of reabsorbed sodium in the renal tubules (umol / min) in the compared groups. *differences between groups are significant at p<0.05
В опытной группе степень снижения этого показателя оказалась достоверно меньше и статистически не отличалось от нормы уже через 7 дней. Значения абсолютного количества реабсорбированного натрия во 2-й группе на всех сроках наблюдения были достоверно выше, чем в 1-й группе. Таким образом, несмотря на то, что в процентном отношении канальцевая реабсорбция натрия через 14 суток после ишемии была одинаковой, но абсолютное количество реабсорбированного натрия было выше во 2-й группе, что свидетельствует о лучшей сохранности канальцевого эпителия в почках крыс, леченых БПК.
Схожая ситуация имела место и в отношении реабсорбции кальция (рис. 2). Если по результатам определения процентного отношения реабсорбции кальция в почечных канальцах достоверные различия между 1-й и 2-й группами были отмечены лишь в первые 3 суток после ишемии, то при определении абсолютного количества раеабсорбированного кальция во 2-й группе значения были достоверно выше по сравнению с 1-й группой на всех сроках наблюдения, что также подтверждает лучшую сохранность канальцевого эпителия в почках крыс, леченых БПК.
Рис. 2. Абсолютные значения реабсорбированного кальция в почечных канальцах (мэкв/мин) в сравниваемых группах. *различия между группами достоверны при p<0,05 Fig. 2. Absolute values of reabsorbed calcium in the renal tubules (meq/min) in the compared groups. *differences between groups are significant at p<0.05
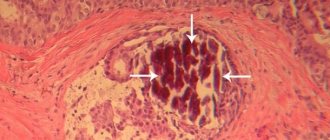
Лучшую сохранность почечных структур у крыс 2-й группы подтвердили морфологические исследования. В почках животных этой группы уже через 3 суток и в последующем обнаруживали до 20% гипертрофированных клубочков, тогда как у крыс контрольной группы гипертрофия клубочков выявлялась в более поздние сроки, достигая к 7 суткам в контрольной и опытной группах 50% об общего количества клубочков в препарате (рис. 3А). При этом через 3 суток до 5% клубочков контрольных крыс находилась в коллабированном состоянии, а к 14 суткам их доля возрастала до 15% при развитии признаков начинающегося гломерулосклероза. В опытной группе доля сморщенных клубочков не превышала 1% даже в поздние сроки наблюдения.
Рис. 3. Гипертрофированный клубочек в почке крысы 2-й группы через 3 суток после ишемии (А) и коллабированный клубочек с развивающимся гломеролуросклерозом в почке крысы 1-й группы через 7 суток после ишемии (Б). Окраска гематоксилином и эозином. Ув. 200х Fig. 3. Hypertrophied glomerulus in the kidney of a rat of the 2nd group 3 days after ischemia (A) and a collapsed glomerulus with developing glomerulurosclerosis in the kidney of a rat of the 1st group 7 days after ischemia (B). Hematoxylin and eosin stain. 200x magnification
Рис. 4. Нерезко выраженная дистрофия канальцевого эпителия в почках крыс 2-й группы (А) и участок некроза канальцев и гиалиновые цилиндры в их просвете в почках крыс 1-й группы. Окраска гематоксилином и эозином. Ув. 200х Fig. 4. Mildly pronounced dystrophy of the tubular epithelium in the kidneys of rats of the 2nd group (A) and the site of tubular necrosis and hyaline cylinders in their lumen in the kidneys of rats of the 1st group. Hematoxylin and eosin stain. 200x magnification
У крыс контрольной группы выявляли выраженные нарушения внутрипочечной микроциркуляции. Отмечалось резко выраженное расширение капилляров клубочков и перитубулярных капилляров с формированием эритроцитарных тромбов в их просвете, (рис. 5). У крыс 2-й группы дилатация капилляров была нерезко выражена.
Рис. 5. Резко выраженное расширение клубочковых и перитубулярных капилляров с формированием эритроцитарных тромбов. Окраска гематоксилином и эозином. Ув. 200х Fig. 5. A pronounced expansion of the glomerular and peritubular capillaries with the formation of red blood clots. Hematoxylin and eosin stain. 200x magnification
Рис. 6. Воспалительный инфильтрат (А) и очаговый интерстициальный фиброз в почках крыс 1-й группы (Б). Окраска гематоксилином и эозином. Ув. 200х Fig. 6. Inflammatory infiltrate (A) and focal interstitial fibrosis in the kidneys of rats of the 1st group (B). Hematoxylin and eosin stain. 200x magnification
В гистологических препаратах 1-й группы выявляли массивные воспалительные инфильтраты (рис. 6 А), тогда как во 2-й группе выраженной воспалительной реакции не обнаруживали. При этом в конце периода наблюдения (14 суток после ишемии) в препаратах выявляли очаговый интерстициальный фиброз, который была существенно более выражен в почках крыс 1-й группы (рис. 6 Б).
ОБСУЖДЕНИЕ
Результаты проведенного исследования убедительно показали, что при экспериментально вызванной ОПН путем ишемии единственной почки длительностью 60 минут, терапия БПК эмбриональной ткани способствует уменьшению выраженности функциональных расстройств и более быстрой нормализации функции органа. Этот эффект в значительной степени связан с ускорением развития компенсаторной гипертрофии ишемизированного органа, что проявляется в большей степени возрастания его массы по сравнению с контрольной серией опытов, приближаясь к 14-м суткам к массе обеих почек у интактных крыс. При этом при гистологическом исследовании в опытной серии выявляли гипертрофию значительной части клубочков (15% в ранние сроки и 50% к 14-м суткам), тогда как в контрольных опытах от 5% (на ранних сроках) до 15% (на поздних сроках) клубочков выглядели коллабированными с признаками развития гломерулосклероза. В соответствии с этим у крыс опытной серии определяли более высокие значения клиренса креатинина и лучшую азотовыделительную функцию органа, оцененную по суточной экскреции креатинина.
Степень повреждения почечных канальцев также была существенно менее выражена в опытной серии, что проявлялось в более высоких показателях канальцевой реабсорбции натрия и кальция, так и в морфологических признаках повреждения канальцевого эпителия.
Важным моментом является оценка возможных отдаленных последствий ишемического повреждения почки, проявляющихся в развитии нефросклероза, что потенциально может вести к формирования хронической почечной недостаточности. Наши исследования показали, что без терапии БПК через 14 суток после ишемии в контрольной серии опытов выявляются очаги интерстициального фиброза, замещающие поврежденную паренхиму органа. В опытной группе они выявлялись в единичных случаях и были менее значительными.
Таким образом, терапевтический эффект белковопептидного комплекса эмбриональной ткани, на наш взгляд, может быть связан со стимуляцией регенерации поврежденных клеточных структур и уменьшением их повреждения. Многие исследования подтверждают, что именно «секретом» и его аутокринные и/или паракринные эффекты стимулируют регенерацию поврежденных клеток [2,5,6,19,20]. Это в определенной степени может происходить за счет активации резидентных стволовых клеток, выявляемых в почках взрослого организма, и являющихся предшественниками как клеток клубочков (подоцитов, эндотелиоцито), так и канальцевого эпителия [21], которые могут замещать поврежденные клетки этих структур. Кроме того, выделяемый этими клетками комплекс биологически активных веществ также стимулирует пролиферацию дифференцированных клеток за счет механизма дедиференцировки и/или редифференцировки [22].
Другим потенциальным механизмом может быть противовоспалительный эффект гуморальных факторов, продуцируемых стволовыми клетками [3]. В нашем исследовании выявлено существенное уменьшение выраженности воспалительной реакции в ткани ишемизированной почки в постишемическом периоде при терапии эмбриональным БПК по сравнению с контрольными опытами, а в более отдаленном периоде – меньшая степень склерозирования ткани почки, что можно рассматривать как положительный фактор в отношении перехода ОПН в хроническую форму функциональной недостаточности.
Таким образом, проведенное исследование показало выраженный терапевтический эффект терапии БПК эмбриональной ткани у животных с экспериментально вызванной постишемической ОПН и целесообразность дальнейших исследований данного препарата в терапии острых и хронических функциональных расстройств органов моче-половой системы.
ЛИТЕРАТУРА
- Кирпатовский В.И. Возможности клеточной терапии в восстановлении нарушенной функции органов мочеполовой системы. Вопросы реконструктивной и пластической хирургии 2016;19 (1):60-67. .
- Duffield JS, Park KM, Hsiao LL, Kelley VR, Scadden DT, Ichimura T, et al. Restoration of tubular epithelial cells during repair of the postischemic kidney occurs independently of bone marrow-derived stem cells. J Clin Invest 2005;115(7):1743–1755.
- Chen YT, Sun CK, Lin YC, Chang LT, Chen YL, Tsai TH et al. Adipose-derived mesenchymal stem cell protects kidneys against ischemia-reperfusion injury through suppressing oxidative stress and inflammatory reaction. J Transl Med 2011;9:51. doi: 10.1186/1479-5876-9-51.
- Dittmer J, Leyh B. Paracrine effects of stem cells in wound healing and cancer progression (Review). Int J Oncol 2014;44(6):1789-98. doi: 10.3892/ijo.2014.2385.
- Bi B, Schmitt R, Israilova M, Nishio H, Cantley LG. Stromal cells protect against acute tubular injury via an endocrine effect. J Am Soc Nephrol 2007;18(9):2486-96.
- Humphreys BD, Czerniak S, DiRocco DP, Hasnain W, Cheema R, Bonventre JV. Repair of injured proximal tubule does not involve specialized progenitors. Proc Natl Acad Sci USA 2011;108(22):9226-31. doi: 10.1073/pnas.1100629108.
- Meyer-Schwesinger C. The role of renal progenitors in renal regeneration. Nephron 2016;132:101–109. doi: 10.1159/000442180.
- Камалов А.А., Кирпатовский В.И., Охоботов Д.А., Камалов Д.М., Карпов В.К. Коллагеновые биоматрицы в реконструктивной урологии. Урология 2015;(2):103-106. .
- Кулакова К.В., Бугров С.Н., Алейник Д.Я., Стручков А.А. Результаты применения разрабатываемых биологически активных материалов на основе коллагена для замещения тканевых дефектов в эксперименте. Технологии живых систем 2013;10 (8):59-64. [Kulakova K.V., Bugrov S.N., Alejnik D.Ja, Struchkov A.A. The results of the application of developed biologically active materials based on collagen to replace tissue defects in the experiment. Tehnologija zhivih system 2013;10(8):59-64. (In Russian)].
- Камалов Д.М. Заместительная пластика мочевых путей препаратами их коллагена 1 типа: Автореф. дисс. … канд. мед. наук. M. 2021. 31 с. . Cand. Med. Sci [thesis]. M. 2021. 31 p (In Russian)].
- Adamowicz J, Kowalczyk T, Drewa T. Tissue engineering of urinary bladder – current state of art and future perspectives. Cent European J Urol 2013;66(2): 202-6. doi: 10.5173/ceju.2013.02.art23.
- Jiang X, Xiong Q, Xu G, Lin H, Fang X, Cui D, et al. VEGF-loaded NanoparticleModified BAMAs enhance angiogenesis and inhibit graft shrinkage in tissue-engineered bladder. Ann Biomed Eng 2015;43(10):2577-86. doi: 10.1007/s10439-015-1284-9.
- Камалов А.А., Кирпатовский В.И., Охоботов Д.А., Ефименко А.Ю., Сагарадзе Г.Д., Макаревич П.И., и др. Использование нового материала на основе продуктов секреции мезенхимных стволовых клеток человека и коллагена для восстановления сперматогенеза на модели экспериментального крипторхизма. Технология живых систем 2017;14 (1):4-17. . Tehnologija zhivih system 2017; 14 (1):4-17. (In Russian)].
- Sagaradzea G.D., Basalova N .A., Kirpatovskiy V.I., Ohobotov D.A., Grigorieva O.A., Balabanyan V.Yu., et al. Application of rat cryptorchidism model for the evaluation of mesenchymal stromal cell secretome regenerative potential. Biomed Pharmacother. 2019;109:1428-1436. doi: 10.1016/ j.biopha.2018.10.174.
- Коваленко А.В., Сафронова М. Н. Влияние целлекса на восстановление когнитивных и речевых нарушений в остром периоде инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова 2015;115(1): 40-44. .
- Хасанова Д.Р., Данилова Т.В., Дёмин Т.В., Кини К.С., Гайфутдинова Л.В. Влияние препарата целлекс на восстановление двигательных и речевых функций в ранней нейрореабилитации пациентов, перенесших ишемический инсульт. Медицинский совет 2018;(9):14-19. .
- Камчатнов П.Р., Измайлов И.А., Соколов М.А. Результаты применения препарата Целлекс у больных с цереброваскулярными заболеваниями. Нервные болезни 2018; (1):26-30. .
- Стельмашук Е.В. Механизмы повреждения и защиты нейронов головного мозга при экспериментальном моделировании ишемии. Дисс… докт. биол. наук. М. 2012. 280 с. . M. 2012. 280 p. (In Russian)].
- Drago D, Cossetti C, Iraci N, Gaude E, Musco G, Bachi A, et al. The stem cell secretome and its role in brain repair. Biochimie 2013; 95(12):2271-85. doi: 10.1016/j.biochi.2013.06.020.
- van Koppen A, Joles JA, van Balkom BW, Lim SK, de Kleijn D, Giles RH, et al. Human embryonic mesenchymal stem cell-derived conditioned medium rescues kidney function in rats with established chronic kidney disease. PLoS One 2012; 7(6):e38746. doi: 10.1371/journal.pone.0038746.
- Кирпатовский В.И., Соколов М.А., Рабинович Э.З., Сивков А.В. Клеточные и гуморальные механизмы регенерации почки. Экспериментальная и клиническая урология 2017;(2):102-111. . Eksperimentalnaya i klinicheskaya urologiya 2017;2:102-111. (In Russian)].
- Sakamoto K, Ueno T, Kobayashi N, Hara S, Takashima Y, Pastan I, et al. The direction and role of phenotypic transition between podocytes and parietal epithelial cells in focal segmental glomerulosclerosis. Am J Physiol Renal Physiol 2014;306 (1):F98-F104. doi: 10.1152/ajprenal.00228.2013.
| Прикрепленный файл | Размер |
| 1.65 Мб |
‹ Показатель прогрессии злокачественного роста у больных с опухолевыми заболеваниями предстательной железы, мочевого пузыря, почек Вверх Редкое клиническое наблюдение миграции внутриматочной спирали в мочевой пузырь ›
Норма магнитно-резонансной томографии головного мозга
МРТ головного мозга, норма
Норма МРТ вещества головного мозга — относительное понятие, зависящее от возраста, пола пациента, изменения на томограммах обязательно сопоставляется с симптомами. Врач оценивает симметричность долей, размер желудочков, сосудов, равномерность их заполнения контрастным веществом, отсутствие новообразований, мальформаций и многое другое. Компьютерная программа выстраивает послойные изображения, после исследования их распечатывают на пленки и рассматривают, размещая на негатоскопе. Далее заполняется бланк заключения, где указывается предварительный диагноз. Самостоятельно вряд ли возможно без специальной подготовки расшифровать МРТ головного мозга: неопытный человек даже если и увидит какой-либо очаг, не разберется, что стало причиной его появления. Все вопросы можно задать врачу, проводившему исследование. В неясных ситуациях при неоднозначных результатах обосновано получение второго мнения. Часто пациенты прочитав в заключении слова “новообразование, опухоль, NEO”, пытаются сразу выяснить перспективы заболевания у рентгенолога, что терпит неудачу. На эти вопросы может ответить нейрохирург после получения результатов биопсии. Иногда для полноты картины необходимо дополнительно сделать МРТ шейного отдела позвоночника.
Основные причины развития патологии
Необратимые последствия при поражениях головного мозга, требуют комплексного подхода в лечении и кардинальных перемен в привычном образе жизни:
- Отказ от вредных привычек;
- Физическая активность – пешие прогулки и бассейн, для укрепления сердечной мышцы;
- Соблюдение диеты — стол № 10 – ограничение соли, жирной и острой еды. Преимущественно отварная или приготовленная на пару пища;
- Соблюдение режима отдыха – при патологиях мозга, необходимо увеличить сон на несколько часов;
- Избегание стрессов – не стабильное эмоциональное состояние напрямую влияет на причины многих заболеваний.
Медикаментозная терапия направлена на устранение когнитивных расстройств и лечение основного заболевания, которое является причиной изменения мозговых тканей:
- Препараты для улучшения кровоснабжения (помогают восполнить дефицит кислорода в тканях);
- Анальгетики (купирование болей);
- Противоэпилептические препараты (снятие судорожного синдрома);
- Бета-адреноблокаторы (контроль АД, для исключения гипертонических кризов);
- Нестероидные противовоспалительные препараты;
- Витамины группы В (восстановление работы нервной системы);
- Антидепрессанты (при тревожных расстройствах);
- Ноотропные препараты (восстановление когнитивных способностей).
При незначительных очагах поражения, возможно, замедлить прогрессирующий процесс, выполняя предписания невролога и проходя ежегодное повторное обследование сосудов головного мозга.
Профилактические меры, направленные на ведение здорового образа жизни и ежегодные плановые обследования у невропатолога, позволяют свести риск к минимуму для людей предрасположенных к сосудистым патологиям.
Дисфункциональные нарушения головного мозга влияют на качество жизни и течение болезни, приводящее к летальному исходу при обширных поражениях мозговой ткани. Своевременное лечение не избавляет от патологии, но возможно замедлить атрофические процессы и наладить угасающие жизненные функции.
Как и любые другие патологии, очаговые изменения вещества мозга дисциркуляторного характера могут иметь несколько стадий развития. Каждая из них имеет свои особенности и отличия, поэтому врачу очень важно понять, на каком же именно этапе находится ваше заболевание, для того чтобы подобрать для вас оптимальное лечение.
Итак, на самом первом этапе заметить наличие патологии крайне трудно. Ведь мозговое кровообращение только начало нарушаться. В этом случае особые симптомы болезни еще не выражены, поэтому диагностировать ее практически невозможно, да и у пациента нет особых жалоб.
На второй стадии состояние пациента ухудшается, ведь нервные клетки и мозговые ткани начинают отмирать. Такие процессы связаны со значительными нарушениями мозгового кровообращения.
Третья стадия данного заболевания является последней. В этом случае большая часть мозгового вещества погибла, поэтому мозг перестает нормально функционировать. При этом признаки недуга могут быть самыми разнообразными и у каждого пациента проявляться по-разному.
На самом деле существует огромное количество причин, благодаря которым могут возникать очаговые изменения вещества мозга дисциркуляторного характера. Последствия данной патологии мы рассмотрим ниже, а сейчас разберемся, какие же причины влияют на ее развитие.
Как было сказано выше, такое состояние возникает из-за того, что кровоснабжение мозга нарушается. Очень часто такое наблюдается из-за того, что шейный отдел позвоночника травмирован или же подвержен остеохондрозу и другим болезням. Также болезнь может возникнуть на фоне наличия некоторых заболеваний сердечно-сосудистой системы или же после получения травм головного мозга.
Очаговые изменения чаще всего возникают у людей преклонного возраста, однако в последнее время к невропатологам все чаще обращаются и молодые пациенты, а это говорит о том, что недуг начинает активно молодеть.
В первую очередь очень важно наладить кровоснабжение мозга, а также обеспечить поддержку здоровым нервным клеткам для того, чтобы недуг не продолжал прогрессировать. При необходимости пациент может принимать седативные и другие лекарства. Это нужно делать для поддержки нормальной жизнедеятельности. Очень часто к усложнениям приводит кислородный голод, поэтому важно своевременно устранить такое явление.
Также нужно укрепить нервную систему. Для этого специалисты рекомендуют принимать безопасные и эффективные растительные препараты. Необходимо также позаботиться и о том, чтобы мозговые клетки получали достаточное количество питательных веществ, микроэлементов и витаминов. Очень важно привести в тонус сосуды и расширить их для того, чтобы не возникал кислородный голод.
Если же проходимость артерий сильно ухудшается, тогда врачом может быть принято решение о проведении хирургического вмешательства. Однако делается это в самом крайнем случае.
Симптомы изменения вещества головного мозга дистрофического характера чаще всего проявляются довольно ярко, но, к сожалению, это происходит, когда болезнь уже сильно прогрессирует. Поэтому важно обращать внимание на появление даже небольших отклонений в состоянии здоровья.
- Вначале описываемые очаговые измененияпроявляются головной болью, возникающей как при физической, так и при эмоциональной нагрузке.
- Характерны для данного заболевания и периодические проявления парестезии – онемения или легкого покалывания в конечностях.
- Больной жалуется на головокружения и бессонницу, у него возникают нарушения координации движений (атаксия).
- С течением болезни перечисленные признаки усугубляются, к ним присоединяется гиперкинез (непроизвольные движения конечностями), развиваются парезы и параличи.
- Дальнейшее развитие недуга приводит к ухудшению памяти, заметному снижению интеллекта, аграфии (потере способности к письму).
Несколько слов о последствиях
Описанный в этой статье недуг очень опасный, поэтому при первых же признаках очень важно обратиться к невропатологу. Где сделать МРТ головного мозга, подскажет ваш лечащий врач. Обычно такая процедура проводится в самой больнице или в центре для обследований. В любом случае не игнорируйте ее, так как она поможет установить точный диагноз.
Очаговые изменения вещества мозга дисциркуляторного характера могут приводить к очень тяжелым последствиям. Наличие данного заболевания может отразиться на всем организме в целом: артериальное давление будет повышаться, при этом будет повышаться также и риск возникновения такого опасного состояния, как инсульт.