Кортексин – это ноотроп, состоящий из пептидов. Он получается путем специального приготовления из коры крупного рогатого скота. Препарат обладает нейропротекторными и антиоксидантными свойствами. Использование Кортексина повышает устойчивость нервных тканей к повреждающим воздействиям, таким как токсины, химические вещества, микробы и вирусы. При применении этого лекарственного средства ускоряются процессы регенерации структур ЦНС, улучшается передача импульса между нейронами. За счет этого существенно ускоряется процесс выздоровления при неврологических заболеваниях.
Кортексин в составе комплексной терапии успешно используется в лечении многих патологий, но основными показаниями к его применению являются:
- Нарушение кровообращения.
- Последствие черепно-мозговой травмы.
- Энцефалопатии различного генеза.
- Энцефалит, миелит, энцефаломиелит.
- Эпилепсия и судорожный синдром.
- Астеническое состояние (надсегментарные вегетативные расстройства).
- Когнитивные нарушения (расстройства памяти, мышления и внимания).
- Детский церебральный паралич.
- Задержка психомоторного и речевого развития у детей.
- Сниженная способность к обучению.
Что такое эпилепсия?
Одними из показаний к применению Кортексина являются эпилепсия и судорожный синдром.
Эпилепсия – это часто встречающееся заболевание нервной системы, проявляющееся в припадках, судорогах и потере сознания.
Причины этой патологии разнообразны: от органических поражений (инсульт, черепно-мозговая травма) до наследственной предрасположенности. Все это ведет к повышенной возбужденности определенных областей коры головного мозга. Образующиеся импульсы имеют чрезмерную силу и охватывают слишком большие области нервных клеток. В зависимости от пораженного участка, возможные проявления эпилепсии:
- Двигательные нарушения.
- Изменения чувствительности (зрительной, слуховой, тактильной, обонятельной, вкусовой).
- Смешанная форма.
Возможно появление симптомов расстройства вегетативной нервной системы (повышенная потливость, покраснение кожи) и нарушения психических функций (речи, мышления, памяти, эмоциональная неустойчивость)
При небольшом участке патологического возбуждения проявления могут быть незначительны. Однако при вовлечении в процесс крупных областей коры больших полушарий приступы приобретают генерализованный характер.
Кортексин в комплексном лечения эпилепсии
Ноотропы обладают широким диапазоном действия, работая при этом мягко, не вызывая большого напряжения систем организма.
Как правило, при эпилепсии препараты этого класса используются в качестве вспомогательных средств, дополняя противоэпилептические лекарства.
При использовании Кортексина у пациентов с эпилепсией развиваются следующие эффекты:
- Нормализация соотношения возбуждающих и тормозящих нейромедиаторов.
- Стабилизация передачи импульсов между нейронами.
- Замедление процессов перекисного окисления, что способствуют снижению образования перекисей, возбуждающих нейроны.
- Повышение устойчивости нервной ткани к агрессивным воздействиям (в том числе к гипоксии и свободным радикалам).
За счет этого достигается улучшение как в течении основного заболевания, так и сопутствующих симптомов.
Это лекарство успешно используется в комплексной терапии у детей и у взрослых.
Для достижения желаемого результата особенно важно следовать инструкции по применению.
Широкая распространенность эпилепсии, высокий риск развития сопутствующих судорожным припадкам неврологических и когнитивных нарушений наряду с высокой частотой фармакорезистентных форм этого заболевания делают актуальным поиск новых противоэпилептических препаратов (ПЭП), обладающих не только достаточно высоким антиэпилептическим потенциалом, но и способных повышать устойчивость тканей мозга к повреждающему действию судорожной активности (нейропротекторные свойства). В определенной мере этим требованиям отвечает препарат кортексин.
Первоначальная оценка эффективности клинического применения кортексина при эпилепсии была выполнена на кафедре неврологии Санкт-Петербургской государственной педиатрической медицинской академии в 2003 г. [3]. Кортексином лечили пациентов в возрасте от 1,5 до 17 лет с диагнозом симптоматической эпилепсии. Введение кортексина в течение 10 дней позволило улучшить у детей показатели памяти и внимания; у половины леченых детей от 1,5 до 5 лет была отмечена положительная динамика психомоторного и речевого развития; ни в одном из наблюдаемых случаев кортексин не спровоцировал рецидив эпилептических приступов; не было зарегистрировано отрицательных изменений неврологического статуса и ЭЭГ, а также побочных эффектов.
Приведенные результаты оказались сходными с наблюдениями, сделанными в Институте мозга человека РАН в 2000-2010 гг. [5]. В этом исследовании было дополнительно установлено, что назначение кортексина позволило нормализовать метаболизм в соответствующих областях мозга. Эффективность кортексина при эпилепсии изучали также В.Н. Цыган и соавт. [7], которые установили, что включение кортексина в схему стандартной терапии эпилепсии приводит к исчезновению пароксизмов на протяжении года и улучшению показателей ЭЭГ у 60-80% пациентов. Полученные данные потребовали детализации и верификации в дальнейших работах [8].
Известно, что кортексин представляет собой комплекс водорастворимых полипептидов. Принято считать, что, проникая через гематоэнцефалический барьер, он оказывает ноотропный, нейропротекторный и антиоксидантный эффекты. Механизм действия кортексина связывает активацией пептидов нейронов и нейротрофических факторов мозга, оптимизацией баланса метаболизма возбуждающих и тормозных аминокислот, дофамина, серотонина, ГАМКергическим воздействием, предотвращением образования свободных радикалов [4, 6]. Эти эффекты, а также способность пептидных препаратов модулировать нейрональную пластичность и нормализовать метаболизм поврежденных тканей, дают основания предполагать, что и дальнейшее изучение их терапевтического действия может быть перспективным направлением в области лечения эпилепсии.
Целью данной работы стало изучение особенностей противосудорожного действия с использованием модели эпилепсии. В качестве основной модели выбрана одна из наиболее удобных и часто используемых в настоящее время моделей эпилептогенеза — пентилентетразоловый киндлинг (ПТЗК). Суть процедуры киндлинга (англ. kindling — раскачивание) заключается в том, что электрическая, химическая (в данном случае — введение пентилентетразола, антагониста ГАМКА-рецепторов) или иная стимуляция мозга изначально подпороговой интенсивности после нескольких применений вызывает прогрессивно нарастающую по силе судорожную активность, которая выражается в появлении эпилептической активности на ЭЭГ и моторных судорогах. Процедура киндлинга делает отделы мозга животного патологически восприимчивыми к эпилептогенным стимулам, приводя к развитию судорожной активности, т.е. изначально здоровые животные после развития киндлинга демонстрируют спонтанные повторные судороги [11, 12]. ПТЗК успешно используют для изучения механизмов развития эпилепсии, в частности височной, у человека, поскольку ПТЗК во многом воспроизводит характер ЭЭГ, мышечных судорог, структурно-функциональных нейрональных перестроек и обладает определенно предиктивной валидностью в отношении влияния антиэпилептических веществ. Он является общепринятой моделью для скрининга лекарственных средств для лечения эпилепсии [15].
Материал и методы
В работе были использованы 180 самцов крыс линии Вистар, полученных из питомника «Столбовая» РАН. Средняя масса животных на начало эксперимента была 150-200 г. В течение всего эксперимента животных содержали в условиях вивария при искусственном световом режиме и постоянной температуре. Эксперименты проводили в первой половине светового дня.
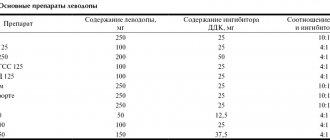
Кортексин растворяли в изотоническом растворе NaCl в концентрациях 0,015, 0,15 или 1,0 мг/мл и вводили внутрибрюшинно из расчета 1 мл/кг. В качестве препаратов позитивного и негативного контроля использовали диазепам (0,2 мг/кг) в изотоническом растворе NaCl и чистый изотонический раствор NaCl соответственно. Кроме того, кортексин в дозе 0,15 мг/мл сорбировали на наночастицах и вводили интраназально. Для повышения эффективности доставки кортексина в мозг использовали микроконтейнеры на основе карбоната кальция. Ранее подобная система была успешно использована для доставки в мозг центрального анестетика лоперамида [2]. Кортексин включали в неорганическую матрицу микрочастиц с помощью его соосаждения с СаСО3 из смеси растворов карбоната натрия и хлорида кальция [20]. Количество функционального вещества в частицах определяли спектрофотометрически.
Судорожную активность вызывали внутрибрюшинным введением пептилентетразола (ПТЗ) (, США) в изотоническом растворе NaCl в дозе 37,5 мг/кг (при хроническом введении) или 70 мг/кг (при остром введении). В пробном эксперименте, проведенном до начала данного исследования, при однократном применении ПТЗ в этих дозах соответственно не вызывал конвульсивных судорог и вызывал генерализованную клонико-тоническую судорожную активность, не приводящую к смерти животного.
Влияние кортексина на развитие судорожной активности исследовали в соответствии с 3 схемами экспериментов. В каждой из них было использовано по 6 групп животных (по 10 в каждой группе), получавших кортексин интраперитонеально в дозах 0,015, 0,15 или 1,0 мг/кг, кортексин, сорбированный на наночастицах, в дозе 0,15 мг/кг интраназально, диазепам или изотонический раствор NaCl интраперитонеально. Животные распределялись между группами случайным образом.
Схема эксперимента 1
— введение кортексина до провокации однократных генерализованных клинико-тонических судорог. В этом случае кортексин и контрольные вещества вводили ежедневно в течение 10 дней; на 10-й день через 1 ч после введения препаратов животных использовали для моделирования эпилептического статуса однократной внутрибрюшинной инъекцией ПТЗ в дозе 70 мг/кг (рис. 1, а).
Рисунок 1. Схема эксперимента. а — эксперимент 1, введение кортексина до провокации однократных генерализованных клонико-тонических судорог; б — эксперимент 2, введение кортексина животным со сформированным ПТЗК; в — эксперимент 3, введение кортексина животным перед киндлингом и на фоне его выработки.
Схема эксперимента 2
— введение кортексина животным со сформулированным ПТЗ. Животным вводили ПТЗ в дозе 37,5 мг/кг 3 раза в неделю, всего 13 инъекций, после чего в течение 10 дней ежедневно вводили кортексин и контрольные вещества. На 10-й день через 1 ч после введения препаратов осуществляли проверку сохранности киндлинга провоцирующей инъекцией ПТЗ в дозе 37,5 мг/кг (см. рис. 1, б).
Схема эксперимента 3
— введение кортексина перед киндлингом и на фоне его выработки. Кортексин и контрольные вещества вводили ежедневно в течение 10 дней, после чего (на 10-й день) начинали выработку киндлинга. Для этого 3 раза в неделю животным вводили ПТЗ в дозе 37,5 мг/кг, всего 13 инъекций. За 1 ч до каждой инъекции ПТЗ животные также получали кортексин или контрольные препараты. После окончания курса инъекций ПТЗ животным предоставляли период отдыха сроком 10 сут, после чего (на 10-й день) осуществляли проверку сохранности киндлинга провоцирующей инъекцией ПТЗ в дозе 37,5 мг/кг (см. рис. 1, в).
Оценку судорожной активности проводили в течение 20 мин после введения ПТЗ по шкале H. Franke и H. Kittner [10], в которой предусмотрены следующие стадии реакции: стадия 0 — отсутствие реакции; стадия 1 — лицевые автоматизмы, подергивание ушей и вибрисс; стадия 2 — конвульсивные волны, распространяющиеся вдоль оси туловища; стадия 3 — миоклонические судороги со вставанием; стадия 4 — клонико-тонические судороги с потерей позы; стадия 5 — генерализованная тоническая экстензия.
Проводилась также регистрация времени от введения ПТЗ до развития первых клонических судорог (латентный период).
Статистическую обработку результатов проводили с использованием программного пакета Statistica 7.0 (StatSoft, США). Достоверность отличий между группами оценивали с применением непараметрического критерия Манна-Уитни, достоверность отличий между разными временны`ми точками внутри одной группы оценивали при помощи парного критерия Вилкоксона. Развитие киндлинга в разных группах сравнивали при помощи дисперсионного анализа для последовательных измерений (repeated measures ANOVA) с последующим сравнением групп между собой при помощи критерия Ньюмена-Кейлса. Для анализа соотношений «доза-эффект» использовали корреляционный анализ по методу Спирмена. Критерий достоверности во всех случаях был установлен на уровне p<0,05. Данные на рисунках представлены в виде M±S.E.M.
Результаты
Эксперимент 1
. При моделировании однократных генерализованных клонико-тонических судорог было обнаружено, что кортексин в большинстве групп не влиял на выраженность судорожной активности, т.е при введении перед моделированием эпилептического статуса кортексин не демонстрировал прямого противосудорожного эффекта.
Эксперимент 2
. В ходе выработки ПТЗК сила судорожной активности увеличилась с 1,02±0,02 балла после первой инъекции ПТЗ до 2,60±0,08 балла после 13-й инъекции ПТЗ. После окончания выработки ПТЗК животным в течение 10 дней вводили кортексин или контрольные вещества, после чего на 10-й день давали еще одну, провоцирующую инъекцию ПТЗ в той же дозе, которую использовали при выработке киндлинга (рис. 2).
Рисунок 2. Сравнение силы судорог (а) и латентного периода судорожной активности (б) крыс с выработанным ПТЗК в ответ на инъекцию ПТЗ (37,5 мг/кг) до и по окончании 10 дней введения кортексина или контрольных веществ. * — отличие от контрольной группы (p<0,05; парный тест Вилкоксона). Было обнаружено, что ни в одной из групп введение кортексина или контрольных веществ в течение 10 дней не оказывало влияния на силу судорог, вызванных провоцирующим введением ПТЗ (p>0,1; парный тест Вилкоксона). Тем не менее животные после курсового введения кортексина в дозе 1,0 мг/кг в течение 10 дней демонстрировали более длительный латентный период развития конвульсивных судорог, чем до введения кортексина (p<0,05; парный тест Вилкоксона). Таким образом, при введении животным с уже сформированным ПТЗК кортексин в дозе 1,0 мг/кг не влиял на силу судорожной активности в ответ на провоцирующую инъекцию ПТЗ, хотя и отдалял время начала клонических судорог.
Эксперимент 3
. В данном эксперименте оценивали влияние кортексина на процесс формирования ПТЗК при введении препарата перед началом выработки киндлинга, а также в течение всего времени его развития. Сила судорог у животных, получавших кортексин до и во время выработки ПТЗК, не отличалась от контрольной группы в течение всего периода выработки киндлинга (рис. 3).
Рисунок 3. Сила судорог животных, получавших кортексин или диазепам до и во время выработки ПТЗК, по сравнению с животными контрольной группы. Сплошная линия — контрольная группа. Пунктирная линия — группы животных, получавших кортексин в дозе 0,015 мг/кг (а), 0,15 мг/кг (б), 1,0 мг/кг (в), кортексин в комплексе с наночастицами (г) и диазепам в дозе 0,2 мг/кг (д). * — отличие от контрольной группы (p<0,05; тест Ньюмена-Кейлса). Группа животных, получавших диазепам, отличалась от контрольной группы на всем протяжении выработки ПТЗК: F(1,17)=5,52; p=0,03. Тем не менее после 10-дневного периода отдыха животные, прежде получавшие кортексин в дозе 1,0 мг/кг, демонстрировали достоверно более слабые судороги в ответ на провоцирующее введение ПТЗ по сравнению с контрольными животными. Тенденция к такому снижению силы судорог при провокации присутствовала и в группе, получавшей меньшую дозу кортексина (0,15 мг/кг). Однако животные, получавшие минимальную исследовавшуюся дозу кортексина (0,015 мг/кг), не отличались от контрольной группы при провокации, как и животные, получавшие кортексин в комплексе с наночастицами.
Поскольку в ходе проведенных экспериментов были получены данные, указывающие на возможное наличие зависимости между дозой кортексина и выраженностью судорог при провокации, был проведен корреляционный анализ величин силы и латентного периода судорожной активности при провокации с применявшейся дозой кортексина. Было обнаружено, что с дозой кортексина при введении до и во время выработки ПТЗК обратно коррелировала выраженность судорожной активности при последующей провокации (коэффициент корреляции Спирмена r=–0,41; p<0,05) и положительно коррелировала длительность латентного периода при провокации (коэффициент корреляции Спирмена r=0,6; p<0,05). Таким образом, увеличение дозы кортексина (в диапазоне 0,015-1,0 мг/кг), применявшегося до и во время выработки ПТЗК, приводило к ослаблению судорог и замедлению их развития при последующей провокации. При введении кортексина после выработки ПТЗК его доза не коррелировала с длительностью латентного периода и выраженностью судорожной активности при провокации. Результаты сравнения эффектов различных доз кортексина на эти показатели в двух экспериментах представлены на рис. 4.
Рисунок 4. Сравнение силы судорог (а) и латентного периода судорожной активности (б) у крыс, получавших кортексин до и во время выработки ПТЗК (темные столбики), и у крыс, получавших кортексин после выработки ПТЗК (светлые столбики). Значения приведены к показателям контрольной группы в каждом эксперименте, принятым за 100%.
Обсуждение
Представленные результаты свидетельствуют о способности кортексина влиять на латентность и степень выраженности судорог при моделировании хронической судорожной активности с использованием ПТЗ. Иными словами, показана дозозависимая противоэпилептическая активность кортексина.
При этом длительное (10 дней) применение кортексина перед введением высокой однократной дозы ПТЗ (70 мг/кг) не влияло на судорожную активность. Это свидетельствует об отсутствии у кортексина прямой противосудорожной активности.
Выше уже говорилось о том, что часто при моделировании эпилептогенеза используется феномен киндлинга [16, 22]. Хроническое введение подпороговой дозы ПТЗ сопровождается развитием киндлинга, являющегося моделью эпилептогенеза с доказанной предсказательной ценностью в отношении фармакологических средств с противоэпилептической активностью. ПТЗК сопровождается не только гибелью нейронов, но и синаптической реорганизацией, аксональным спраутингом (англ. sprout — пускать ростки), т.е. с образованием новых ветвей аксонов нервных волокон, изменениями нейрогенеза в гранулярном слое зубчатой извилины гиппокампа, глиозом, изменением экспрессии генов в нейронах и астроцитах. Эти изменения обусловливают активацию нервных сетей и усиление их ответа на каждое последующее введение ПТЗ. Кроме того, развитие судорожной активности при ПТЗК сопровождается нарушениями обучения и памяти у животных и развитием нейродегенеративных процессов, локализованных преимущественно в гиппокампе [10, 17, 18, 22], что позволяет считать ПТЗК наиболее адекватной моделью височной эпилепсии у человека [15, 19].
При моделировании хронической судорожной активности с помощью ПТЗ наиболее выраженный антиэпилептический эффект кортексина отмечался при его применении до начала и во время развития ПТЗК, при этом он носил «отставленный» характер, проявляясь через 10 дней после окончания выработки киндлинга и введения кортексина. Это дает основание полагать, что механизм действия кортексина связан с долговременными изменениями нейрональной пластичности. Последняя проявляется в перестройках нейронных сетей, преобразованием глии с пролиферацией клеток, нейро- и ангиогенезом. На молекулярном уровне речь идет об изменениях экспрессии генов, уровня кальция в ткани мозга, функции ионных каналов и рецепторов, а также метаболизма с развитием сигнальных каскадов.
Эпилепсию вообще можно рассматривать как пример аберрантных пластических преобразований [21]. В связи с этим можно привести высказывание Y. Ben-Ari [8]: мозг при эпилепсии можно охарактеризовать «новым состоянием пластичности, при котором судороги порождают судороги». Так, при височной эпилепсии эти изменения отмечены в области зубчатой извилины.
Исследования на грызунах подтвердили, что лимбические пароксизмы приводят к гибели нейронов и активации возбуждающих синапсов, которые участвуют в развитии последующих судорог. Запускающим сигналом в данном случае является формирование новых синапсов и усиление синаптической нейротрансмиссии. Новые синапсы являются аберрантными (т.е. формируются в участках, где они отсутствуют в норме) и содержат нехарактерные рецепторы. Аберрантная форма реактивной нейрональной пластичности обеспечивает последующую генерацию судорог. Эти процессы затрагивают структуры мозга, отвечающие за выполнение интегративных и мнемонических функций, и влияют на когнитивные процессы [21].
Можно полагать, что кортексин, являясь препаратом с метаболическим механизмом действия, способен корректировать метаболизм поврежденных участков нервной ткани, тем самым способствуя восстановлению нормальной пластичности нейронов. Очень сложно провести четкую грань между нормальной пластичностью и патологическими изменениями, которые составляют так называемый континуум пластичность-патология. Впервые это понятие было сформулировано J. McEachern и C. Shaw [14]. Основываясь на представлении об общности (плейотропности) основных молекулярных механизмов, необходимых для нормального функционирования нейрона и принимающих участие в его повреждении и гибели, авторы пришли к выводу, что в рамках этого континуума могут быть рассмотрены все основные проявления эпилепсии — от нормального осуществления когнитивных функций до нейродегенерации мозга и судорожной активности. Другими словами, на молекулярном уровне не происходят заведомо патологические реакции: все биохимические процессы реализуются как в нормальном состоянии, так и при патологии. Патологические изменения развиваются в результате сбоя «нормальных» механизмов и заключаются в том, что изначально нормальные реакции в таком случае осуществляются в иной степени, в иной период, в иных клетках, клеточных или внеклеточных компартментах, с иным субстратом (ферменты) [1]. Учитывая, что механизм действия кортексина включает оптимизацию баланса метаболизма возбуждающих и тормозных аминокислот, дофамина, серотонина и ГАМК, предотвращение образования свободных радикалов, представляется, что введение кортексина создает необходимые условия для нормализации патологически выраженной пластичности нервной системы и, таким образом, оказывает долговременный антиэпилептический эффект.
Проведенные эксперименты подтверждают возможность и оправданность клинического применения кортексина у пациентов с когнитивными эпилептическими дезинтеграциями в стадии клинико-электроэнцефалографической ремиссии. Материалы данного исследования подтверждают обоснованность клинического применения кортексина в терапии данной патологии головного мозга.