Показания
◊ Рекомендаци Минздрава России
F32 Депрессивный эпизод
F33 Рекуррентное депрессивное расстройство
F40.1 Социальные фобии
F41.0 Паническое расстройство (эпизодическая пароксизмальная тревожность)
F42.9 Обсессивно-компульсивное расстройство неуточненное
F43.1 Посттравматическое стрессовое расстройство
◊ Рекомендации FDA
- Большое депрессивное расстройство
- Предменструальное дисфорическое расстройство
- Паническое расстройство
- Посттравматическое стрессовое расстройство
- Социальная фобия
- Обсессивно-компульсивное расстройство (ОКР)
- Генерализованное тревожное расстройство (ГТР)
◊ Рекомендации UK Medicines and Healthcare Products Regulatory Agency
- Большое депрессивное расстройство
- Паническое расстройство с/без агорафобии
- ОКР у взрослых и детей с 6 лет
- Социальная фобия
- Посттравматическое стрессовое расстройство
◊ Использование Off-label
- Предотвращение артериальной гипотензии при гемодиализе [6]
- Зуд [7]
Другие препараты, которыми можно заменить Сертралин
Иногда возникает необходимость в применении препаратов, оказывающих комплексное терапевтическое воздействие. Антидепрессантами, которые обладают такими свойствами, являются Спитомин, Рексетин и Паксил.
Спитомин
Спитомин – транквилизатор и дофаминомиметик, содержащий 5 или 10 мг буспирона гидрохлорид. Оказывает анксиолитическое и антидепрессивное воздействие. За счет такой особенности лекарство может применяться для устранения:
- алкогольной или неалкогольной абстиненции;
- рекуррентных депрессий;
- неврологических расстройств;
- депрессивного эпизода;
- панических атак;
- генерализованного тревожного расстройства;
- соматоформной дисфункции вегетативной нервной системы;
- прочих расстройств ВНС.
Противопоказан прием медикамента:
- при непереносимости любого вещества, содержащегося в таблетках;
- при лактации;
- больным с тяжелым течением ХПН;
- пациентам с тяжелой формой печеночной недостаточности;
- при глаукоме;
- лицам, страдающим от миастении;
- беременным пациенткам;
- при подозрении на беременность;
- несовершеннолетним детям (безопасность Спитомина для этой категории больных не изучалась).
Буспирон, как активный компонент, хорошо воспринимается организмом, поэтому возникновение побочных действий – явление редкое. Обычно подобные недомогания отмечаются только в самом начале терапевтического курса, после чего самостоятельно исчезают. Чаще всего они проявляются:
- болью в груди;
- головокружениями;
- повышенной нервной возбудимостью;
- проблемами со сном;
- цефалгией;
- шумом в ушах;
- аллергическим ларингитом;
- отечностью носовой слизистой.
Обычно такие реакции проходят без лечения, но если необходимость в симптоматической терапии, все же возникнет, то за рекомендациями нужно обратиться к врачу.
Таблетки принимают всегда в одно и то же время. Важно учитывать, что Спитомин не может применяться для кратковременного или периодического лечения тревожных состояний ввиду того, что первый терапевтический эффект от его приема достигается только через 7 – 14 дней.
Начальная дозировка лекарства при всех видах расстройств – 15 мг. Ее повышение проводится раз в 2 – 3 дня на 5 мг, и до тех пор, пока не будет достигнут ожидаемый результат. Лечение следует продолжать не менее 1 недели.
Спитомин отличается от Сертралина составом, стоимостью, особенностями приема, а также более обширным списком показаний к приему.
Рексетин
Рексетин – таблетированный антидепрессант, содержащий 20 или 30 мг пароксетина. Лекарство обладает антидепрессивным воздействием, и назначается для устранения:
- депрессий;
- рекуррентного депрессивного расстройства;
- социальной фобии;
- панических припадков;
- тревожно-депрессивных расстройств;
- разных тревожных расстройств;
- ОКР;
- ПТСР.
Прием лекарства проводится в утреннее время, в период приема пищи, но разжевывать таблетку не стоит. Рекомендуемая суточная дозировка Рексетина – 20 мг, но ее можно увеличивать каждые 2-3 суток. Окончательный режим дозирования устанавливается врачом, исходя из конкретного диагноза, и с учетом тяжести его течения.
Рексетин нечасто провоцирует возникновение нежелательных реакций. Самые часто встречающиеся побочные эффекты проявляются сонливостью, нарушением пищеварения, головной болью, тошнотой, бессонницей, головокружениями. Реже возможно развитие аллергии, для которой характерны зуд, покраснение, крапивница, сыпь на коже.
Рексетин и Сертралин отличаются составом и ценой.
Паксил
Паксил – еще один заменитель Сертралина, изготовленный на основе пароксетина. 1 таблетка содержит 20 мг действующего вещества. Препарат обладает антидепрессивным воздействием, и относится к группе СИОЗС (селективных ингибиторов обратного захвата серотонина).
Паксил предназначен для лечения всех типов депрессии, ОКР у взрослых пациентов и детей с 7 лет. Агорафобия, панические приступы, ПТСР, генерализованное тревожное расстройство – эти состояния тоже являются основанием для применения данного медикамента.
Параллельно с этим Паксил не рекомендуется принимать в период гестации и ГВ, при гиперчувствительности к пароксетину, а также при приеме МАО либо Тиоридазина. Детям до достижения 7 лет назначать средство тоже не следует.
Чаще всего лечение Паксилом сопровождается:
- снижением или потерей аппетита;
- сонливостью;
- бессонницей;
- расстройствами зрения;
- зевотой;
- судорожными приступами;
- тошнотой;
- запором;
- сухостью слизистой ротовой полости;
- поносом;
- повышенной потливостью;
- нарушением сексуальной функции;
- астенией;
- сенсорными нарушениями;
- расстройствами сна;
- тревогой.
Для начала назначается 20 мг Паксила. Затем, при необходимости, дозировка увеличивается до 50 мг/сутки, что является максимумом. Особенности повышения дозы: на 10 мг каждую неделю.
Паксил отличается от основного медпрепарата не только ценой, но также составом и особенностями приема.
Смотрите также:
ТОП 10 аналогов Тиоридазина — заменители по терапевтическому действию
Механизм действия и фармакокинетика
Селективно блокирует (преимущественно через серотониновые 1А рецепторы) обратный захват серотонина пресинаптической мембраной нейронов головного мозга и тромбоцитами. При длительном применении снижает количество серотониновых 5-НТ1А и адренорецепторов в ЦНС. Сертралин также обладает некоторой способностью блокировать обратный захват дофамина, что может увеличить нейротрансмиссию дофамина. Сертралин также связывается с сигма 1 рецепторами, что может объяснять его противотревожное действие.
.
- Серталин метаболизируется несколькими ферментами цитохрома P450 (CYP): CYP2B6, CYP2C19, CYP2C9, CYP2D6 и CYP3A4, а также моноаминоксидазами и глюкуронилтрансферазами [10]
- Максимальная концентрация в плазме через 4.5-8.4 часов
- Период полувыведения 22-36 часов;
- Период полувыведения метаболитов 62-104 часа [7].
Фармакологические свойства препарата Сертралин
Специфический ингибитор обратного захвата серотонина (5-НТ) в нейронах in vitro. Оказывает слабое влияние на обратный захват норадреналина и допамина. В клинических дозах сертралин блокирует захват серотонина в тромбоцитах человека. Не оказывает стимулирующего, седативного или антихолинергического действия и не обладает кардиотоксичностью. Благодаря селективному угнетению захвата 5-НТ сертралин не усиливает катехоламинергическую активность. Сертралин не обладает сродством к мускариновым (холинергическим), серотониновым, допаминовым, адренергическим, гистаминовым, ГАМК- или бензодиазепиновым рецепторам. Длительное применение сертралина у животных приводило к снижению активности норадреналиновых рецепторов головного мозга; сходное действие оказывают другие клинически эффективные антидепрессивные и антиобсессивные препараты. В отличие от трициклических антидепрессантов при лечении депрессии или обсессивно-компульсивных расстройств (ОКР) сертралином увеличения массы тела не происходит; у некоторых пациентов даже отмечается ее снижение. Развития лекарственной зависимости не установлено. Сертралин активно биотрансформируется при первом прохождении через печень. Основной метаболит — N-десметилсертралин — почти в 20 раз уступает по активности сертралину in vitro и фактически неактивен на моделях депрессии in vivo. Период полувыведения N-десметилсертралина варьирует в пределах 62–104 ч. Сертралин и N-десметилсертралин активно биотрансформируются в организме; образующиеся метаболиты выводятся с калом и мочой в равных количествах. Неизмененный сертралин выводится с мочой в незначительном количестве (менее 0,2%). Прием пищи не оказывает существенного влияния на биодоступность сертралина.
Схема лечения
◊ Дозировка и подбор дозы
- Оптимальная доза: 50-200 мг/день
- Депрессия и ОКР: начинать с 50 мг и ждать несколько недель, но можно повышать каждую неделю, максимум – 200 мг/день
- Паническое расстройство, ПТСР, социальная тревожность: начинать с 25 мг, через неделю повысить до 50 мг, ждать несколько недель, чтобы оценить, нужно ли повышать, максимум – 200 мг/день
- Пременструальное дисфорическое расстройство: 50 мг/день весь менструальный цикл или только в лютеальной фазе
- Зуд: 25-100 мг/день [7]
- Предотвращение артериальной гипотензии во время гемодиализа: 100 мг/день [6].
- Многим пациентам доза 50 мг/день недостаточна [1]
- При сильной тревожности и ажитации начальная доза должна быть меньше, титровать надо медленнее, а также добавить тразадон или бензодазепин
- Если у пациента в прошлом история непереносимости антидепрессантов, начинать с дозы 12,5 мг
- Если в начале лечения или после прерывания лечения появляются тревожность, бессонница, ажитация, акатизия, нужно рассмотреть возможность биполярного расстройства и переключиться на стабилизатор настроения или атипичный антипсихотик
◊ Как быстро действует
- У некоторых пациентов начинает действовать сразу же.
- Начинает действовать после 2-4 недель.
- Если нет эффекта через 6-8 недель, надо повысить дозу или перейти на другой препарат.
- Для предотвращения рецидива можно принимать в течение многих лет.
◊ Ожидаемый результат
- Полная ремиссия.
- После исчезновения симптомов депрессии следует продолжать прием 1 год, если это было лечение первого эпизода. Если это лечение повторного эпизода, лечение можно продлить бессрочно.
- Использование при лечении тревожности может быть бессрочным [1].
◊ Если не работает
- Изменить дозу, перейти на другое лекарство или добавить вспомогательный препарат;
- Подключить психотерапию;
- Пересмотреть диагноз, выяснив коморбидные состояния;
- У пациентов с недиагностированным биполярным аффективным расстройством эффективность лечения может быть низкой, в таком случае следует перейти на Стабилизатор настроения [1].
- В острой фазе депрессивного расстройства тяжёлой степени, которое сопровождается психотическими или кататоническими симптомами, а также у пациентов с актуальными суицидальными идеями необходимо рассмотреть возможность проведения электросудорожной терапии [4].
◊ Как прекратить прием
- Постепенно снижать дозу, чтобы избежать синдрома отмены;
- Для многих работает такая схема: снизить на 50 % за 3 дня, потом еще на 50 % за 3 дня, потом прекратить;
- Если синдром отмены очень сильный, надо поднять дозу и переждать, пока симптомы синдрома отмены уйдут;
- Важно отличать синдром отмены от возврата симптомов заболевания [1].
◊ Лечебные комбинации
- При бессоннице: тразадон
- В США Сертралин комбинируют с бупропионом. Данная комбинация называется “Well-loft”.
- При усталости, сонливости, потере концентрации: модафинил [3].
- Комбинации с другими антидепрессантами могут активировать биполярное расстройство и суицидальные идеи
- При биполярной депрессии, психотической депрессии, резистентной депрессии, резистентном тревожном расстройстве: стабилизаторы настроения, атипичные антипсихотики
- При тревожном расстройстве: габапентин, тиагабин
- Бензодиазепины
Структурные аналоги Сертралина
Лекарствами, содержащими сертралин в качестве основного компонента, являются: Золофт, Стимулотон, Асентра, Серената, Торин.
Золофт
Золофт – антидепрессант, содержащий 100 или 50 мг сертралина в 1 таблетке. Лекарство предназначено для лечения:
- депрессивных расстройств различной этиологии (терапия и профилактика);
- ОКР;
- панических приступов, расстройств;
- ПТСР;
- агорафобии.
Не назначается медпрепарат пациентам с гиперчувствительностью к сертралину, беременным и лактирующим женщинам, детям младше 6-летнего возраста. Нельзя пить таблетки в том случае, если больной принимает МАО или пимозид.
На заметку. Строгого запрета на прием лекарства будущими или кормящими матерями нет, но к его назначению в эти периоды прибегают только в крайних случаях.
В самом начале лечения у больного могут возникнуть побочные эффекты, проявляющиеся:
- сухостью во рту;
- диспепсией;
- сонливостью;
- цефалгией;
- мигренью;
- головокружениями;
- нарушением сна;
- тремором конечностей;
- зевотой;
- аллергическими реакциями.
Примечание. В редких случаях возможен сбой менструального цикла у женщин. У обоих полов иногда отмечается повышение уровня пролактина и расстройство половой функции.
Начальная дозировка медпрепарата при депрессии и ОКР составляет 50 мг, при других диагнозах – 25 мг. При необходимости доза может быть увеличена – в зависимости от терапевтического ответа. Увеличение количества принимаемого лекарства должно осуществляться постепенно – на 25 или 50 мг еженедельно. Прием таблеток осуществляется 1 раз в сутки.
Золофт отличается от Сертралина стоимостью. Показания и противопоказания к назначению обоих медсредств одинаковы.
Стимулотон
Стимулотон – таблетированный антидепрессант, содержащий сертралин в количестве 50 или 100 мг в 1 таб. Препарат оказывает выраженное антидепрессивное влияние, и назначается при разного рода депрессивных расстройствах, ОКР, ПТСР, социальной фобии.
Не выписывают медикамент:
- лицам с гиперчувствительностью к сертралину;
- детям до 6 лет;
- пациентам, принимающим МАО или Пимозид.
Прием Стимулотона может спровоцировать возникновение у больного следующих побочных эффектов:
- головокружений;
- сухости в ротовой полости;
- тошноты;
- вздутия живота;
- несварения желудка;
- головных болей;
- тремора конечностей;
- проблем с засыпанием;
- бессонницы.
Таблетки принимают раз в сутки, начиная с дозы 50 мг при депрессии и ОКР, и 25 мг – при других диагнозах. При неэффективности такого режима дозирования количество принимаемых таблеток увеличивают до тех пор, пока не удастся добиться ожидаемого терапевтического ответа. Максимально допустимой суточной дозой Стимулотона является 200 мг.
Продолжительность терапии – минимум 1, максимум – 4 недели. Повторение лечения возможно, но только с перерывами между курсами.
Стимулотон отличается от Сертралина стоимостью, а также доступностью. Его намного легче найти в аптеках России, нежели основное ЛС.
Асентра
Асентра – еще один структурный аналог Сертралина. Содержит активное вещество в дозе 50 или 100 мг в 1 таблетке. Препарат показан к приему при:
- панических расстройствах;
- обсессивно-компульсивных расстройствах;
- депрессиях (лечение плюс профилактика);
- посттравматическом стрессовом расстройстве.
Лекарство запрещено принимать:
- пациентам с непереносимостью действующего вещества;
- беременным женщинам;
- больным, принимающим МАО, Триптофан, Фенфлурамин;
- лицам с нестабильным течением эпилепсии;
- лактирующим матерям;
- детям до достижения 6-летнего возраста.
К самым частым проявлениям негативных реакций на препарат можно отнести:
- чувство сухости во рту;
- снижение аппетита;
- диспепсию;
- сонливость;
- цефалгию;
- тремор конечностей;
- бессонницу;
- головокружения;
- нарушения либидо, эякуляции, эрекции;
- сбой менструального цикла;
- повышение артериального давления;
- кожные проявления аллергии.
Важно! При резком прекращении приема лекарства у некоторых больных может развиваться синдром отмены.
Таблетки предназначены для приема внутрь. При лечении депрессивных состояний и ОКР взрослым больным и подросткам с 13-летнего возраста назначают по 50 мг/сутки, детям 6 – 13 лет – по 25 мг/сутки. Это начальная доза препарата Асентра, которая может быть увеличена в случае необходимости.
Повышение суточной дозировки – вопрос строго индивидуальный. Этот процесс должен быть постепенным. Параллельно с ним важно оценивать реакцию организма больного на проводимое лечение.
Прием таблеток осуществляется 1 раз. Желательно проводить его утром или в обеденное время. Таблетка глотается целиком – дробить или разжевывать ее не следует. Прием пищи не оказывает воздействия на биодоступность сертралина, поэтому Асентру можно пить как до, так и после еды.
Длительность терапевтического курса определяется индивидуально. Обычно он составляет 2-4 недели, но если потребуется пролонгация лечения, то она осуществляется только с разрешения врача.
Асентра отличается от основного медикамента Сертралина производителем, стоимостью, доступностью. Приобрести данный аналог в России можно, в отличие от «прототипа», в стационарных и виртуальных аптеках.
Серената
Серената – антидепрессант из группы СИОЗС. Активный компонент – сертралин. Производитель – Торрент, Индия. Лекарство назначается с целью устранения депрессий (а также профилактики их повторного развития), панических приступов, ОКР, ПТСР, агорафобии. Нельзя пить таблетки:
- при нестабильной эпилепсии;
- детям младше 6 лет;
- женщинам на протяжении гестацинонного и лактационного периодов;
- лицам с гиперчувствительностью к АВ сертралину.
Препарат принимается исключительно внутрь. Взрослым пациентам назначается начальная доза 50 мг, детям – 25 мг. Внесение корректив в схему терапии в сторону повышения суточной дозировки проводится постепенно – раз в неделю.
Максимально допустимой суточной концентрацией сертралина является 200 мг (4 таб. по 50 мг или 2 – по 100 мг) для взрослых больных.
Длительность терапевтического курса – от 1 до 4 недель. Этот критерий является одинаковым для пациентов любых возрастных категорий.
Важно! Отмена лекарства должна проводиться постепенно, с медленным снижением дозировки. В противном случае возможно развитие синдрома отмены.
Негативные реакции на прием Серенаты проявляются обычно в самом начале терапии. Они сопровождаются:
- зевотой;
- головокружением;
- потерей аппетита (реже он, напротив, повышается);
- диспептическими расстройствами;
- гастралгией;
- сонливостью;
- цефалгией;
- нарушением обменных процессов;
- тремором;
- бессонницей;
- экстрапирамидными расстройствами;
- кожной аллергией.
Проявление этих реакций не является весомым основанием для отмены Серенаты. Но если недомогания нарастают, а симптомы усугубляются, то об этом следует немедленно сообщить врачу.
Серената отличается от основного лекарства ценой, более широкой распространенностью, производителем.
Торин
Торин – препарат российского производства, содержащий сертралин в количестве 50 мг/таб. Лекарство оказывает выраженное антидепрессивное воздействие.
Медикамент применяется для лечения различных психических и психологических расстройств: депрессий, посттравматических стрессовых состояний, ОКР, агорафобии, панических приступов у взрослых и детей с 6 лет.
Противопоказано лекарство больным, не переносящим вещество сертралин, кормящим матерям, беременным пациенткам, маленьким пациентам до 6 лет. С осторожностью назначают медпрепарат лицам с ХПН, эпилепсией, поражением печени, неврологическими расстройствами.
Торин принимают внутрь 1 раз в сутки. При депрессии и ОКР терапию начинают с дозы, равной 50 мг, при других расстройствах – 25 мг/сутки. Детям 6 – 13 лет – только с 25 мг, подросткам с 13 – как взрослым.
Как и в ранее приведенных описаниях, возможно постепенное повышение суточной дозы до достижения ожидаемых результатов от лечения. Допускается применение максимум 200 мг Торина за день.
Обычно первые признаки положительной динамики от проводимой терапии наблюдаются уже спустя неделю с момента первого приема таблеток. Однако важно пройти полный курс, чтобы добиться стойких и более выраженных результатов.
Продолжать применение Торина нужно минимум 2, максимум – 4 недели. Пролонгация лечебного курса возможна, но исключительно после консультации с врачом.
Препарат нечасто провоцирует проявление побочных эффектов, но иногда о них сигнализируют симптомы в виде:
- головокружений;
- тошноты;
- вздутия живота;
- бессонницы;
- цефалгии;
- болей в животе;
- метеоризмов;
- рвоты;
- сонливости;
- экстрапирамидных расстройств;
- тремора конечностей.
В редких случаях возможны временные изменения в показателях крови.
Торин является отечественным аналогом Сертралина, и отличается от него только своей стоимостью.
Смотрите также:
ТОП 11 аналогов Тофизопама — заменители по терапевтическому действию
Особые группы пациентов
◊ Пациенты с больными почками
Особый подбор доз не требуется [1].
◊ Пациенты с больной печенью
Снизить дозы или принимать в два раза реже [1].
◊ Пациенты с больным сердцем
Полезен при восстановлении депрессивных пациентов после инфаркта.
◊ Пожилые пациенты
Некоторым лучше подходят низкие дозы.
◊ Дети и подростки
- Необходимо регулярно и лично проверять состояние пациента, в особенности первые недели лечения.
- Проинформировать взрослых о рисках.
- Одобрен для лечения ОКР
- Возраст 6-12: начальная доза 25 мг/день
- С 13 лет – взрослые дозы [1].
◊ Беременные
- Не рекомендуется беременным, в особенности в первом триместре [9]
- Следует взвесить и сравнить все риски
- При родах можно ожидать кровотечение
◊ Грудное вскармливание
- Лекарство проникает в грудное молоко.
- Если младенец показывает признаки раздражения или седации, следует прекратить кормление или прием сертралина
- Однако лечение после родов может быть необходимым, поэтому следует взвесить все риски.
- Сертралин доказал эффективность при лечении послеродовой депрессии
- Сертралин является наиболее изученным антидепрессантом, применяемом у женщин, кормящих грудью. Он является предпочтительным антидепрессантом в период лактации [8].
Особые указания по применению препарата Сертралин
Во время лечения антидепрессивными или антиобсессивными средствами возможны случаи обострения мании или гипомании, судороги. При появлении судорог во всех случаях сертралин необходимо отменить. Больным с депрессией свойственна склонность к суицидальным попыткам, поэтому в начале лечения такие больные должны находиться под строгим наблюдением врача. Эффективность и безопасность применения сертралина у детей в возрасте до 6 лет не установлены. Сертралин следует применять в период беременности лишь в том случае, когда предполагаемая польза для матери превышает возможный риск для плода. Женщинам репродуктивного возраста во время лечения сертралином необходимо использовать адекватные методы контрацепции. Сведения о проникновении сертралина в грудное молоко отсутствуют, поэтому не рекомендуется назначать его в период кормления грудью.
Взаимодействие с другими веществами
- Трамадол повышает риск судорог
- Нельзя использовать с ингибиторами МАО. После окончания приема ингибиторов МАО должно пройти 14 дней. Начинать лечение ингибиторами МАО через 7 дней после окончания приема циталопрама.
- Вместе с антикоагулянтами, вероятно, повышает риск кровотечений.
- Тесты мочи на бензодиазепины могут давать ложноположительный результат у тех, кто принимает сертралин.
- Из-за ингибирования CYP450 2D6 сертралин может повысить уровень тиоридазина и вызвать аритмию
- Из-за ингибирования CYP450 3А4 сертралин может повысить уровень алпрозалама, буспирона и триазолама
- Посредством ингибирования CYP450 3A4 сертралин теоретически может повышать концентрации определенных ингибиторов HMG-CoA-редуктазы, снижающих уровень холестерина, особенно симвастатина, аторвастатина и ловастатина, но не правастатина или флувастатина, что увеличило бы риск рабдомиолиза. Таким образом, совместное введение сертралина с определенными ингибиторами HMG CoA редуктазы следует проводить с осторожностью
Взаимодействия препарата Сертралин
Возможны выраженные реакции (симптомы, напоминающие cеротониновый синдром) у больных, получающих сертралин в сочетании с ингибиторами МАО. К симптомам взаимодействия селективных ингибиторов обратного захвата серотонина и ингибиторов МАО относятся: гипертермия, ригидность, судороги мышц, автономная нестабильность, изменения психического состояния (спутанность сознания, раздражительность и чрезмерное возбуждение с развитием делирия и комы). В связи с этим сертралин не следует применять в комбинации с ингибиторами МАО и назначать его в течение 14 дней после прекращения лечения ими. Назначать ингибитор МАО можно не ранее чем через 14 дней после отмены сертралина. При одновременном назначении сертралина с другими серотонинергическими препаратами (триптофан, фенфлурамин) необходимо соблюдать осторожность и при возможности избегать подобной комбинации в связи с существующей вероятностью фармакодинамического взаимодействия. Замену других антидепрессантов или антиобсессивных препаратов на сертралин следует проводить крайне осторожно, особенно при замене препаратов с длительным действием (например флуоксетин). Одновременный прием сертралина в дозе 200 мг/сут не потенцирует эффекты алкоголя, карбамазепина, галоперидола или фенитоина на когнитивную и психомоторную функцию у здоровых людей; тем не менее, следует избегать одновременного приема сертралина и алкоголя. Одновременный прием сертралина с диазепамом или толбутамидом приводит к небольшому, но статистически достоверному изменению некоторых фармакокинетических параметров. Циметидин вызывает существенное снижение клиренса сертралина при их сочетанном применении. Клиническое значение этого эффекта неизвестно. Сертралин не оказывал влияния на β-адреноблокирующую активность атенолола. Признаков взаимодействия сертралина в дозе 200 мг/сут с глибенкламидом и дигоксином не выявлено. При одновременном приеме сертралина в дозе 200 мг/сут и варфарина наблюдалось небольшое, но статистически достоверное увеличение протромбинового времени; клиническое значение этого эффекта неизвестно. В связи с этим следует тщательно контролировать показатель протромбинового времени в начале терапии сертралином и после его отмены. Необходимо соблюдать осторожность при одновременном назначении сертралина с такими препаратами, как литий, эффект которых может быть опосредован серотонинергическими механизмами.
Побочные эффекты и другие риски
◊ Механизм появления побочных эффектов
- Побочные эффекты вызваны повышением серотонина. Большинство побочных эффектов возникают сразу после начала лечения и со временем уходят, в то время как терапевтические эффекты со временем усиливаются.
- Сертралин может влиять на обратный захват дофамина, что может привести к ажитации и тревожности в начале лечения. С другой стороны, повышение уровня серотонина может вызывать снижение высвобождения дофамина и может способствовать замедлению когнитивных функций и развитию апатии у некоторых пациентов.
◊ Побочные эффекты
- Гастроэнтерологические (сниженный аппетит, тошнота, понос, запор)
- Бессонница, седация, ажитация, тремор, головная боль
- Потливость Редкая гипонатриемия у пожилых (проходит после прекращения приёма сертралина) [1]
- Опасные побочные эффекты: судороги, мания, суицидальные идеи
- Набор веса: редко
- Седация: редко
- Сексуальная дисфункция: да (дозо-зависимый эффект)
◊ Что делать с побочными эффектами
- Ждать;
- Если сертралин активирует, принимать утром;
- Снизить дозу до 25 мг или 12,5 мг, когда побочные эффекты пройдут, поднять дозу;
- Если побочные эффекты не уходят, сменить препарат [1]
◊ Длительное использование
Безопасно
◊ Привыкание
Нет.
◊ Передозировка
- Очень редкие случаи фатальных передозировок. Летальные исходы связаны с сочетанием сертралина с алкоголем и наркотиками.
- Рвота, седация, нарушение сердечного ритма.
Советы эксперта
- Антидепрессант с лучше всего доказанной кардиологической безопасностью.
- По сравнению с некоторыми другими антидепрессантами чаще вызывает гастроэнтерологические побочные эффекты (диарея) [1].
- Сертралин показывает эффективность при лечении депрессии у пациентов с сосудистыми когнитивными нарушениями [5].
- Может быть более эффективным лечением для женщин с ПТСР или депрессией, чем для мужчин с ПТСР или депрессией, но клиническая значимость этого неизвестна
- СИОЗС могут быть менее эффективными у женщин старше 50 лет, особенно если они не принимают эстроген
- Некоторые данные свидетельствуют о том, что лечение сертралином только во время лютеиновой фазы может быть более эффективным, чем непрерывное лечение пациентов с ПМДР.
- В комбинации с оланзапином сертралин показал свою эффективность в лечении психотической депрессии [10]. При этом важно учитывать, что сертралин повышает клиренс оланзапина на 30%. Причём такой эффект трудно объяснять взаимодейтсвием препаратов на уровне цитохромов. Возможно, это связно с P-гликопротеином.
- Тот факт, что сертралин может метаболизироваться несколькими путями, клинически полезен: он менее восприимчив к лекарственным взаимодействиям, чем антидепрессанты, которые полагаются только на один фермент или путь в качестве своего основного метаболического пути.
- Дополнительное преимущество сертралина над некоторыми другими СИОЗС (особенно флуоксетином, пароксетином и флувоксамином) заключается в том, что он не является сильным ингибитором какого-либо конкретного фермента CYP [10].
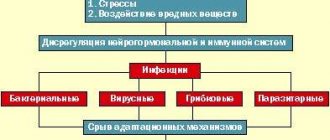
Эпилепсия относится к заболеваниям с высокими показателями распространенности и заболеваемости во всем мире, причем у четверти больных заболевание является пожизненным [13, 15]. Поэтому терапия эпилепсии и, в частности, ее парциальных форм является важной проблемой практической эпилептологии.
Основным критерием оптимальной терапевтической эффективности является достижение купирования припадков с помощью подбора индивидуальной дозы противоэпилептических препаратов (ПЭП) [9, 17]. Но даже адекватно подобранная монотерапия с использованием максимально разрешенных доз ПЭП не во всех случаях позволяет достигнуть контроля над приступами [36]. Так, у 20—30% пациентов с парциальной эпилепсией отмечается отсутствие положительного ответа на ПЭП [20, 28, 36, 37, 45]. В сложившейся ситуации становится актуальной проблема выбора дополнительного ПЭП.
В качестве препаратов первого выбора при парциальной эпилепсии традиционно назначаются карбамазепины или вальпроаты, обладающие высоким потенциалом возникновения лекарственного взаимодействия, что необходимо учитывать при выборе дополнительного ПЭП. В качестве последнего может быть использован новейший ПЭП прегабалин (ПГБ), который не метаболизируется в печени и не связывается с белками плазмы, не имеет индуцирующего или ингибирующего действия на энзимы печени [22]. Эффективность ПГБ в качестве дополнительной терапии у пациентов, страдающих рефрактерной парциальной эпилепсией, была установлена как отечественными [3, 8], так и зарубежными исследователями [18, 19, 21, 27, 29, 38, 42—44]. Подробный обзор литературы, посвященной политерапии парциальной эпилепсии с применением ПГБ, был представлен в работе С.Г. Бурдом и соавт. в 2009 г. [5]. Дополнительно заметим, что в ряде работ [16, 26, 40, 41] показана эффективность применения ПГБ у больных эпилепсией с тревожными расстройствами.
На протяжении последних лет в структуре психической заболеваемости отмечаются рост форм эпилепсии с непсихотическими депрессивными и тревожными расстройствами и снижение удельного веса эпилептических психозов, что отражает очевидный патоморфоз клинических проявлений болезни. Речь идет об увеличении числа больных эпилепсией с указанными расстройствами (с 11 до 66%) [10, 11, 14, 47]. Следует отметить, что среди больных эпилепсией превалируют лица с атипичными депрессиями, в том числе с тревожно-депрессивными состояниями [4]. Тревожные расстройства, по данным одних авторов [23], отмечаются у 48%, а по данным других [25, 47] — у 66% больных эпилепсией. При этом есть данные о том, что у больных эпилепсией преобладают явления личностной тревожности [24]. Существует точка зрения [23, 32], что иногда тревожные и депрессивные нарушения больше влияют на социальное функционирование больных эпилепсией, чем припадки.
Последние исследования [35] показали, что существует целый ряд общих для эпилепсии и депрессии патогенетических механизмов. Кроме того, не только наличие эпилепсии повышает риск формирования депрессии, но и наличие депрессии у больного является фактором риска развития в будущем эпилептических припадков и эпилепсии [1, 30, 31, 35].
Сказанное выше свидетельствует о том, что при эпилепсии на личностном уровне формируется когнитивно-эмоционально-поведенческий комплекс расстройств, опосредующий поведение и социальное функционирование пациента [6, 12] и его отношение к болезни [2, 6, 7].
Современная стратегия терапии эпилепсии предполагает при выборе ПЭП учет не только типа и частоты припадков, но и коррекцию сопутствующих психических нарушений [48]. Депрессивные и тревожные расстройства у больных эпилепсией в этом отношении должны привлекать особое внимание. Их коррекция требует дополнительного назначения антидепрессантов. Высокую эффективность в этих случаях (сравнимую с кломипрамином и моклобемидом), особенно при наличии атипичной депрессии, показал сертралин (CEP) [39, 46]. Было установлено, что СЕР безопасен в отношении предрасположенности к судорогам, минимально взаимодействует с ПЭП [4, 33, 34].
Цель настоящего исследования — изучение эффективности и переносимости комбинированной терапии СЕР (золофт) и ПГБ (лирика) у больных парциальной формой эпилепсии с частыми приступами — депрессивными и тревожными расстройствами, получающих базовые ПЭП в режиме монотерапии.
Материал и методы
Исследование выполнено на базе городского эпилептологического центра Санкт-Петербурга.
Оценивали влияние комбинированной терапии на течение заболевания. В 1-й группе в дополнение к базовой терапии ПЭП назначался ПГБ в суточной дозе 300 мг в сочетании с СЕР 100 мг в сутки. Во 2-й группе, помимо базовой терапии ПЭП, больные получали только СЕР 100 мг в сутки.
Изучали влияние указанной терапии на частоту припадков, степень выраженности депрессивной и тревожной симптоматики, влияние этих характеристик на тип отношения к болезни, его динамику, анализ переносимости и безопасности вышеуказанной комбинированной терапии.
В исследование включались больные с парциальной эпилепсией с недостаточным контролем припадков (показатель редукции 60%) и наличием в клинической картине генерализованного тревожного расстройства и нарушений депрессивного спектра непсихотического уровня. В исследование не включались пациенты, принимающие более одного ПЭП, антипсихотические препараты, транквилизаторы, антидепрессанты, больные с прогрессирующими заболеваниями нервной системы, пациенты, употребляющие наркотические препараты или алкоголь, пациенты, не соблюдающие режим терапии, а также беременные и кормящие женщины.
Для оценки эффективности терапии применялись: шкала оценки депрессии Монтгомери-Асберга (Montgomery-Asberg Depression Rating Scale, MADRS), шкала оценки тревоги Гамильтона (Hamilton Anxiety Rating Scale, HARS).
Психологическая диагностика типов отношения к болезни проводилась по методике ТОБОЛ, разработанной в Санкт-Петербургском научно-исследовательском психоневрологическом институте им. В.М. Бехтерева [6, 7]. Эта методика позволяет диагностировать следующие 12 типов отношения к болезни: гармоничный (Г), эргопатический (Р), анозогнозический (З), тревожный (Т), ипохондрический (И), неврастенический (Н), меланхолический (М), апатический (А), сенситивный (С), эгоцентрический (Э), паранойяльный (П) и дисфорический (Д). 12 типов отношения к болезни объединены в три блока. При объединении типов в блоки были выбраны два критерия: «адаптивность—дезадаптивность», которая отражает влияние отношения к болезни на адаптацию личности больного, и «интер- и интрапсихическая направленность» дезадаптации (в случае дезадаптивного характера отношения). Таким образом, тип отношения к болезни может определяться по наивысшему или наивысшим значениям шкал, что и было положено в основу разработки конкретного правила диагностики типа (или типов при их смешении) на основании совокупности шкальных оценок. Первый блок (I) включает Г, Р и З типы отношения к болезни, при которых психическая и социальная адаптация существенно не нарушается. Второй блок (II) включает Т, И, Н, М, А типы отношения к болезни, для которых характерна интрапсихическая направленность личностного реагирования на болезнь, обусловливающая нарушения социальной адаптации больных с этими типами реагирования. В третий блок (III) вошли С, Э, П и Д типы отношения к болезни, для которых характерна интерпсихическая направленность личностного реагирования на болезнь, также обусловливающая нарушения социальной адаптации больных. Таким образом, тип отношения к болезни может определяться по наивысшему или наивысшим значениям шкал, что и было положено в основу разработки конкретного правила диагностики типа (или типов при их смешении) на основании совокупности шкальных оценок. Существо диагностического правила сводится к определению шкалы с максимальной оценкой и других шкал, оценки которых находятся в так называемой диагностической зоне, т.е. отстоят от максимальной не более чем на пороговый интервал. Если в диагностической зоне оказывается одна шкала, то диагностируется «чистый» тип, соответствующий этой шкале, если две или три, то «смешанный», если более трех — «диффузный» [7].
Всего наблюдали 89 больных. Из них 46 пациентов, 22 мужчины и 24 женщины, составили 1-ю группу. Средняя частота припадков у этих больных была 3,26±1,53 в месяц, средний возраст больных на момент включения в исследование (0-й день) — 37,39±4,37 года, средняя длительность заболевания — 8,11±2,85 года, средний балл по шкале HARS — 30,95±4,79, средний балл по шкале MADRS — 24,09±3,32. Во 2-ю группу вошли 43 пациента, 21 мужчина и 22 женщины, со средней частотой припадков 3,14±1,15 в месяц, средним возрастом 39,12±4,84 года, средней длительностью заболевания 7,53±3,44 года; средний балл по шкале HARS у них составлял 32,93±5,75, средний балл по шкале MADRS — 25,39±3,03.
В качестве базовых ПЭП, на фоне которых применялись ПГБ и СЕР, в 1-й группе использовались: вальпроаты — у 4 (8,7%) пациентов, карбамазепины — у 7 (15,2%), окскарбазепин — у 15 (32,6%), топирамат — у 9 (19,6%), ламотриджин — у 5 (10,9%) и леветирацетам — у 6 (13,0%). Базовая терапия ПЭП во 2-й группе была следующей: вальпроатами лечились 3 (7,0%) пациента, карбамазепином — 5 (11,6%), окскарбазепином — 16 (37,2%), топираматом — 8 (18,6%), ламотриджином — 4 (9,3%) и леветирацетамом — 7 (16,3%). Следует отметить, что большинству пациентов с парциальной формой эпилепсии был назначен окскарбазепин, что соответствует современным рекомендациям Российской противоэпилептической лиги.
Исследуемые группы были сопоставимы по возрасту, средней частоте припадков в месяц, длительности заболевания, набору ПЭП и среднему баллу по HARS и MADRS, что позволяет считать их статистически однородными.
Длительность исследования составила 6 мес. Эффективность терапии оценивалась в конце 1, 2, 4-го и 6-го месяцев.
Приведем схему титрования ПГБ: на 1-й неделе пациенты получали 75 мг ПГБ в сутки вечером, на 2-й — 150 мг (в 2 приема), на 3-й — 225 мг (в 2 приема), а начиная с 4-й недели и до завершения исследования — 300 мг ПГБ в сутки (в 2 приема). СЕР у пациентов обеих групп титровался следующим образом: на 1-й неделе — 50 мг утром, на 2-й — 50 мг утром и 50 мг вечером.
В процессе исследования из 1-й группы выбыли 4 больных: 1 (2,2%) отказался от приема ПГБ ввиду высокой стоимости терапии, 2 (4,4%) были исключены в связи с нарушением режима терапии и 1 (2,2%) пациент был исключен в связи с развитием диспепсии и слабости. Таким образом, в 1-й группе исследование завершили 42 пациента. Из 2-й группы выбыли 2 больных: 1 (2,3%) в связи с жалобами на головокружение и тремор, 1 (2,3%) попросил назначить вместо СЕР более дешевый препарат (был переведен на амитриптилин). Исследование завершили 41 пациент. В окончательную обработку данных вошли результаты больных, завершивших исследование.
Статистическая обработка данных проводилась с помощью программы Statistica (версия 6). Для анализа количественных нормально распределенных признаков применялся параметрический метод (t
-критерий Стьюдента). С целью оценки взаимосвязи количественных признаков использовался непараметрический метод (ранговая корреляция по Спирмену, p).
Результаты и обсуждение
В табл. 1
| Таблица1 |
представлены результаты исследования степени редукции припадков у больных эпилепсией 1-й и 2-й групп в течение исследования по отношению к первоначальной частоте припадков в зависимости от длительности терапии. Как следует из этой таблицы, к концу 1-го месяца терапии у пациентов 1-й группы частота припадков достоверно снизилась по сравнению с исходной (р<0,05). К концу 2-го, 4-го и 6-го месяцев степень редукции припадков по сравнению с исходной еще более увеличилась (р<0,005, р<0,001, р<0,001 соответственно).
У пациентов же 2-й группы частота припадков не изменилась. Таким образом, только применение ПГБ в дозе 300 мг в сутки в качестве дополнительной терапии у больных с парциальной формой эпилепсии способствует статистически значимой редукции количества припадков.
Рассмотрим теперь влияние комбинированной терапии на выраженность тревожности (табл. 2).
| Таблица2 |
| ]]> |
В обеих группах больных эпилепсией была отмечена статистически значимая редукция таких нарушений. Данные, представленные в табл. 2, свидетельствуют о том, что к концу 1-го месяца терапии у пациентов обеих групп наблюдалось значительное уменьшение степени выраженности тревоги, однако у пациентов 1-й группы это уменьшение оказалось более выраженным (t= –6,17; p<0,001). Это отмечалось в конце 2-го (t= –3,93; p<0,001), 4-го (t= –6,15; p<0,001) и 6-го (t= –11,76; p<0,001) месяцев терапии. Таким образом, у пациентов 1-й группы, получающих в составе комплексной терапии ПГБ в дозе 300 мг в сутки, степень редукции тревожной симптоматики оказалась выше, чем у больных 2-й группы.
Далее приводятся данные, касающиеся выраженности нарушений депрессивного спектра. Из табл. 3
| Таблица3 |
| ]]> |
следует, что редукция депрессивной симптоматики на фоне терапии была статистически значимой в обеих группах и различия между 1-й и 2-й группами имели место только в конце 1-го (t= –2,33; p<0,05) и 4-го (t= –3,07; p<0,005) месяцев терапии.
Тип отношения к болезни, его структурные компоненты и клинико-динамические соотношения были проанализированы до начала лечения, в конце 2-го и 6-го месяцев терапии (табл. 4).
| Таблица4 |
| ]]> |
Следует подчеркнуть, что «чистые» типы отношения к болезни диагностировались редко. Несколько чаще наблюдались «диффузные» типы отношения к болезни, и очень часто встречались «смешанные». До начала терапии 1-я и 2-я группы по показателям ТОБОЛ не отличались (p>0,05). Для больных эпилепсией характерно смешанное отношение к болезни с преобладанием шкальных оценок по II и III блокам методики ТОБОЛ, что свидетельствует о наличии выраженной социальной дезадаптации в связи с ситуацией болезни. Сравнение групповых характеристик отношения к болезни по структурным компонентам I блока демонстрирует, что величина Г, Р и З составляющих (типы без выраженных нарушений психической и социальной адаптации) была низкой у больных обеих групп. Анализ данных, полученных при рассмотрении средних показателей II блока, демонстрирует значительное преобладание всех его компонентов у больных обеих групп, что указывает на высокий уровень психической дезадаптации, связанной преимущественно с интрапсихической направленностью реагирования на болезнь. Результаты анализа средних показателей структурных компонентов III блока демонстрируют высокий уровень психической дезадаптации, связанной преимущественно с интерпсихической направленностью реагирования на болезнь.
При сравнении двух указанных групп пациентов в конце 2-го месяца комбинированной терапии выявлены статистически значимые различия для всех составляющих I блока методики ТОБОЛ (см. табл. 4). Показано, что Г, Р и З составляющие были ниже у больных 2-й группы. При анализе показателей II блока обнаружено преобладание Т, И и Н компонентов у пациентов 2-й группы. Исключение составили М и А компоненты, значения которых в обеих группах статистически значимо не различались. III блок характеризовался отсутствием значимых различий в обеих группах за исключением С составляющей, доминирующей у больных 2-й группы. К концу 6-го месяца исследования выявленная динамика показателей I блока методики ТОБОЛ сохраняется. Во II и III блоках методики ТОБОЛ отмечается преобладание всех составляющих у пациентов 2-й группы.
Далее приводится графическое отображение динамики структурных компонентов методики ТОБОЛ в исследованных группах до начала лечения, к концу 2-го и 6-го месяцев терапии (см. рисунок).
| Средние показатели (баллы) ТОБОЛ в исследуемых группах до начала терапии (а), через 2 мес (б) и 6 мес (в). |
| ]]> |
| Примечание. По оси абсцисс — типы отношения к болезни. |
К концу 2-го месяца терапии у пациентов 1-й группы выявляется стойкая динамика показателей ТОБОЛ в виде повышения составляющих компонентов I блока: Г (t= –15,87; p<0,001), Р (t= –15,35; p<0,001) и З (t= –3,19; p<0,001). II блок отличался обратной динамикой: уменьшились показатели следующих его компонентов: Т (t=10,76; p<0,001), И (t=8,58; p<0,001), Н (t=18,44; p<0,001), М (t=12,46; p<0,001) и А (t=11,11; p<0,001).
В III блоке уменьшились значения следующих компонентов: С (t=5,48; p<0,001), Э (t=2,93; p<0,005) и Д (t=6,62; p<0,001). Статистически значимых колебаний П компонента выявлено не было (t=1,34; p>0,05). Пациенты 2-й группы также характеризовались положительной динамикой показателей ТОБОЛ: увеличение Г (t= –11,31; p<0,001) и Р (t= –11,67; p<0,001) составляющих. Значение З составляющей статистически значимо не изменилось (t= –1,36; p>0,05). На фоне проводимой терапии снизились показатели следующих компонентов II блока: Т (t=9,12; p<0,001), И (t=3,62; p<0,001), Н (t=9,32; p<0,001), М (t=10,91; p<0,001) и А (t=7,29; p<0,001). III блок характеризовался уменьшением значений С (t=5,33; p<0,001) и Д (t=2,98; p<0,005) компонентов. Значения Э (t=1,04; p>0,05) и П (t=1,84; p>0,05) составляющих у пациентов 2-й группы не изменились.
К концу 6-го месяца терапии у пациентов обеих групп отмечается однонаправленная динамика показателей ТОБОЛ в виде повышения составляющих компонентов I блока: Г (1-я группа: t= –26,20; p<0,001 и 2-я группа: t= –22,35; p<0,001), Р (1-я группа: t= –21,32; p<0,001 и 2-я группа: t= –15,34; p<0,001) и З (1-я группа: t= –10,96; p<0,001 и 2-я группа: t= –6,71; p<0,001). Обе группы характеризовались снижением удельного веса всех компонентов II блока: Т (1-я группа: t=21,74; p<0,001 и 2-я группа: t=18,26; p<0,001), И (1-я группа: t=19,53; p<0,001 и 2-я группа: t=11,13; p<0,001), Н (1-я группа: t=28,24; p<0,001 и 2-я группа: t=20,19; p<0,001), М (1-я группа: t=28,61; p<0,001 и 2-я группа: t=24,06; p<0,001) и А (1-я группа: t=21,23; p<0,001 и 2-я группа: t=15,34; p<0,001). Показатели III блока уменьшились для следующих составляющих: С (1-я группа: t=13,12; p<0,001 и 2-я группа: t=11,25; p<0,001), Э (1-я группа: t=8,44; p<0,001 и 2-я группа: t=3,68; p<0,001), П (1-я группа: t=11,54; p<0,001 и 2-я группа: t=10,32; p<0,001) и Д (1-я группа: t=12,03; p<0,001 и 2-я группа: t=14,69; p<0,001).
Нами был проведен также анализ корреляционных связей в 1-й группе до начала терапии, показавший наличие множественных зависимостей между структурными компонентами методики ТОБОЛ (табл. 5).
| Таблица5 |
| ]]> |
Из табл. 5 видно, что снижение Г составляющей сопряжено с повышением значений по шкалам Р, З, Т, И, Н, М, С, Э и Д, что указывает на взаимосвязь между наличием психопатологической симптоматики и дезадаптивным типом отношения к болезни. Г тип отношения к болезни чаще наблюдается у больных с меньшей выраженностью психопатологических проявлений. В свою очередь повышение показателей Р связано с повышением значений З, Т, И, Н, М, С, Э и Д, а также со снижением значений по шкале Г. Пациенты стремятся, несмотря на болезнь, продолжить активно работать. Нередко Р тип отношения к болезни становится своеобразной «защитой» от негативных психоэмоциональных переживаний («уход от болезни в работу»). З тип отношения к болезни у больных эпилепсией находится в обратной зависимости от уровня Т, И, Н, М, С, Э и Д типов реагирования на болезнь. При анозогнозии повышаются показатели по шкале Р. Т тип отношения к болезни тесно связан с высокими показателями по шкалам Р, И, Н, М, С, П и Д. Чем выше уровень тревоги, тем чаще встречаются Р, И, Н, М, С, П и Д реакции на факт заболевания эпилепсией. Исключение составляют пациенты с А типом отношения к болезни — при нарастании симптомов апатии Т реакции практически не встречалась. При Т типе реакции на болезнь также снижается выраженность Г и З вариантов реагирования на болезнь. Ипохондрический радикал в структуре типа отношения к болезни тесно взаимосвязан с такими показателями личностного реагирования, как Р, Т, Н, М, С, Э, П и Д. Исключение составляют показатели по шкалам Г, З и А: чем больше выраженность И типа реакции, тем меньше значения Г, З и А. Н компонент типа отношения к болезни был тесно связан с высокими показателями по шкалам Р, Т, И, М, С, Э, П и Д. Чем выше был показатель по шкале Н, тем ниже значения по шкалам Г и З. М тип отношения к болезни также редко встречался в чистом виде: наиболее распространенными были сочетания его с Р, Т, И, Н, С, Э и Д. В свою очередь у больных с высокими показателями по шкале М отмечалось снижение значений Г, З и А. Наиболее низкие показатели по шкале А наблюдались у больных с высокими значениями по шкалам Т, И, М, С и П. Компонент С коррелировал с высокими показателями по шкалам Р, Т, И, Н, М и низкими баллами по шкалам Г, З и А. Э тип отношения к болезни чаще наблюдался у больных эпилепсией с высоким удельным весом таких признаков, как Р, И, Н, М, и низким процентом баллов по шкалам Г и З. Для больных с П типом отношения к болезни были характерны высокие показатели по шкалам Т, И, Н, С, Д и низкие по шкале А. Д радикал в структуре типа отношения к болезни в значительной степени был связан с высокими уровнями по шкалам Р, Т, И, Н, М, С и П. У больных с высокими показателями по шкалам Г и З признаки Д наблюдались редко.
Обратимся к анализу корреляционных зависимостей по данным методики ТОБОЛ у пациентов 2-й группы.
Как видно из табл. 6,
| Таблица6 |
| ]]> |
увеличение значений по шкалам Р, Т, И, Н, М, А, С, Э и П сопряжено со снижением значений шкалы Г. Повышение показателей по шкале Р связано с повышением уровней З, Т, И, Н, М, Э, П и Д, а также со снижением значений по шкале А. При З типе отношения к болезни повышаются показатели по шкале Р, Э, П и уменьшаются значения И, Н, Д. Т тип отношения к болезни тесно связан с высокими показателями по шкалам Р, И, Н, М, С, Э, П, Д и низкими показателями по шкалам Г и А. Признаки И в структуре типа отношения к болезни тесно взаимосвязаны с такими показателями личностного реагирования, как Р, Т, Н, М, С, Э, П и Д. Исключение составляют показатели по шкалам Г, З и А: чем больше выраженность И типа реакции, тем меньше значения Г, З и А. Н радикал типа отношения к болезни был тесно связан с высокими показателями по шкалам Р, Т, И, М, С, Э, П и Д. Чем выше был показатель по шкале Н, тем ниже были значения по шкалам Г и З. Высокие значения по шкале М чаще наблюдались в сочетании с высокими уровнями Р, Т, И, Н, С и П. В свою очередь у больных с высокими показателями по шкале М отмечалось снижение значений по шкале Г. Низкие значения по шкале А наблюдались у больных с высокими значениями по шкалам Г, Р, Т и И. С тип отношения к болезни был связан с высокими показателями по шкалам Т, И, Н, М, С, П, Д и низкими баллами по шкале Г. Э направленность типа отношения к болезни чаще наблюдалась у больных эпилепсией с высокими значениями Р, З, Т, И, Н, С, П, Д и низкими баллами по шкале Г. Для больных с П типом отношения к болезни были характерны высокие показатели по шкалам Р, З, Т, И, Н, М, С, Э и низкие по шкале Г. Д радикал в структуре типа отношения к болезни в значительной степени коррелировал с высокими уровнями по шкалам Р, Т, И, Н, С, Э и П. У больных с высокими показателями по шкалам З проявления Д компонента отмечались редко.
Таким образом, анализ средних показателей профиля типа отношения к болезни в исследованных группах характеризовался низкими значениями блока I, высокими значениями блока II и более низкими по сравнению с блоком II значениями блока III. Таким образом, больные парциальной формой эпилепсии демонстрировали дезадаптивный тип отношения к болезни.
Анализ переносимости комбинированной терапии показал следующее: в 1-й группе транзиторные побочные эффекты легкой и умеренной степени выраженности, не требующие отмены лечения, выявились у 9 (21,6%) пациентов, отсутствие побочных эффектов отмечено у 33 (78,4%) больных. Среди побочных эффектов у 3 (7,2%) пациентов отмечалась диспепсия, у 2 (4,8%) — головная боль, у 2 (4,8%) — головокружение. В единичных случаях выявлялись тремор — 1 (2,4%) больной и тахикардия — 1 (2,4%). У пациентов 2-й группы транзиторные побочные эффекты легкой и умеренной степени выраженности развились у 10 (24,0%) пациентов. У 2 (4,8%) выявлена диспепсия, у 2 (4,8%) — головокружение, у 2 (4,8%) — сонливость, у 2 (4,8%) — замедление психических и двигательных реакций. Редко обнаруживались головная боль — 1 (2,4%) пациент и шаткость походки — 1 (2,4%). У 31 (76,0%) больного побочных эффектов не обнаружено. Таким образом, переносимость комбинированной терапии больными была достаточно хорошей. У пациентов, получающих в качестве дополнительной терапии ПГБ в дозе 300 мг в сутки, не было выявлено статистически значимого преобладания побочных эффектов по сравнению с больными 2-й группы (21,6 и 24,0% соответственно).
Настоящее исследование подчеркнуло значимость проблемы психических расстройств у больных эпилепсией как одной из наиболее частых причин нарушения социального функционирования. У всех пациентов до начала исследования выявлялись клинически значимые проявления тревоги и депрессии. Больные эпилепсией характеризовались смешанным типом отношения к болезни с преобладанием шкальных оценок по II и III блокам методики ТОБОЛ, что свидетельствует о наличии выраженной социальной дезадаптации в связи с ситуацией болезни. Показано, что присутствие в клинической картине аффективных и тревожных нарушений было связано с формированием дезадаптивных типов реагирования на болезнь преимущественно с интра- и интерпсихической направленностью эмоционально-поведенческих девиаций. Проведен анализ корреляционных зависимостей по данным методики ТОБОЛ у больных эпилепсией, позволивший сформулировать более точное представление о внутренней картине болезни при эпилепсии и ее структурно-динамических компонентах.
К концу исследования у пациентов обеих групп отмечалась однонаправленная положительная динамика показателей ТОБОЛ в виде повышения значений всех составляющих компонентов I блока и снижения удельного веса всех компонентов II и III блоков. Результаты проведенного исследования позволили сделать вывод о том, что задачей терапии больных эпилепсией на современном этапе является не только достижение редукции пароксизмальных проявлений, но и направленное воздействие на сопутствующие аффективные и тревожные нарушения. По данным исследования установлено, что СЕР в дозе 100 мг в сутки не влияет на частоту припадков у больных парциальной эпилепсией. Применение ПГБ в качестве дополнительной терапии способствовало статистически значимому снижению частоты припадков к концу 1-го месяца лечения. Психометрические показатели после курса лечения СЕР и ПГБ продемонстрировали высокую статистически значимую эффективность в лечении депрессивных и тревожных нарушений у больных эпилепсией. У пациентов, получавших в составе комплексной терапии ПГБ в дозе 300 мг в сутки, степень редукции тревожной симптоматики оказалась выше. Степень редукции депрессивной симптоматики на фоне проводимой терапии была статистически значимой в обеих группах, что обосновывает применение СЕР у данной категории больных. Переносимость комбинированной терапии больными была хорошей. Таким образом, ПГБ целесообразно рекомендовать в качестве дополнительного средства при длительной терапии тревожных расстройств при эпилепсии.