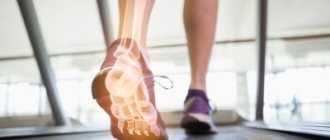
Что такое аксональная полинейропатия
Полиневропатия (второе название — полиневрит) — это клинический синдром, который возникает из-за ряда факторов, влияющих на периферическую нервную систему, и отличается размытыми патогенетическими изменениями. Заболевание занимает одно из лидирующих мест в перечне недугов периферической нервной системы, уступая первенство только вертеброгенной патологии, превосходящей по сложности клинической картины и последствиям, развивающимся из-за нее.
Аскональная полинейропатия считается междисциплинарной проблемой, с ней часто сталкиваются доктора различных специализаций. В первую очередь с данным заболеванием обращаются к неврологу. Частота возникающего синдрома неизвестна, так как отсутствуют статистические данные.
На данный момент известны всего три важных патоморфологических механизма, которые лежат в истоках формирования полинейропатии:
- валлеровская дегенерация;
- первичная демиелинизация;
- первичная аксонопатия.
В соответствии с иммунологической теорией полинейропатия является результатом перекрестного образования иммунных глобулинов, уничтожающих собственные клетки, в результате чего возникает некроз тканей и мышечное воспаление.
Исследователи выдвигают ряд гипотез возникновения и проблем течения аксональной полинейропатии:
- Сосудистая. Базируется на вовлечении в процесс сосудов, по которым кислород и питательные вещества поступают в периферические нервы. Изменяются характеристики крови по качественному и количественному составу, что может привести к ишемии нервных окончаний.
- Теория оксидативного стресса. Позиционирует формирование болезни со стороны нарушения обмена оксида азота, вследствие чего изменяются калий-натриевые механизмы, лежащие в основе формирования нервного возбуждения и проведения импульсов по нервам.
- Теория деактивации факторов роста нерва. Говорит о том, что болезнь возникает из-за недостатка аксонального транспорта с последующим развитием аксонопатии.
- Иммунологическая. Объясняет развитие заболевания в результате перекрестного образования антител к структурам периферической нервной системы, которое сопровождается аутоиммунным воспалением, а затем и некрозом нервов.
Даже при использовании ультрасовременных методов диагностики сложно найти достоверную причину патологии, выяснить ее получается только у 50-70% пострадавших.
Факторов возникновения полинейропатии нижних конечностей по аксональному типу очень много. Однако даже инновационные способы исследования не позволяют установить истинную этиологию заболевания.
Мнение эксперта
Автор: Алексей Владимирович Васильев
Руководитель НПЦ болезни двигательного нейрона/БАС, кандидат медицинских наук, врач высшей категории
Аксональная полинейропатия — это одно из самых опасных неврологических заболеваний, сопровождающееся поражением периферической нервной системы. При болезни разрушаются периферические нервные волокна.
Причин возникновение аксональной полинейропатии несколько. Самые распространенные:
- Сахарный диабет нарушает структуру крови, питающей нервы, в свою очередь происходит сбой в обменных процессах.
- Длительный дефицит витаминов В. Именно они максимально важны для правильной работы нервной системы, поэтому долгая нехватка способна привести к аксональной полинейропатии.
- Воздействие токсинов на организм. К ним относят разнообразные отравляющие вещества, например, алкоголь, а также ВИЧ. При отравлении опасными веществами заболевание может развиться уже через несколько дней.
- Наследственный фактор.
- Синдром Гийена-Барре.
- Различные травмы, к которым также относится длительное сдавливание нервов, которое характерно при грыже или остеохондрозе.
Лечение аксональной полинейропатии обязательно должно быть комплексным, иначе нужного эффекта достичь не удастся. Категорически запрещается заниматься самолечением и при возникновении первых же симптомов нужно срочно обратиться к доктору. Врачи Юсуповской больницы подбирают лечение индивидуально для каждого пациента. В зависимости от тяжести патологии и симптоматики назначается комплексное лечение под наблюдением опытных специалистов.
Архів
Скорочений виклад
Dana L. Newswanger, Charles R. Warren Am Fam Physician 2004;69:2405-10.
Синдром Гійєна-Барре (СГБ) — епонім для гетерогенної групи імунно-опосередкованих периферичних нейропатій. Рисою, спільною для всіх варіантів СГБ, є швидко наростаюча полірадикулонейропатія, якій передує певна пускова подія, найчастіше інфекція. Цей стан загалом маніфестується у вигляді симетричного моторного паралічу з сенсорними та вегетативними розладами або без них.
У різних країнах світу були проведені популяційні дослідження, в яких намагалися оцінити річну частоту СГБ — загалом дослідники зійшлися на цифрах 1–3 випадки/100 тис. осіб на рік. Він трапляється у всіх вікових групах, хоча дещо рідше в дітей. У віковому діапазоні від народження до 30 років середньорічна частота відносно стабільна — 1,3–1,9 випадки/100 тис. осіб. Перший пік захворюваності корелює з підвищеним ризиком інфікування цитомегаловірусом та Campylobacter jejuni. Причина наступного піку захворюваності в осіб похилого віку невідома, але, ймовірно, викликана дефектами імуносупресорних механізмів. Ще однією закономірністю є еволюція частоти захворювання у жінок під час вагітності та в післяпологовому періоді. Згідно з великим епідеміологічним дослідженням, проведеним у Швеції, його рівень низький протягом періоду вагітності, але підвищується протягом наступних кількох місяців після пологів.
У хворого на СГБ останній проявляється слабістю, котра супроводжується пекучими дизестезіями в кінцівках. Вона більше виражена у проксимальних відділах кінцівок; частіше в ногах, а не руках. Трапляються парестезії, які поширюються проксимально, але не далі зап’ясть і щиколоток. Глибокі сухожилкові рефлекси зникають в інтервалі кількох днів після виникнення симптомів.
Прогресуюча фаза синдрому триває від кількох днів до чотирьох тижнів. Близько 73% пацієнтів досягають піку порушення функцій за 7 днів, 98% — за 4 тижні. За прогресуючою фазою йде фаза плато (персистуючі, незмінні симптоми), після цього починається відновлення. Період часу до зникнення проявів хвороби дуже коливається серед різних пацієнтів.
Унаслідок залучення черепних нервів у пацієнтів можуть бути розлади з боку повітроносних шляхів, мімічних та окорухових м’язів, ковтання. Таких хворих слід госпіталізувати для динамічного спостереження. Приблизно 30% осіб, які захворіли на СГБ, у певний момент хвороби потребуватимуть зовнішньої допоміжної вентиляції. Поганий прогноз головним чином пов’язаний із важким ступенем хвороби — рівень смертності досягає 20%, переважно в пацієнтів, які потребують зовнішньої підтримки дихання. Біль, ще одна поширена ознака СГБ, трапляється приблизно в половини хворих й інколи має дуже неприємний характер, посилюючись навіть при спробах зробити мінімальні рухи. Він найвираженіший у м’язах пояса верхніх кінцівок, спині і задній частині стегон. Суб’єктивно хворі описують його як неприємне відчуття, котре нагадує м’язевий дискомфорт, виникаючий після фізичних вправ. Біль може супроводжуватися м’язовими спазмами і найсильніший уночі.
Діагноз
СГБ — найпоширеніший варіант швидко прогресуючого захворювання периферичної нервової системи. Однак із ним, особливо на початку хвороби, плутають кілька інших розладів (таблиця 1).
Таблиця 1. Диференціальна діагностика і прояви захворювань, що відрізняються від синдрому Гійєна-Барре
| Закупорка основної артерії (асиметричний парез кінцівок) Ботулізм (низхідний параліч) Інтоксикація важкими металами (дезорієнтація, психоз, синдром органічного ураження головного мозку) Гіпофосфатемія (дратівливість, тривожність, гіпервентиляційний синдром, нормальні показники ліквору) Метаболічні міопатії (також супроводжуються симптомами ураження головного мозку та мозочка) Міастенія (слабість, що зменшується після відпочинку) Неопластичний менінгіт (асиметричний спастичний параліч) Отруєння нейротоксинами морських продуктів (спонтанне одужання в інтервалі 24 годин) Паранеопластична нейропатія (хронічний стан) Поліомієліт (суто руховий розлад з менінгітом) Поліміозит (хронічний стан, уражаються м’язи проксимальних відділів кінцівок) Стиснення спинного мозку (асиметричність неврологічних симптомів) Кліщовий параліч (відсутні чутливі розлади, нормальні показники ліквору) Поперечний мієліт (раптова двобічна слабість ніг, висхідний сенсорний дефіцит) Васкулітні нейропатії (мононейропатія) |
Діагноз СГБ ґрунтується на типових клінічних проявах; у його верифікації досить помічні електрофізіологічна діагностика та дослідження спинномозкової рідини (СМР) (таблиця 2).
Таблиця 2. Діагностичні критерії типового синдрому Гійєна-Барре
| Ознаки, необхідні для постановки діагнозу |
| Прогресуюча двобічна слабість рук та ніг Арефлексія |
| Ознаки, що чітко підтверджують діагноз |
| ППрогресування симптомів протягом кількох днів (максимум — до чотирьох тижнів) Відносна симетричність проявів Незначні чутливі симптоми Залучення черепних нервів (особливо двобічна слабість мімічних м’язів) Одужання починається через 2–4 тижні після припинення прогресування Вегетативні порушення Відсутність гарячки на початку хвороби Висока концентрація білка в лікворі, кількість клітин — до 10 клітин/мм3 Типові результати електрофізіологічних досліджень |
| Ознаки, що виключають діагноз |
| Діагноз ботулізму, міастенії, поліомієліту чи токсичної нейропатії Порушений метаболізм порфірину Дифтерія у недавньому анамнезі Суто чутливі симптоми без слабості |
| Діагноз синдрому Гійєна-Барре ґрунтується на типових клінічних симптомах, даних електрофізіологічних обстежень та аналізах спинномозкової рідини. |
Головні дані електрофізіологічних методів дослідження, які дозволяють припустити СГБ, — відсутність Н-рефлексу, низька амплітуда чи відсутність потенціалів дії чутливих нервів, патологічна F-хвиля. На їх основі можна вирішувати питання щодо специфічного лікування на початку захворювання, але точний діагноз ставиться лише приблизно на 5 день після розвитку симптомів.
Характерними змінами в СМР є підвищення білка (більше 0,55 г/дл) без плеоцитозу (підвищеної кількості клітин у лікворі). Часто СМР є нормальною в перші 48 годин після розвитку симптомів, але під кінець першого тижня після цього рівень білка в ній підвищується. Із підвищенням кількості лейкоцитів ліквору (від 10 до 100 клітин/мм3) у хворого з типовими ознаками СГБ зростає ймовірність хвороби Лайма, новотвору, СНІДу, саркоїдного менінгіту та інших захворювань.
СГБ має п’ять відмінних підваріантів: гостра запальна демієлінізуюча полірадикулонейропатія (ГЗДП), гостра моторна аксональна нейропатія (ГМАН), гостра моторно-сенсорна аксональна нейропатія (ГМСАН), синдром Міллера Фішера і гостра вегетативна нейропатія. Згідно з певними припущеннями, загалом аксональні форми мають гірший прогноз, що вказує на потребу визначення специфічного різновиду хвороби. Останні розрізняють електрофізіологічно і патологоанатомічно (таблиця 3).
Таблиця 3. Різновиди синдрому Гійєна-Барре
| Гостра запальна демієлінізуюча полірадикулонейропатія (ГЗДП) |
| Автоімунний розлад, опосередкований антитілами Запускається вірусною чи бактеріальною інфекцією, котра передує самому захворюванню Електрофізіологічні дослідження демонструють демієлінізацію Запальна демієлінізація може супроводжуватися руйнуванням аксонів Ремієлінізація наявна після припинення імунних реакцій |
| Гостра моторна аксональна нейропатія (ГМАН) |
| Суто моторна аксональна форма нейропатії 66% хворих є серопозитивними на кампілобактеріоз При електрофізіологічних дослідженнях чутливі нерви незмінені, функції моторних — знижені чи повністю порушені Одужання зазвичай набагато швидше Високий відсоток хворих — діти |
| Гостра моторно-сенсорна аксональна нейропатія (ГМСАН) |
| Подібне до валлерівського переродження мієлінізованих моторних і сенсорних волокон Мінімальні запалення і демієлінізація Близька до ГМАН, за винятком того, що при ГМСАН уражуються сенсорні нерви і корінці Зазвичай хворіють дорослі |
| Синдром Міллера Фішера |
| Рідкісний стан Швидко еволюціонуюча атаксія, арефлексія, легка слабість у кінцівках і офтальмоплегія Втрата чутливості нетипова, але може порушуватися пропріоцепція Демієлінізація та запалення III і VI черепних нервів, спинномозкових вузлів і периферичних нервів Знижені чи відсутні потенціали дії чутливих нервів, зазвичай відсутній тибіальний Н-рефлекс Зникнення симптомів настає за 1–3 місяці |
| Гостра вегетативна нейропатія |
| Найрідкісніший варіант синдрома Гійєна-Барре Залучається як симпатична, так і парасимпатична нервова система Частими є серцево-судинні розлади (постуральна гіпотензія, тахікардія, гіпертензія, аритмії) Погіршення зору, сухість в очах і ангідроз Одужання поступове і часто неповне Часто поєднується з чутливими симптомами |
| Терапію з допомогою плазмаферезу і внутрішньовенного вливання високих доз імуноглобуліну слід починати відразу після постановки діагнозу. |
Події, що передують захворюванню
Гострі інфекційні хвороби є загальновідомими подіями, що передують СГБ у 2/3 випадків. Перехресне реагування між патогеном і нервовою тканиною запускає автоімунну реакцію. Пацієнти зазвичай повідомляють про інфекції дихальних шляхів або гастроентерит, котрі минають на початку нейропатії.
Результати дослідження за типом “випадок-контроль”, проведеного в 1995 році у 103 пацієнтів із СГБ, виявило, що 26% з них серопозитивні на C. jejuni
порівняно з 2% у групі контролю і 1% у групі контролю, співмірною за віком. 70% хворих, інфікованих
C. jejuni
, повідомляли про наявність поносів в інтервалі 12 тижнів перед початком неврологічних проявів. Іншими тригерними інфекціями є цитомегаловірус, ВІЛ, вірус Епштейна-Барра і вітряної віспи.
Електрофізіологічні дослідження демонструють, що ГМАН і ГМСАН трапляються частіше у хворих на СГБ, інфікованих C. jejuni
, порівняно з ГЗДП. Інфікування
C. jejuni
також асоціюється з повільнішим одужанням, аксональною дегенерацією і важкою залишковою інвалідизацією.
Недавня імунізація від грипу також була пов’язана із СГБ. В одному дослідженні зроблено огляд усіх випадків СГБ в періоди піку захворюваності на грип у 1992–1993 і 1993–1994 роках і виявлено ризик його розвитку в 1–2 випадки на 1 млн. вакцинацій.
Згідно з даними 2003 року Системи нагляду за побічними ефектами після вакцинації, керованої з Центру запобігання і контролю над хворобами та Адміністрації з ліків і харчових продуктів США, ризик розвитку пов’язаного з імунізацією СГБ є менший порівняно з ризиком розвитку важкого грипу. Крім того, незважаючи на збільшення дози призначуваної вакцини за останні чотири сезони грипу, кількість випадків СГБ залишається стабільною.
Лікування
Лікування СГБ включає два компоненти: підтримуючу (базову) і специфічну терапію. Якщо хворий проходить через гостру фазу захворювання, то в більшості випадків функції відновлюються. Однак інколи полінейропатія може наростати настільки швидко, що ендотрахеальна інтубація і механічна вентиляція будуть необхідними в інтервалі доби від появи симптомів.
Тому всіх хворих з СГБ слід госпіталізувати для постійного спостереження на предмет дихальної недостатності, порушень функцій черепних нервів і вегетативних розладів. Останні можуть маніфестуватися у вигляді коливань артеріального тиску, серцевих аритмій, ознак псевдонепрохідності шлунково-кишкового каналу і затримки сечовипускання. Слід забезпечити профілактику тромбозу глибоких вен, оскільки такі пацієнти часто залишаються знерухомленими протягом багатьох тижнів.
При розвитку слабості дихальних м’язів необхідно розглянути можливість вибіркової ендотрахеальної інтубації. Прогресування дихальної недостатності реально передбачити з допомогою певних параметрів (таблиця 4).
Таблиця 4. Показання для інтубації
| Форсована життєва ємність легень менше 20 мл/кг |
| Максимальний інспіраторний тиск менше 30 мм Н2О |
| Максимальний експіраторний тиск менше 40 мм Н2О |
| Прогресування констатують при зниженні життєвої ємності легень, максимального інспіраторного чи експіраторного тиску більш ніж на 30% |
Хворі, неспроможні підтримувати мінімальне функціонування легень, потребують інтубації. Постійна серійна оцінка дихальних показників при швидкому прогресуванні є критично важливою. Додатковими предикторами необхідності механічної вентиляції є: (1) період часу від початку СГБ до госпіталізації до 7 днів; (2) нездатність хворого самостійно підняти лікті чи голову; (3) нездатність хворого стояти; (4) відсутність ефекту від кашлю у видаленні харкотиння і (5) підвищення рівня ферментів печінки. Предикторами необхідності механічної вентиляції у хворих із уже виміряною життєвою ємністю є період часу від початку СГБ до госпіталізації до 7 днів, нездатність пацієнта самотужки підняти голову і показники життєвої ємності менше 60% від попередньо передбачуваних.
У таких пацієнтів також треба лікувати біль, одну з важливих скарг. Наркотичні засоби необхідно застосовувати з застереженням через підвищений ризик кишкової непрохідності. Фізіотерапія із залученням поверхневого масажу, пасивних фізичних вправ і частої зміни положення тіла може дати певне полегшення болю. Для цього ж використовують як ад’ювантну терапію карбамазепін (тегретол) і габапентин (нейронтин). Пацієнти, котрі приймали ці агенти, менше потребували знечулення наркотиками, мали мінімалізовані побічні ефекти та седацію порівняно з тими, хто застосовував плацебо.
Специфічну терапію треба починати незабаром після постановки діагнозу. Це внутрішньовенне вливання високих доз імуноглобуліну (ВВІг; з розрахунку 400 мг/кг/день протягом 5 днів) чи плазмаферез (5 сеансів протягом 5–8 днів). Для визначення того, наскільки ВВІг ефективніше порівняно з плазмаферезом при СГБ, було розроблене і реалізоване багатоцентрове дослідження із залученням 150 хворих протягом 4 тижнів. У ньому не спостерігалося статистично достовірної різниці в рівнях інвалідизації серед обох груп. Виявили, що ВВІг і плазмаферез однаково ефективні. Нещодавно проведений мета-аналіз найбільших досліджень за базою даних Cochrane засвідчив, що обидва методи дають свій ефект у прискоренні одужання при СГБ у пацієнтів, які потребують сторонньої допомоги під час ходьби.
В іншому багатоцентровому контрольованому дослідженні з залученням 380 хворих не спостерігали додаткових переваг при поєднанні ВВІг і плазмаферезу порівняно з монотерапією — різниця в рівнях рецидивів не була статистично значущою. Імунотерапію слід починати дуже рано, відразу після появи моторних симптомів, водночас вона не обов’язкова в легких випадках без чітких рухових дефектів.
Пацієнти, котрим рано почали застосовувати плазмаферез, рідше потребували механічної вентиляції і в них був коротший період госпіталізації. При цій процедурі відбувається відфільтрування з крові циркулюючих імунних комплексів, які мають дотичність до патогенезу СГБ. Об’єднана французька група з плазмаферезу при СГБ дійшла висновку, що для хворих з легкими проявами хвороби достатньо і двох сеансів, пацієнтам же із важчими формами будуть необхідні два додаткові сеанси. Існують деякі розходження стосовно оптимальної кількості процедур, але згідно з даними практично всіх досліджень виражений ефект наступає за 4–6 сеансів. Сьогодні цей метод лікування вважається єдиним, що ефективніший від ізольованої підтримуючої терапії. Більше того, хоча він і найліпший у пацієнтів, здатних ходити, та в інтервалі 2 тижнів від початку хвороби, він має свої позитивні аспекти і в іммобілізованих хворих у діапазоні аж до 30 днів від розвитку захворювання.
Недоліками плазмаферезу є рідкісні ускладнення типу сепсису, котрі можуть бути викликані зниженням рівня імуноглобулінів крові. При використанні для замінного вливання свіжозамороженої плазми існує ризик зараження вірусними інфекціями (гепатитом, СНІДом).
ВВІг має певні переваги над плазмаферезом, оскільки його легше виконати, воно дає менше ускладнень і зручніше для хворого. Цей метод рекомендують у хворих з СГБ, котрі не можуть рухатися без сторонньої допомоги в інтервалі 2–4 тижнів від виникнення симптомів. Вважається, що при його використанні відбувається модуляція імунної системи через доволі гетерогенні механізми із залученням постійних і варіабельних регіонів у молекулах IgG, а також рецепторах макрофагів і В-клітин. Патологічні антитіла можуть зв’язуватися IgG, що посилює їх видалення. Крім того, через активацію поки що неясного механізму відбувається посилення функцій CD8+ T-клітин.
Незважаючи на всі позитивні аспекти, при терапії з допомогою ВВІг існують певні побічні ефекти, зокрема, збільшення об’єму плазми, тому імуноглобуліни слід обережно вливати при застійній серцевій і нирковій недостатності. У хворих може розвинутися гарячка, міальгії, болі голови, нудота і блювання, але ці “грипоподібні” симптоми зникають спонтанно, без будь-якого лікування. Також іноді може мати місце асептичний менінгіт, нейтропенія і гіпертензія. Дані про анафілактичні реакції на імуноглобуліни в анамнезі є протипоказанням для повторного застосування останніх. Ризик зараження гепатитом С останнім часом дуже знизився із поширенням модифікованих очищених форм препаратів.
Колись припускали, що кортикостероїди корисні в лікуванні СГБ внаслідок їх імуносупресорних властивостей. Проте аналіз рандомізованих досліджень за базою даних Cochrane, в яких здійснювали гормонотерапію та уникали її, не продемонстрував якоїсь різниці в сенсі прогнозу. Нині цей клас препаратів виключений із стандартних схем терапії СГБ.
Прогноз і одужання
Приблизно 85% хворих із СГБ досягають повного і функціонального одужання в інтервалі 6–12 місяців. Максимальне воно за 18 місяців від початку хвороби. Однак у деяких хворих спостерігають персистуючі слабість, арефлексію і парестезії. Близько 7–15% пацієнтів мають залишкові неврологічні наслідки типу двобічного парезу стопи, атрофій м’язів кистей, сенситивної атаксії і дизестезій. Рівень смертності становить менше 5% у спеціалізованих центрах. Причинами смерті є респіраторний дистрес-синдром дорослих, сепсис, тромбоемболія легеневої артерії і зупинка серця.
Кілька факторів гострої фази захворювання є предикторами поганого одужання. Це вік понад 60 років; важка, швидко прогресуюча форма хвороби; низька амплітуда провідності по нервах при дистальній стимуляції, що свідчить про аксональне руйнування. Допоміжними чинниками є тривала механічна вентиляція протягом більш ніж 1 місяця і наявність захворювання легень перед розвитком СГБ. У цілому ж поганий довготерміновий прогноз безпосередньо пов’язаний із ступенем важкості гострої фази і затримкою ініціації специфічної терапії. Рецидиви трапляються в малого відсотка випадків (3–5%), вони достовірно не пов’язані з напрямком лікування чи якимись іншими факторами.
Підготував Юрій Матвієнко
- 1 Дизестезія — виникнення відчуття, неадекватного подразнику (наприклад, торкання сприймається як біль, больовий подразник, як температурний і т. ін.). Можлива ознака патології тім’яної частки кори великих півкуль, таламуса або чутливих провідників спинного мозку.
- 2 Парестезія — спонтанно виникаюче відчуття заніміння, поколювання, “повзання мурашок”, обпікання, стягування; зазвичай короткотривале, спостерігається при ураженні периферичних нервів кінцівок, інколи — при подразненні кори постцентральної закрутки.
- 3Хвороба Лайма — рецидивуюче мультисистемне захворювання, спричинене Borrelia burgdorferi, яке у більшості випадків починається з хронічної мігруючої еритеми, супроводжуваної міальгіями, артритами великих суглобів, симптомами ураження нервової і серцево-судинної систем.
- 4 Валлерівське переродження — жирова дегенерація нервових волокон, відділених від трофічного центру нейрона (його тіла).
- 5 Атаксія — симптомокомплекс порушень статики і координації у зв’язку з розладом узгодженої роботи м’язів агоністів і антагоністів, виникаючий при ураженні мозочка чи його зв’язків, лобових часток кори, вестибулярної системи, тракту глибокої чутливості.
- 6 Офтальмоплегія — знерухомлення очного яблука. Найчастіше виникає при поєднаному ураженні окорухових черепних нервів (окорухового, блокового і відвідного).
- 7 Пропріоцепція — здатність відчувати подразнення пропріоцепторів, закладених у глибині тканин. При рухах забезпечує зворотну аферентацію і таким чином контроль над виконуваним руховим актом.
- 8 Плазмаферез — видалення плазми із забраної крові з ретрансфузією формених елементів крові донору. Застосовується в терапії нейро-імунних захворювань (синдрому Гійєна-Барре, міастенії, розсіяного склерозу).
- 9 Сенситивна атаксія — синдром статико-координаторних порушень, виникаючий при ураженні тракту глибокої чутливості на різних рівнях (периферичні нерви, задні стовпи білої речовини спинного мозку, медіальна петля стовбура головного мозку, таламус). Характерною ознакою є наростання атактичних явищ при відсутності візуального контролю з боку пацієнта.
Причины
Самые распространенные причины возникновения аксональной полинейропатии нижних конечностей:
- истощение организма;
- длительный недостаток витаминов группы В;
- недуги, ведущие к дистрофии;
- острые инфекции;
- токсическое поражение ртутью, свинцом, кадмием, угарным газом, спиртными напитками, метиловым спиртом, фосфорорганическими соединениями, медицинскими препаратами, принимаемыми без согласования с врачом;
- болезни сердечно-сосудистой, кроветворной, кровеносной и лимфатической систем;
- эндокринологические патологии, в том числе инсулинозависимость.
Главными факторами, которые провоцируют развитие моторной или сенсомоторной аксональной полинейропатии, являются:
- эндогенная интоксикация при почечной недостаточности;
- аутоиммунные процессы, протекающие в организме;
- амилоидоз;
- вдыхание токсических веществ или паров.
Также болезнь может быть обусловлена наследственностью.
Нехватка в организме витаминов группы В, а в особенности пиридоксина и цианокобаламина, крайне негативно воздействует на проводимость нервных и моторных волокон и может вызывать сенсорную аксональную полинейропатию нижних конечностей. Это же происходит при хронической алкогольной интоксикации, глистной инвазии, заболеваниях желудочно-кишечного тракта, которые ухудшают скорость всасывания.
Токсическое отравление лекарственными препаратами, аминогликозидами, золотыми солями и висмутом занимают большой процент в структуре факторов аксональной невропатии.
У пациентов с сахарным диабетом нарушена функция периферических нервов из-за нейротоксичности кетоновых тел, то есть метаболитов жирных кислот. Происходит это из-за невозможности организма использовать глюкозу как главный источник энергии. Поэтому вместо нее окисляются жиры.
При аутоиммунных заболеваниях, протекающих в организме, иммунная система человека атакует собственные нервные волокна, воспринимая их как источник опасности. Это происходит из-за провокации иммунитета, возникающей при неосторожном приеме иммуностимулирующих медикаментов и нетрадиционных методик лечения. Поэтому у людей, которые склонны к возникновению аутоиммунных заболеваний, пусковыми факторами аксональной полинейропатии являются:
- иммуностимуляторы;
- вакцины;
- аутогемотерапия.
При амилоидозе в организме накапливается такой белок, как амилоид. Именно он нарушает основные функции нервных волокон.
Причины периферической нейропатии
Есть много факторов, которые могут вызвать периферическую нейропатию, поэтому часто бывает трудно определить причину болезни. В целом нейропатия классифицируется на три основных группы:
- Приобретенные невропатии
, вызванные воздействием токсинов, травмой, болезнями или инфекциями. Известные причины приобретенной нейропатии включают: Диабет; - Некоторые редкие наследственные заболевания;
- Алкоголизм;
- Плохое питание и дефицит витаминов;
- Некоторые виды рака и воздействие химиотерапии, применяемой для их лечения;
- Ситуации, когда нервы подвергаются атаке иммунной системы организма;
- Некоторые лекарства;
- Заболевания почек или щитовидной железы;
- Некоторые инфекции (болезнь Лайма, СПИД).
встречаются не так часто. Наследственная невропатия это заболевание периферических нервов, которое генетически передается от родителей к ребенку.
диагностируется тогда, когда причины заболевания не известны. К этой категории относится примерно треть всех невропатий.
Первые признаки
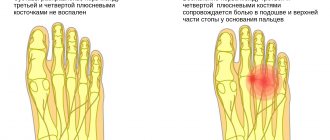
Заболевание обычно начинает развиваться с поражения толстых или тонких нервных волокон. Зачастую аксональная полинейропатия имеет дистальное симметричное распределение на кисти или стопы. Нейропатия чаще всего сначала поражает нижние конечности, а затем симметрично распространяется вверх по телу. К самым частым первичным симптомам поражения относят:
- мышечную слабость;
- болевой синдром в конечностях;
- жжение;
- ощущение ползания мурашек;
- онемение кожных покровов.
Симптоматика ярче всего проявляется в вечернее и ночное время суток.
Симптомы
Врачи подразделяют хроническое, острое и подострое течение аксональной полинейропатии. Заболевание подразделяется на два вида: первично-аксональный и демиелинизирующий. В ходе течения болезни к ней присовокупляется демиелинизация, а затем и вторично аксональный компонент.
К основным проявлениям недуга относятся:
- вялость в мышцах ног или рук;
- спастический паралич конечностей;
- чувство подергивания в мышечных волокнах;
- головокружение при резкой перемене положения тела;
- отек конечностей;
- жжение;
- покалывание;
- ощущение ползания мурашек;
- снижение чувствительности кожных покровов к высокой или низкой температуре, боли и касаниям;
- нарушение ясности речи;
- проблемы с координацией.
Вегетативными признаками сенсомоторной полинейропатии асконального типа считаются следующие симптомы:
- учащенный или, напротив, замедленный сердечный ритм;
- неумеренное потоотделение;
- чрезмерная сухость кожи;
- изменение цвета кожных покровов;
- нарушение эякуляции;
- эректильная дисфункция;
- проблемы с мочеиспусканием;
- сбой двигательных функций желудочно-кишечного тракта;
- повышенное слюнотечение или, наоборот, сухость во рту;
- расстройство аккомодации глаза.
Заболевание проявляется в нарушениях функций поврежденных нервов. Именно периферические нервные волокна отвечают за двигательные функции мышечной ткани, чувствительность, а также оказывают вегетативное воздействие, то есть регулируют сосудистый тонус.
Для нарушения функции проводимости нервов характерны расстройства чувствительности, например:
- чувство ползания мурашек;
- гиперестезия, то есть увеличение чувствительности кожи к внешним раздражителям;
- гипестезия, то есть уменьшение чувствительности;
- отсутствие ощущения собственных конечностей.
Когда поражены вегетативные волокна, то из-под контроля выходит регуляция сосудистого тонуса. При аксонально-демиелинизирующей полинейропатии наступает сдавление капилляров, из-за чего ткани отекают. Нижние, а затем и верхние конечности из-за скапливания в них жидкости существенно увеличиваются в размерах. Так как при полинейропатии нижних конечностей основное количество крови накапливается именно в пораженных областях тела, то у пациента возникает стойкое головокружение при принятии вертикального положения. Из-за того, что пропадает трофическая функция, могут возникнуть эрозивно-язвенные поражения нижних конечностей.
Аксональная моторная полинейропатия проявляется в двигательных нарушениях верхних и нижних конечностей. Когда моторные волокна, отвечающие за движения рук и ног, повреждены, то наступает полный или частичный паралич мышц. Обездвиживание может проявляться совершенно нетипично — может ощущаться как скованность мышечных волокон, так и чрезмерная их расслабленность. При средней степени поражения ослаблен мышечный тонус.
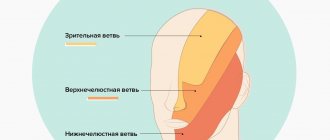
В ходе течения заболевания могут быть усилены или ослаблены сухожильные и надкостничные рефлексы. В редких случаях доктор-невролог их не наблюдает. При болезни часто могут быть поражены черепные нервы, которые проявляются следующими нарушениями:
- глухотой;
- онемением подъязычных мышц и мускулатуры языка;
- невозможностью проглотить еду или жидкость из-за проблем с глотательным рефлексом.
Когда поражен тройничный, лицевой или глазодвигательный нерв, изменяется чувствительность кожных покровов, развиваются параличи, возникает асимметрия лица и подергивание мышц. Иногда при диагностированной аксонально-демиелинизирующей полинейропатии поражения верхних или нижних конечностей могут быть асимметричными. Такое случается при множественной мононейропатии, когда коленные, ахилловы и карпорадиальные рефлексы несимметричны.
Диффузное аксональное повреждение головного мозга (вопросы визуализации)
К диффузному аксональному повреждению (ДАП) головного мозга относят распространенные разрывы аксонов в сочетании с мелкоочаговыми геморрагиями, обусловленные травмой преимущественно инерционного типа. При этом наиболее характерными территориями аксональных и сосудистых нарушений являются ствол мозга, мозолистое тело, паравентрикулярные зоны и белое вещество больших полушарий. Одновременно возможны скользящие парасагиттальные ушибы мозга.
При определенном опыте клинический диагноз ДАП вполне возможен. Однако его всегда следует подкрепить КТ или МРТ. На КТ диффузное аксональное повреждение характеризуется увеличением объема мозга различной степени (вследствие его отека, набухания, гиперемии) со сдавлением боковых и III желудочка, субарахноидальных конвекситальных пространств, а также цистерн основания мозга. При этом часто выявляются мелкоочаговые геморрагии в белом веществе полушарий мозга, мозолистом теле, а также в подкорковых и стволовых структурах (рис. 1).
Рис. 1. ДАП головного мозга тяжелой степени у пострадавшего 25 лет. КТ: верхний ряд – на 1-е сутки после ЧМТ, множественные мелкие очаговые кровоизлияния в глубинных отделах полушарий, субэпендимарно, в мозолистом теле, сдавление желудочковой системы; средний ряд – на 7-е сутки, увеличение размеров и плотности очаговых кровоизлияний; нижний ряд – через 2,5 месяца после ЧМТ, выраженные признаки атрофического процесса: расширение желудочковой системы, базальных и конвекситальных субарахноидальных пространств, межполушарной щели.
Вместе с тем еще в остром периоде обнаруживается довольно типичный для ДАП феномен скопления жидкости (с плотностными характеристиками ликвора) над лобными долями, преимущественно в передних отделах с одной или обеих сторон. При легких и среднетяжелых формах ДАП на КТ выявляются лишь признаки незначительного увеличения объема мозга либо компьютерная картина неотличима от нормальной. Повторные КТ-исследования, проведенные у больных с ДАП, обнаруживают довольно характерную динамику. Спустя 2–4 недели после травмы явления отека и набухания мозга регрессируют, мелкоочаговые геморрагии либо не визуализируются, либо становятся гиподенсивными. Вместе с тем начинают отчетливо вырисовываться базальные цистерны и конвекситальные субарахноидальные щели на фоне более или менее выраженной тенденции к расширению желудочковой системы. Вентрикуломегалия и другие признаки диффузного атрофического процесса часто в дальнейшем нарастают (см рис. 1).
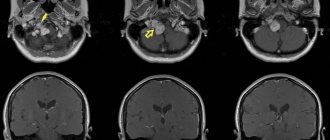
МРТ при ДАП обычно более информативна, чем КТ, четко визуализируя повреждения мозолистого тела, ствола, других образований. Наиболее частая находка – различные по размерам гиперинтенсивные участки на границе серого и белого вещества, в паравентрикулярных зонах, мозолистом теле, в стволе мозга (рис. 2). В дальнейшем интенсивность их изображения снижается. При мелких кровоизлияниях в местах поражения аксонов на томограммах по Т1 могут обнаруживаться признаки наличия дериватов окисления гемоглобина, особенно четко они выявляются при использовании режима SWAN. Множественные участки понижения сигнала на томограммах по Т2 и с использованием градиентного эхо могут наблюдаться в течение многих лет после травмы.
Рис. 2. ДАП тяжелой степени. МРТ на 3-и сутки после ЧМТ: а – по Т2 в сагиттальной проекции; б – по Т2 в аксиальной проекции, выражены посттравматические изменения в задней трети и валике мозолистого тела; в, г – по Т1 в аксиальной проекции, видны мелкие геморрагические очаги в лобной и височной долях, подушке зрительного бугра справа; глубокая кома. Через 2 месяца: д, е – по Т2, ж, з – по Т1. изменения в мозолистом теле уменьшились, кровоизлияния разрешились, умеренно расширились боковые желудочки; глубокая инвалидизация.
Диагностика
Главной методикой исследования, которая позволяет обнаружить локализацию патологического процесса и степень пораженности нервов, является электронейромиография.
Чтобы определить причину заболевания, врачи назначают следующие анализы:
- определение уровня сахара в плазме крови;
- токсикологические тесты;
- полный анализ мочи и крови;
- выявление уровня холестерина в организме.
Нарушение нервных функций устанавливается при помощи определения температурной, вибрационной и тактильной чувствительности.
При первичном осмотре применяется зрительная методика исследования. То есть врач, к которому обратился с жалобами пострадавший, осматривает и анализирует такие внешние симптомы, как:
- уровень давления крови в верхних и нижних конечностях;
- чувствительность кожных покровов к прикосновениям и температуре;
- наличие всех необходимых рефлексов;
- диагностика отечности;
- изучение внешнего состояния кожи.
Выявить аксональную полинейропатию можно при помощи следующих инструментальных исследований:
- магнитная резонансная томография;
- биопсия нервных волокон;
- электронейромиография.
Лечение аксональной полинейропатии
Лечение аксональной полинейропатии должно быть комплексным и направленным на причину развития заболевания, его механизмы и симптоматику. Гарантией эффективной терапии является своевременное выявление болезни и лечение, которое сопровождается абсолютным отказом от сигарет, алкоголя и наркотических веществ, ведением здорового образа жизни и соблюдением всех рекомендаций врача. В первую очередь проводятся следующие терапевтические мероприятия:
- избавление от токсического воздействия на организм, если оно присутствует;
- антиоксидантная терапия;
- прием препаратов, которые воздействуют на тонус кровеносных сосудов;
- восполнение дефицита витаминов;
- регулярный контроль концентрации глюкозы в плазме крови.
Отдельное внимание уделяется лечению, направленному на купирование острого болевого синдрома.
Если присутствуют периферические парезы, то есть существенное снижение мышечной силы с многократным уменьшением амплитуды движений, то в обязательном порядке показана лечебная физкультура и специальные физические упражнения, направленные на возвращение тонуса мышечным тканям и предотвращение образования различных контрактур. Особенно важна регулярная психологическая поддержка, которая не дает пациенту впасть в депрессию, сопровождающуюся расстройством сна и чрезмерной нервной возбудимостью.
Лечение аксональной полинейропатии — это продолжительный процесс, так как нервные волокна восстанавливаются долго. Поэтому не стоит ожидать моментального выздоровления и возвращения к привычному образу жизни. Медикаментозная терапия включает такие препараты, как:
- обезболивающее;
- глюкокортикоиды;
- витамины группы В;
- антиоксиданты;
- сосудорасширяющие;
- средства, ускоряющие метаболизм и улучшающие микроциркуляцию крови.
Терапия лекарственными препаратами направлена на восстановление функций нервов, улучшение проводимости нервных волокон и скорости передачи сигналов центральной нервной системе.
Лечение следует проводить длительными курсами, которые не стоит прерывать, хоть и эффект от них проявляется не сразу. Чтобы устранить болевые ощущения и расстройство сна, назначают следующие медикаменты:
- антидепрессанты;
- противосудорожные;
- препараты, купирующие аритмию;
- обезболивающие.
Для избавления от боли используют нестероидные противовоспалительные препараты. Но стоит помнить, что применять их можно только короткий промежуток времени, так как длительное употребление может привести к повреждению слизистой оболочки желудочно-кишечного тракта.
К физиотерапевтическим методам лечения аксональной полинейропатии относятся:
- терапия магнитными волнами;
- грязелечение;
- электростимуляция;
- иглоукалывание;
- лечебный массаж;
- физкультура;
- ультрафонофорез;
- гальванотерапия.
Именно лечебная физкультура позволяет сохранить работоспособность мышечных тканей и поддерживать конечности в нужном положении. Регулярные занятия спортом вернут мышцам тонус, гибкость и увеличат амплитуду движений до нормальной.
Профилактика
Пациент в обязательном порядке должен совершать профилактические мероприятия, которые помогут избежать рецидива или возникновения опасного заболевания. Они включают в себя обогащение рациона витаминами, регулярный контроль уровня сахара в крови, полный отказ от табакокурения, наркотических веществ и алкогольных напитков.
В целях профилактики болезни рекомендуется:
- носить удобную обувь, которая не пережимает стопу, ухудшая кровоток;
- регулярно осматривать обувь, чтобы избежать образования грибка;
- исключить пешие прогулки на длительные расстояния;
- не стоять долгое время на одном месте;
- мыть ноги прохладной водой или делать контрастные ванночки, что помогает улучшить циркуляцию крови в организме.
Пострадавшим в стадии ремиссии категорически запрещается принимать лекарственные препараты без согласования с лечащим врачом. Важно своевременно лечить воспалительные заболевания, соблюдать меры предосторожности при работе с токсическими веществами, которые оказывают пагубное воздействие на организм, регулярно выполнять лечебные физические упражнения.