Классификация атрофии челюстей и фенотипов костной ткани
В зависимости от положения челюсти, различают две группы, которые характеризуют атрофическое состояние верхней и нижней челюстей:
- По Шредеру для верхнего ряда. Существует три вида верхних челюстей с отсутствием зубов, в результате чего истончается костная ткань:
- Сильно заметны челюстные бугорки. В эти пробелы можно протезировать имплантаты, поскольку физические отклонения незаметны. Небо глубокое, а изгиб слизистой довольно большой.
- Альвеолярные отростки выражены нечетко. Глубина неба средняя. Протезирование возможно, но может быть ухудшение его фиксации после перенапряжение мышечной ткани.
- В основании челюсти кость серьезно разрушена. Гребни и бугры альвеол гладкие, а небо трансформируется в плоскую форму. Складка слизистой оболочки становится на уровне неба и плохо держит форму. В результате патологии протезирующие конструкции закрепить невозможно.
- По Келлеру для нижнего ряда:
- Альвеолярные элементы чуть сглажены, но видны на всей челюсти. В начале альвеолярного гребня крепятся мышечная ткань и складка слизистой оболочки. Установка протеза не вызывает затруднений.
- Гребень становится заметен и приобретает более острую форму. Мышцы крепятся у гребня. Имплантат в большинстве случаев вызывает дискомфорт и болезненные ощущения.
- Наблюдается зачастую у людей, перенесших раннее удаление боковых зубов. Альвеолы около моляров и премоляров истончаются. В центральной части костная ткань не теряет объем. Создание искусственных зубов возможно, но имеется вероятность соскальзывания имплантата при жевании.
- В области фронтальных резцов наблюдается яркий атрофический процесс, при этом боковой зубной ряд остается сохранен. Фиксация протеза не может быть сделана, т.к. повышается вероятность его смещения.
Причины
Основной причиной возникновения атрофии сетчатки глаза врачи называют ишемию, в процессе которой ухудшается питание тканей сетчатки, расположенной между стекловидным телом и сосудистой оболочкой глазного яблока. Под ишемией понимают ослабление кровоснабжения или полное его прекращение. В результате нее возникает острое или хроническое кислородное голодание тканей, приводящее к постепенному истощению сетчатки, то есть атрофии.
До настоящего момента офтальмологам не удалось окончательно сформировать перечень внутренних и внешних факторов, под действием которых начинается атрофия сетчатки. В перечень провокаторов ее развития
входят явления, негативно отражающиеся на функционировании кровеносной системы в целом:
- продолжительное курение;
- носительство цитомегаловируса;
- дефицит витаминов, особенно каротиноидов и антиоксидантов (витамина С, Е);
- избыток в рационе насыщенных и твердых жиров, а также продуктов, богатых холестерином;
- хроническая интоксикация организма вследствие проживания в экологически небезопасных регионах;
- системные хронические заболевания, включая сахарный диабет, гипертонию и системную красную волчанку;
- серьезные травмы шеи и головы.
Точные причины заболевания в большинстве случаев остаются неустановленными. Офтальмологи склонны называть атрофию сетчатки естественным возрастным процессом, ведь понятие «плохое» кровоснабжение у пожилых можно применить практически ко всем органам. Однако это не означает, что патологию можно оставлять без внимания: без поддерживающей терапии она способна привести к полной слепоте.
Имплантация при атрофии костной ткани челюсти
Для скорейшего восстановления зубного ряда применяются несколько методик. Например, установка мостовидных или съемных протезов. Однако данные способы не могут восстановить нужную нагрузку на кость, поскольку нагружаются десна или здоровые зубы.
Имплантация позволяет восполнить давление на кость и предупредить дальнейшее ее истончение.
В запущенных случаях, когда атрофия костной ткани челюсти значительна, используется перед имплантацией восстановление костной структуры. Применяются разные методики, к примеру, синус-лифтинг, разъединение отростка альвеолы, внедрение искусственной ткани. Через полгода после операции проводит вживление имплантатов. В результате этого сохраняется плотность и объем кости.
Новой методикой считается имплантация с немедленной нагрузкой. Специальные материалы устанавливаются не в альвеолярный отросток, а в базальную часть челюсти. Благодаря этому, кость сразу нагружается, а обмен веществ не нарушается. Подходит только при отсутствии трех и более зубов в ряду.
Диагностика
Диагноз атрофия сетчатки может быть поставлен после осмотра глазного дна. Для заболевания характерны очень специфические признаки: усиление пигментации макулы, разрозненные или сливающиеся атрофические очаги на сетчатке при сухой форме болезни, или отечность сетчатки с усилением сосудистого рисунка при влажной. Помогают определиться с диагнозом и субъективные жалобы пациента.
Для подтверждения диагноза используются инструментальные методы:
- биомикроскопия глаза, в процессе которой врач осматривает внутренние структуры органов зрения через специальную щелевую лампу под многократным увеличением;
- визометрия — измерение остроты зрения с помощью специальных таблиц: пациент рассматривает поочередно обоими глазами и называет изображения, на которые указывает врач;
- ангиография — рентгенографическое исследование сосудов глаз с контрастом;
- УЗ-сканирование с допплерографией, выявляющее непроходимость сосудов;
- КТ глаз, определяющее границы ишемии и атрофии сетчатки.
При выявлении сосудистых аномалий могут быть назначены дополнительные исследования: анализы крови на глюкозу и холестерин, общеклинические лабораторные анализы крови и мочи и т. д. Выписывает направления на обследования врач-офтальмолог. В дальнейшем могут быть привлечены врачи других специализаций: терапевты, хирурги, флебологи и кардиологи.
Виды и степени атрофии костной ткани челюстей
Деформация кости челюстей развивается с разной интенсивностью:
- I степень. В начале заболевания устраняется путем протезирования. Имплантат выполняет свою функцию, кровоснабжение не нарушается.
- II степень. Клиническая картина усиливается. Слизистая оболочка челюсти начинает уменьшаться. Протезирование зубов возможно, но перед этим требуется провести дополнительное лечение.
- III степень. Контур костной ткани сглаживается как с внутренней стороны ротовой полости, так и со стороны подбородка.
При подборе методики лечебной терапии следует учитывать данную характеристику развития патологии.Костная ткань уменьшается не только по высоте, но и по ширине. Кость становится короткой и тонкой.
Вагинальная атрофия: этиологические аспекты и современные подходы к терапии
Постменопауза характеризуется эстрогендефицитным состоянием у женщин, обусловленным возрастным снижением, а затем и прекращением функции яичников [1]. Как известно, любые эпителиальные ткани реагируют на изменение окружающей их гормональной среды сходным образом, но ни одна из них не может сравниться с эпителием свода влагалища и шейки матки по скорости и отчетливости реакции на гормоны, в первую очередь на половые стероиды [2]. Таким образом, урогенитальный тракт особенно чувствителен к снижению уровня эстрогенов и около половины всех женщин в постменопаузе испытывают симптомы, связанные с урогенитальной атрофией (УГА), затрагивающие половую функцию и качество жизни [3]. В клинической картине урогенитальных расстройств в климактерическом периоде выделяют симптомы, связанные с атрофией влагалища (вагинальная атрофия (ВА)), и расстройства мочеиспускания (цистоуретральная атрофия). В отличие от вазомоторных симптомов, которые обычно проходят со временем, симптомы вагинальной атрофии, как правило, возникают в пременопаузе и прогрессируют в постменопаузальном периоде, приводя к функциональным и анатомическим изменениям [4]. У 15% женщин в пременопаузе и 40–57% женщин в постменопаузе отмечаются симптомы ВА [5], такие как сухость влагалища 27–55%, жжение и зуд 18%, диспареуния 33–41%, а также повышенная восприимчивость к инфекционным заболеваниям органов малого таза 6–8% [4], что значительно ухудшает состояние здоровья, негативно влияет на общее и сексуальное качество жизни [6]. У 41% женщин в возрасте 50–79 лет есть хотя бы один из симптомов ВА [10].
Стенки влагалища состоят из трех слоев: внутреннего слоя, который выстлан многослойным плоским эпителием; среднего мышечного и наружного соединительнотканного слоев (или волокнистого слоя). Атрофические процессы, захватывающие соединительнотканные и мышечные структуры влагалища, а также мышцы тазового дна, уретры, мочевого пузыря, особенно выражены в слизистой влагалища. Известно, что у женщин слизистая оболочка влагалища состоит из четырех основных слоев эпителиальных клеток: базальный слой; парабазальный слой (или митотически-активный); промежуточный гликогенсодержащий слой; поверхностный (слущивающийся) [11]. Эстрогеновые рецепторы располагаются в основном в базальном и парабазальном слоях влагалища и практически отсутствуют в промежуточном и поверхностном [10]. Дефицит эстрогенов блокирует митотическую активность базального и парабазального слоев эпителия влагалищной стенки, а следовательно, и пролиферацию влагалищного эпителия [12]. Следствием прекращения пролиферативных процессов во влагалищном эпителии является исчезновение гликогена — питательной среды для лактобактерий, таким образом из влагалищного биотопа полностью элиминируется его основной компонент — лактобациллы [3, 12].
Известно, что перекись-продуцирующие лактобациллы, преобладающие в микробиоцинозе влагалища у женщин репродуктивного возраста, играют ключевую роль в предотвращении появления заболеваний урогенитального тракта [10, 11]. Вследствие расщепления гликогена, который образуется в эпителии влагалища при условии наличия достаточного количества эстрогенов, образуется молочная кислота, обеспечивающая кислую среду влагалища (в пределах колебаний рН от 3,8 до 4,4). Подобный защитный механизм приводит к подавлению роста патогенных и условно-патогенных бактерий. В период постменопаузы слизистая оболочка влагалища утрачивает эти защитные свойства, истончается, легко травмируется с последующим инфицированием не только патогенными, но и условно-патогенными микроорганизмами.
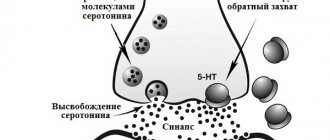
Эстрогены являются главными регуляторами физиологических процессов во влагалище. Эстрогеновые рецепторы α присутствует во влагалище в пременопаузе и постменопаузе, в то время как эстрогеновые рецепторы β полностью отсутствуют или имеют низкую экспрессию в вагинальной стенке у женщин в постменопаузе. Наиболее высокая плотность эстрогеновых рецепторов наблюдается во влагалище и уменьшается по направлению от внутренних половых органов к коже. Плотность андрогеновых рецепторов, наоборот, низкая во влагалище и более высокая в области наружных половых органов. Рецепторы прогестерона встречаются только во влагалище и эпителии вульвовагинального перехода [10]. Поскольку в клетках стромы влагалища содержатся рецепторы к эстрогенам, то коллаген, входящий в состав соединительной ткани влагалищной стенки, является эстроген-чувствительной структурой, содержание которого уменьшается по мере прогрессирования эстрогенного дефицита. Так как рецепторы к эстрогенам располагаются не только в эпителии и строме влагалищной стенки, но и в эндотелии сосудов, в постменопаузе отмечается снижение кровообращения во влагалище до уровня различной степени ишемии. К тому же эстрогены являются вазоактивными гормонами, которые увеличивают приток крови, стимулируя высвобождение эндотелиальных медиаторов, таких как оксид азота, простагландины и фактор гиперполяризации эндотелия. Подобное прогрессирующее снижение кровотока в слизистой влагалища приводит к гиалинизации коллагеновых и фрагментации эластических волокон, увеличивая количество соединительной ткани [12].
Эстрогеновые рецепторы были также обнаружены на вегетативных и сенсорных нейронах во влагалище и вульве. В исследовании T. L. Griebling, Z. Liao, P. G. Smith было выявлено уменьшение плотности сенсорных ноцицептивных нейронов во влагалище на фоне лечения эстрогенами. Эта особенность может быть полезна в целях устранения дискомфорта, связанного с ВА, а именно в облегчении симптомов, таких как жжение, зуд и диспареуния, с которыми сталкиваются многие женщины в постменопаузе [5, 10].
Атрофия слизистой вульвы и влагалища характеризуется истончением эпителия, уменьшением вагинальной складчатости, побледнением, наличием петехиальных кровоизлияний, признаков воспаления. Также вследствие инволютивных изменений происходит потеря упругости тканей, подкожно-жировой клетчатки и выпадение лобковых волос, снижение секреторной активности бартолиниевых желез [3, 13, 14]. Как правило, врачи диагностируют атрофию вульвы и влагалища на основании сочетания клинических симптомов и визуального осмотра. Исследователи все чаще настаивают на более объективных и воспроизводимых способах диагностики, не исключая субъективные жалобы пациента [13]. Исторически сложилось, что для диагностики ВА необходимы два основных объективных способа диагностики и оценки эффективности лечения: рН влагалища, а также подсчет вагинального индекса созревания (ВИС, преобладание клеток базального и парабазального слоев) [12, 13]. Интересно, что степень атрофических изменений, измеряемая индексом созревания, не всегда коррелирует с симптомами [15]. В исследовании, проведенном среди 135 менопаузальных женщин-добровольцев, которые прошли оценку симптомов, а затем рейтинг «вагинального здоровья» (оценка цвета влагалища, выделений, целостности и толщины эпителия, рН) и измерение индекса созревания, исследователи обнаружили слабую корреляцию между физическими проявлениями и индексом созревания.
Гормональные изменения, происходящие в течение жизненного цикла, оказывают влияние на вагинальную флору начиная от момента рождения до периода постменопаузы. Снижение эстрогенов в перименопаузе и постменопаузе приводит к уменьшению количества лактобактерий и изменению флоры в целом. Согласно данным S. L. Hillier, R. J. Lau, при детальном анализе микрофлоры влагалища 73 женщин в постменопаузе, не принимавших гормональную терапию, в 49% случаев не было выявлено лактобацилл. А среди тех, у которых они обнаруживались, концентрация последних была в 10–100 раз меньше, чем у женщин в пременопаузе [15]. В постменопаузе наиболее распространенными микроорганизмами являлись анаэробные грамотрицательные палочки и грамположительные кокки.
Несмотря на вышесказанное, у некоторых женщин симптомы атрофии прогрессируют вскоре после наступления менопаузы, а у других они не возникают даже в более поздние годы. Среди факторов, которые могут увеличить риск развития урогенитальной атрофии, курение является одним из наиболее изученных. Курение оказывает прямое воздействие на плоскоклеточный эпителий влагалища, снижает биодоступность эстрогена и уменьшает перфузию крови. Другими гормональными факторами, которые, как правило, имеют значение, являются уровни различных андрогенов, таких как тестостерон и андростендион. Предполагают, что после менопаузы у женщин с более высоким уровнем андрогенов, которые поддерживают сексуальную активность, отмечено меньше изменений, связанных с атрофией [12]. Кроме того, ВА наблюдается чаще у женщин, которые никогда не рожали через естественные половые пути [16].
Принимая во внимание патогенез заболевания, терапия эстрогенами является золотым стандартом лечения. Все клинические рекомендации по лечению УГА сходятся во мнении, что наиболее распространенным и эффективным методом лечения является системная или локальная гормональная терапия эстрогенами в различных формах, так как она достаточно быстро улучшает индекс созревания и толщину слизистой оболочки влагалища, снижает рН влагалища и устраняет симптомы ВА [3, 11–13]. Для лечения УГА, сочетающейся с симптомами климактерия, используют системную гормональную терапию. В остальных случаях отдают предпочтение местному лечению, которое позволяет избежать большинства системных побочных эффектов [12, 13]. Исследования показали, что системная заместительная гормональная терапия устраняет симптомы ВА в 75% случаев, в то время как локальная терапия — в 80–90%.
Эстрогенсодержащие препараты для локального применения, представленные в форме крема, таблеток, пессариев/суппозиториев, вагинального кольца, могут содержать эстриол, конъюгированные эквинэстрогены, эстрадиол или эстрон. Из трех природных эстрогенов человеческого организма эстриол имеет самый короткий период полувыведения и наименьшую биологическую активность. В России имеется многолетний опыт локального применения эстриолсодержащих препаратов, обладающих выраженным кольпотропным эффектом. Учитывая слабое пролиферативное действие на эндометрий при использовании эстриола, дополнительное введение прогестагена не требуется. Многочисленные исследования показали, что ежедневное применение эстриола в дозе 0,5 мг оказывает заметный пролиферативный эффект на эпителий влагалища. Локальное применение эстриолсодержащих препаратов является безопасным и эффективным подходом к предотвращению и лечению ВА, не имеющим ограничений по возрастному аспекту и длительности лечения. В настоящее время в европейских странах отмечается тенденция к локальному использованию низких доз для эстрогенов эстриола и эстрадиола.
В 2006 г. в Кокрановском систематическом обзоре были проанализированы 19 клинических испытаний, в которых приняли участие 4162 женщины в постменопаузе, распределенные по группам, в зависимости от принимаемого вагинально препарата с эстрогенами, а конечной точкой в исследовании была оценка эффективности, безопасности и приемлемости терапии. Четырнадцать исследований сравнивали безопасность различных препаратов, семь акцентировали внимание на побочных эффектах и четыре на безопасности лечения и воздействии на эндометрий. Семь исследований включали плацебо-группы, и во всех показано улучшение состояния пациентов, принимающих гормональную терапию (табл.).
Результаты анализа показывают, что вагинальные таблетки с эстрадиолом более эффективны по сравнению с вагинальным кольцом и что оба варианта лечения превосходят плацебо в устранении диспареунии, сухости и зуда во влагалище. Вагинальный крем с конъюгированными лошадиными эстрогенами (КЛЭ) превосходит увлажняющие кремы в устранении сухости, повышении эластичности и объема кровотока во влагалище. Однако не было обнаружено никаких различий между тремя проанализированными препаратами терапии (крем с КЛЭ, таблетки с эстрадиолом и эстрадиол-рилизинг-кольцо) по отношению к количеству парабазальных клеток, кариопикнотическому индексу, индексу созревания и вагинальному индексу здоровья. К тому же также сообщаются данные об отсутствии значительных различий в толщине эндометрия, гиперплазии и количестве побочных эффектов между вагинальным кольцом, кремом или таблетками. Тем не менее, незначительный риск вагинальных кровотечений был описан во всех исследованиях, в которых применялись различные методы местной терапии эстрогенами, а также возможное увеличение риска развития кандидоза [16].
В результате метаанализа, проведенного Cardozo и соавт., показано, что вагинальный путь введения эстрогенов является эффективным методом лечения ВА. Комбинация местной и системной терапии позволяет достичь результатов в более сжатые сроки. Кроме того, низкие дозы местных эстрогенов: эстрадиола или эстриола так же эффективны, как и при системном введении. Было показано, что трансдермальный пластырь с ежедневной дозой в 14 мкг эстрадиола обладает аналогичным воздействием на рН влагалища и на индекс созревания, как и вагинальное кольцо с 7,5 мкг эстрадиола [17].
Положительный терапевтический эффект местной гормональной терапии был также отмечен в ситуациях, выходящих за рамки лечения ВА, а именно таких, как снижение риска рецидивирующих инфекций мочевыводящих путей и развития гиперактивного мочевого пузыря. С учетом вышеизложенного, эстрадиол-рилизинг-кольцо было одобрено в качестве лечения дизурии и ургентного недержания мочи. В то время как системная гормональная терапия, наоборот, увеличивает процент возникновения стрессового недержания мочи и почечных камней [10].
Таким образом, местная терапия имеет ряд преимуществ по сравнения с системным введением препаратов. Она позволяет избежать первичный метаболизм в печени, минимально воздействует на эндометрий, имеет низкую гормональную нагрузку, минимальные побочные эффекты, не требует добавления прогестагенов, оказывает в основном локальный эффект.
С практической точки зрения и в связи с аналогичной эффективностью и безопасностью всех местных препаратов с эстрогенами, пациентка должна иметь возможность выбрать препарат, который она считает наиболее подходящим для нее. Она должна быть проинформирована о том, что эффект достигается после одного-трех месяцев лечения. Дополнительное назначение прогестагенов не является обязательным при использовании локальных форм эстрогенов [18]. В обзоре за 2009 г., посвященном местной гормональной терапии, говорится, что ни в одном исследовании не наблюдали пролиферацию эндометрия после 6–24 месяцев использования эстрогенов, так что литература, таким образом, дает уверенность относительно безопасности малых доз вагинальных препаратов с эстрогенами и не поддерживает одновременное применение системных прогестагенов для защиты эндометрия [13].
Помимо перечисленных выше методов лечения ВА на сегодняшний момент существуют такие, как терапия с использованием дегидроэпиандростерона, селективных тканевых эстрогеновых комплексов, селективных модуляторов эстрогеновых рецепторов и негормональные методы лечения, а также комбинированные препараты, содержащие ультранизкодозированный эстриол и лактобактерии.
В работе U. Jaisamrarn и соавт. впервые оценивалась эффективность и переносимость ультранизких доз эстриола (0,03 мг) в сочетании с жизнеспособными Lactobacillus acidophilus в краткосрочной и долгосрочной перспективе лечения симптомов ВА. Было выявлено, что комбинация эстриола и лактобактерий в течение 12 недель была достаточна для достижения статистически и клинически значимых результатов, включающих улучшение объективных параметров (ВИС, рН, доля латобактерий в микрофлоре влагалища), а также качество жизни женщин [19].
Большое количество публикаций посвящается использованию интравагинального геля дегидроэпиандростерона (DHEA) для лечения ВА [8]. DHEA является предшественником половых гормонов, который в дополнение к тестостерону и эстрогенам производится надпочечниками и яичниками. В дальнейшем он подвергается биотрансформации в периферических тканях: в головном мозге, костях, молочных железах и яичниках. На сегодняшний день специфические рецепторы DHEA не найдены, в связи с чем существует предположение, что его действие происходит путем конвертации в андрогены и/или эстрогены и взаимодействия с их рецепторами соответственно. На сегодняшний день большая часть данных благотворного влияния DHEA, введенного вагинально, приведенных в пяти публикациях, взяты из одного рандомизированного исследования, проведенного Labrie и его коллегами. DHEA использовали вагинально 218 женщин в постменопаузе в течение 12 недель. Женщины были распределены по группам: плацебо, принимающие 0,25% (3,25 мг), 0,5% (6,5 мг) или 1,0% (13 мг) вагинальный крем ежедневно. У пациенток, получавших терапию DHEA, вагинальная атрофия исчезла, в то время как наблюдались минимальные изменения уровней стероидных гормонов в сыворотке крови, которые оставались в пределах нормального диапазона, характерного для постменопаузы. Также в данном исследовании было отмечено положительное влияние на четыре аспекта сексуальной функции: желание/интерес, возбуждение, оргазм и диспареуния. Крем с 0,5%-м (6,5 мг) DHEA оказался оптимальным для лечения вагинальной атрофии и существенно не повлиял на сывороточный уровень эстрогенов [20].
Среди селективных модуляторов эстрогеновых рецепторов (SERM) оспемифен является наиболее современным лекарственным средством. В 12-недельном трехфазном рандомизированном исследовании с участием 826 женщин в постменопаузе изучали эффективность данного препарата в дозе 30 мг, 60 мг по сравнению с плацебо. К 4-й и 12-й неделям оспемифен в указанных ранее дозах показал статистически значимое увеличение количества поверхностных клеток, снижение парабазальных клеток и рН во влагалище по сравнению с плацебо. Сухость влагалища значительно снизилась как в группах с 30 мг и 60 мг по сравнению с плацебо к 12-й неделе, в то время как диспареуния уменьшилась только в группе, получавшей препарат в дозе 60 мг. В ходе исследования было выявлено, что побочный эффект препарата, проявляющийся в виде приливов, наблюдался у 9,6%, 8,3% и 3,4% участников в группах, получавших оспемифен в дозе 30 мг, 60 мг и плацебо соответственно. Толщина эндометрия от исходного уровня к 12-й неделе в среднем изменилась на 0,42 мм, 0,72 мм и 0,02 мм у участниц выше представленных групп соответственно [21].
Комбинация конъюгированных эстрогенов и базедоксифена — селективного модулятора эстрогеновых рецепторов, известная как тканевой селективный эстрогенный комплекс (TSEC), изучалась в исследовании 3-й фазы, где 601 женщина была распределена по группам в зависимости от ежедневной получаемой терапии: 20 мг базедоксифена плюс конъюгированные эстрогены 0,45 мг (BZA/CE), или базедоксифен 20 мг плюс 0,625 мг конъюгированные эстрогены, или 20 мг базедоксифена и плацебо. В ходе исследования было выявлено увеличение доли поверхностных клеток и уменьшение доли парабазальных от исходного уровня к 12-й неделе в большей степени в группе BZA/CE по сравнению с плацебо и только BZA. РН влагалища существенно не изменился по сравнению с исходным к окончанию исследования в группе BZA или плацебо, но значительно уменьшились в обеих группах BZA/CE. Тем не менее, снижение рН влагалища было значимо ниже в группе BZA/CE 20 мг/0,625 мг, чем в плацебо-группе. Самые «назойливые» симптомы значительно уменьшились к 12-й неделе по сравнению с плацебо в группе BZA/СЕ 20 мг/0,625 мг, но не в группе BZA/СЕ 20 мг/0,45 мг. Не отмечено каких-либо существенных различий в побочных эффектах или случаях прекращения участия в исследовании между группами. Однако была отмечена более высокая заболеваемость вагинитами в группах лечения (BZA/CE) по сравнению с плацебо [22]. Таким образом TSEC, а именно базедоксифен в сочетании с конъюгированными эстрогенами представляет собой альтернативу терапии прогестинами для защиты эндометрия от стимуляции эстрогенами, при сохранении благоприятного воздействия эстрогенов на симптомы, связанные с менопаузой.
Несмотря на перечисленные методы лечения ВА, не стоит забывать о профилактике заболевания. Сохранение регулярной половой жизни рекомендуется, в общем, всем женщинам и, в частности, женщинам в менопаузе. Это связано с тем, что половой акт улучшает циркуляцию крови во влагалище, и семенная жидкость также содержит половые стероиды, простагландины и незаменимые жирные кислоты, которые способствуют сохранению вагинальной ткани [12].
Хотя официальная распространенность атрофии влагалища меняется в зависимости от численности и индивидуальных особенностей изучаемого населения, все большее число женщин страдают от этого состояния по мере старения населения. Одно из исследований, проведенное зарубежными коллегами, показало, что более 60% женщин испытывают симптомы ВА спустя 4 года после наступления постменопаузы. При этом всего лишь 4% женщин в возрасте 55–65 лет связывают вышеуказанные жалобы с атрофией влагалища, 37% знают, что это симптомы обратимы, и 75% женщин считают, что симптомы ВА негативно влияют на их жизнь. Учитывая деликатный характер этих симптомов, пациентки не решаются обратиться за медицинской помощью и, следовательно, страдают от прогрессирующих симптомов [10, 23]. Лишь 25% женщин с симптомами вагинальной атрофии обращаются за медицинской помощью. ВА является хроническим и прогрессирующим состоянием [10]. Значительное число женщин с симптомами ВА даже не представляют, что существует возможность эффективного лечения. Своевременное информирование пациентов о причинах возникновения вышеуказанных симптомов и возможностях их устранения может позволить в короткие сроки улучшить состояние женщин, возвратить им интерес к жизни и ее качество. Таким образом, проблема сохранения здоровья и профилактики заболеваний, обусловленных старением, приобрела в последние годы особое значение. В связи с ее актуальностью в настоящее время проводится разработка и внедрение новых лекарственных препаратов для лечения ВА, что позволит индивидуализировать подход к лечению пациентов.
Литература
- Вихляева Е. М. Руководство по гинекологической эндокринологии. М.: Медицинское информационное агентство, 1997. С. 227–360.
- Урогенитальные расстройства в климактерии (клиника, диагностика, заместительная гормонотерапия). Дис. д-ра мед. наук. М., 1998.
- Santiago Palacios. Managing urogenital atrophy // Maturitas. 2009; 63: 315–318.
- Sinha A., Ewies A. A. A. Non-hormonal topical treatment of vulvovaginal atrophy: an up-to-date overview // Climacteric. 2013; 16: 305–312.
- Griebling T. L., Liao Z., Smith P. G. Systemic and topical hormone therapies reduce vaginal innervation density in postmenopausal women // Menopause. 2012; 19: 630–635.
- Frank S. M., Ziegler C., Kokot-Kierepa M., Maamari R., Nappi R. E. Vaginal Health: Insights, Views & Attitudes (VIVA) survey — Canadian cohort // Menopause Int. 2012.
- Rosano G. M. C., Vitale C., Silvestri A., Fini M. Metabolic and vascular effect of progestins in postmenopause // Maturitas. 2003; 46: 17–29.
- Hextall E. Esrogens in the funtion uretral tract // Maturitas. 2000; 36: 83–92.
- Манухин И. Б., Тумилович Л. Г., Геворкян М. А. Клинические лекции по гинекологической эндокринологии. М., 2003.
- Management of symptomatic vulvovaginal atrophy: 2013 position statement of The North American Menopause Society // The North American Menopause Society. 2013; 20 (9): 888–902.
- James H. Pickar. Emerging therapies for postmenopausal vaginal atrophy // Maturitas. 2013; 75: 3–6.
- Camil Castelo-Branco, Maria Jes´us Cancelo, Jose Villero, Francisco Nohales, Maria Dolores Juli´a. Management of post-menopausal vaginal atrophy and atrophic vaginitis // Maturitas. 2005; 52: 46–52.
- Sturdee D. W., Panay N. Recommendations for the management of postmenopausal vaginal atrophy // Climacteric. 2010; 13: 509–522.
- Basaran M., Kosif R., Bayar U., Civelek B. Characteristics of external genitalia in pre-and postmenopausal women // Climacteric. 2008; 11: 416–421.
- Paul Nyirjesy. Postmenopausal Vaginitis. Current Infectious Disease Reports. 2007; 9: 480–484.
- Suckling J., Lethaby A., Kennedy R. Local oestrogen for vaginal atrophy in postmenopausal women // Cochrane Database Syst Rev. 2006.
- Gupta P., Ozel B., Stanczyk F. Z., Felix J. C., Mishell Jr. D. R. The effect of transdermal and vaginal estrogen therapy on markers of postmenopausal estrogen status // Menopause. 2008; 15 (1)): 94–97.
- Pitkin J., Rees M. British Menopause Society Council. Urogenital atrophy // Menopause Int. 2008; 136–137.
- Jaisamrarn U., Triratanachat S., Chaikittisilpa S., Grob P., Prasauskas V., Taechakraichana N.. Ultra-low-dose estriol and lactobacilli in the local treatment of postmenopausal vaginal atrophy // Climacteric. 2013; 16: 347–355.
- Labrie F., Archer D. F., Bouchard C. et al. Intravaginal dehydroepiandrosterone (prasterone), a highly efficient treatment of dyspareunia // Climacteric. 2011; 14: 282–288.
- Bachmann G. A., Komi J. O. The Ospemifene Study Group. Ospemifene effectively treats vulvovaginal atrophy in postmenopausal women: results from a pivotal phase 3 study // Menopause. 2010; 17 (3): 480–486.
- Kagan R., Williams R. S., Pan K., Mirkin S., Pickar J. H. A randomized, placebo-and active-controlled trial of bazedoxifene/conjugated estrogens for treat-ment of moderate to severe vulvar/vaginal atrophy in postmenopausal women // Menopause. 2010; 17 (2): 281–289.
- Kingsberg S. A., Krychman M. L. Resistance and barriers to local estrogen therapy in women with atrophic vaginitis // J Sex Med. 2013; 1567–1574.
А. В. Глазунова С. В. Юренева1, доктор медицинских наук, профессор
ФГБУ НЦ АГиП им. В. И. Кулакова МЗ РФ, Москва
1 Контактная информация
Abstract. According to forecasts to 2030 there will be 1,2 bln women in postmenopause. The state of oestrogen deficit in climacterical period cause vaginal atrophy with 15–57% of women. The latest data on the problem of pathogenesis, clinical manifestations and therapy of this state are provided in review.
Атрофия костной ткани челюсти с возрастом
Одним из факторов, влияющих на дефект, является возрастное изменение. Как правило, у пациентов после 60 лет атрофия — нередкий процесс. Объясняется это тем, что недостаток минералов, питания клеток сказывается на обмене веществ и зубы выпадают. Кровоснабжение костной ткани нарушается, не поступает нужное количество кислорода. Это приводит к изменению давления на кость.
Симптомы атрофии
Пациента беспокоит снижение остроты зрения, которое не поддается оптической коррекции.
При этом зрительные нарушения могут проявляться в виде отдельных «пятен» перед глазами или ощущения сужения полей вплоть до «трубчатого зрения». Также возможно нарушение цветоощущения.
Динамика симптомов может быть различной. Иногда атрофия неуклонно прогрессирует при отсутствии лечения, вплоть до развития слепоты. Также атрофический процесс может приостанавливаться. В этом случае снижение зрения может быть значительным, однако полная слепота не развивается.
Атрофия костной ткани челюсти после удаления зубов
Наиболее частой причиной появления заболевания является потеря зуба или зубного ряда. Через несколько месяцев после экстракции при несвоевременном протезировании начинается процесс уменьшения челюстной кости за счет давления на альвеолярный отросток. Уже через год деформация может достигнуть своего максимума.
Последствия дефицита костной ткани выражаются в ухудшении речи, изменении пропорций лица и его формы, появлении сильных морщин в области рта. При запущенной степени у пациентов фиксируется смещение зубного ряда, выпадение противоположных и/или соседних зубов. Из-за этого повышается вероятность невозможности имплантации.
Методы лечения
После подтверждения диагноза атрофию сетчатки лечат по индивидуальной схеме. Она зависит от выявленных особенностей заболевания, имеющихся хронических недугов и общего состояния организма. При легкой степени, когда интенсивность ишемического процесса минимальна, а необратимые изменения не наступили, назначают поддерживающую терапию. Она состоит из медикаментов для перорального приема:
- витаминных комплексов, обогащенных антиоксидантами и ретинолом;
- лекарственных средств для укрепления стенок сосудов;
- средств, уменьшающих ишемические процессы и восстанавливающих кровообращение в области головы.
Дополняет консервативное лечение диета, направленная на восстановление текучести крови, уменьшение риска тромбоза, укрепление сосудистых стенок. Пациентам рекомендуется обогатить рацион продуктами, богатыми полезными для глаз веществами:
- бета-каротинами
— желтыми и оранжевыми овощами и фруктами (морковь, тыква, желтые томаты, цитрусовые, абрикосы и персики, хурма); - лютеином
— все виды капусты, куриные и перепелиные яйца, авокадо и почти все цитрусовые; - ниацином
— филе курицы и индейки, любая печень, тунец и лосось, нежирные сорта свинины и говядина, арахис и бурый рис; - омега-3 кислотами
— все жирные сорта рыбы; - витаминами С и Е
— миндаль, болгарский перец и смородина, цитрусовые и зелень.
Для поддержания тонуса сосудов важно включить в меню больше круп и злаков. Они должны составлять не меньше 1/3 рациона. Твердые животные жиры, включая сливочное масло и жирные сливки, лучше заменить растительными маслами — оливковым, кунжутным, подсолнечным.
Важно! Грамотно составленная и тщательно соблюдаемая диета способна приостановить атрофические процессы в сетчатке и частично восстановить ее функции.
Влажная атрофия сетчатки глаза имеет более агрессивную форму, поэтому требует радикальных способов лечения. Помимо упомянутых ранее поддерживающих препаратов для ее устранения используют инвазивные методы:
- внутриглазные инъекции лекарств
, способствующих восстановлению микроциркуляции, выведению из прилежащих к ретине областей лишней жидкости, устраняющих отечность сетчатки; - инъекционное склерозирование сосудов
, образовавшихся в очаге атрофии, с помощью препарата Visudyne и лазерной стимуляции; - лазерная коагуляция сетчатки
, направленная на предотвращение ее отслоения, устранение рубцовых тканей и уничтожение аномальных сосудов.
Если болезнь приобретает агрессивный характер, проводят полноценную хирургическую операцию, направленную на восстановление обменных процессов в сетчатке и нормализации кровоснабжения. С этой целью делают:
- витрэктомию — удаляют стекловидное тело и заменяют его гелеобразным полимером, который плотно прижимает сетчатку к сосудистой подложке и препятствует ее отслоению;
- вазореконструкция — восстановление кровоснабжения с помощью микрохирургического восстановления проходимости глазных сосудов;
- реваскуляризация — хирургическое удаление вновь образующихся сосудов.
После вмешательства требуется длительная реабилитация и пожизненный прием препаратов, направленных на сдерживание процесса ангиогенеза, то есть неконтролируемого разрастания сосудов.
3.Симптоматика, диагностика
Осевыми, главными в клинике мультисистемной атрофии принято считать следующие группы симптомов. Постепенно утрачивается способность к координированным сложным движениям и, как при болезни Паркинсона, появляются непроизвольные движения (тремор) на фоне повышенного мышечного тонуса. Нарушается походка, моторика становится все более беспорядочной (атаксия). Кроме того, страдают т.н. вегетативные функции, контролируемые периферической нервной системой: возникают и усугубляются те или иные проблемы с мочеиспусканием и дефекацией, водным и температурным балансом кожи, дыханием (особенно во время сна), артериальным давлением (что при принятии вертикального положения может проявляться головокружениями и кратковременными потерями сознания с падением); нарушаются и деградируют речевые и сексуальные функции, затрудняется фиксация взора и снижается острота зрения; уменьшается продуктивность слезных, слюнных и потовых желез. Прогрессирует деменция. В большинстве случаев через несколько лет пациента приходится инвалидизировать. Процесс результирует летальным исходом; в терминальной стадии больные, как правило, пребывают в сугубо вегетативном статусе.
Учитывая полиморфизм возможной симптоматики, мультисистемную атрофию необходимо дифференцировать, прежде всего, с «чистой» болезнью Паркинсона и другими видами нейродегенерации. В дополнение к стандартному неврологическому осмотру и изучению анамнеза, в диагностических целях (поиск и локализация участков дегенерации) могут назначаться томографические методы визуализации (КТ, МРТ). Более специфические, «прицельные» в отношении мультисистемной атрофии диагностические методики, будь то аппаратные или лабораторно-аналитические методы, на сегодняшний день не разработаны.
О нашей клинике м. Чистые пруды Страница Мединтерком!
2.Причины
Нам выпало жить в эпоху, когда стремительное развитие медицинской науки неуклонно сокращает число как неизлечимых болезней, так и болезней непонятных, этиологически неясных. Мультисистемная атрофия относится и к тем, и к другим.
Несмотря на исследовательские усилия, – которые существенно затрудняются редкостью заболевания и многообразием возможных вариантов клинической картины, – этиопатогенетические факторы и механизмы мультисистемной нейронной атрофии пока не известны. Кроме того, не удается выявить статистическую значимость каких бы то ни было условий или индивидуальных особенностей, которые можно было бы назвать факторами риска и, соответственно, профилактическими мишенями. Результаты попыток дешифровать мультисистемную атрофию на хромосомном уровне до последнего времени носят гипотетический, предположительный характер. Достоверно подтверждено преобладание мужчин среди заболевших (по разным оценкам, в 1,5-2 раза), но и эта тенденция пока не получила удовлетворительного объяснения.
Посетите нашу страницу Неврология