01.11.2017
Интересное
Богачева Шарофат Баировна
Мозг — это «мистический» орган, способный наполнить нас невероятными ощущениями, показать собственное «кино», мечту, накапливать опыт и мудрость, позволяющий думать. Это орган, контролирующий и регулирующий работу всего организма в целом и каждого органа и системы в отдельности; обеспечивающий необходимые нашему организму баланс, защиту, компенсаторные реакции на нарушения. Этот небольшой по величине орган, весящий около 1400–1500 г (2 % от массы тела), имеет невероятные способности, которые еще полностью не изучены.
В чем нуждается мозг? Работая без отдыха и днем и ночью, он остро нуждается в кислороде (мозг потребляет 20 % от всего кислорода, поступающего в организм) и питательных веществах, без которых он не может обходиться даже несколько минут. Известен факт, что в мозге не создаются запасы кислорода, и нет каких-либо веществ, способных питать его в анаэробных (в отсутствии кислорода) условиях. То есть, нервные клетки головного мозга постоянно нуждаются в кислороде, глюкозе и «уборке» (очищении от продуктов жизнедеятельности клеток).
Этиология преходящих нарушений мозгового кровообращения
Преходящее нарушение мозгового кровотока (ПНМК) – это остро возникающее нарушение кровообращения головного мозга, которое сопровождается появлением очаговой, общемозговой или смешанной симптоматикой.
ПНМК встречается у 30% населения.
Основными причинными факторами в развитии ПНМК становятся: гипертоническая болезнь, симптоматическая гипертензия, атеросклероз, васкулиты при аутоиммунных поражениях соединительной ткани, пороки сердца, острые нарушения сердечной деятельности (инфаркт миокарда, острый коронарный синдром, стенокардия напряжения), остеохондроз шейного отдела позвоночника, синдром позвоночной артерии.
Выделяют следующие формы ПНМК: транзиторные ишемические атаки (ТИА) и гипертонические кризы. ПНМК по типу ТИА является кратковременным нарушением кровотока и не сопровождается выраженными деструктивными изменениями мозговой ткани, но иногда ТИА может, приводит к формированию кист малого диаметра.
Обычно ПНМК по типу ТИА обратимы и обусловлено это большими компенсаторными возможностями головного мозга, но имеет склонность к образованию «немых» зон.
ПНМК по типу ТИА может включать и диффузные атрофические изменения ткани головного мозга, что может служить пусковым механизмом в развитии ишемического инсульта.
Одной из причин ПНМК может быть и врожденные сосудистые аномалии, например коарктация аорты, гипо – или аплазия артерий, патологическая извитость сосудистых сплетений.
Выраженный спазм мышц шеи, патологическая компрессия извне растущей опухолью, увеличенными лимфоузлами может сыграть важную роль в формировании ПНМК.
Современные представления о хронической недостаточности мозгового кровообращения
В свою очередь, показатель распространенности деменции составляет 5–10% среди лиц старше 60 лет [3]. Исходя из приведенных данных, можно сделать вывод, что 0,5–2,5% пожилых людей страдают сосудистой деменцией. Число лиц с сосудистыми когнитивными расстройствами, не достигающими выраженности деменции, предположительно, в 2–3 раза больше, чем число страдающих сосудистой деменцией [3, 4]. Таким образом, распространенность ХНМК может достигать до 10% лиц старше 60 лет.
В отечественной неврологической практике используется несколько синонимичных диагностических формулировок для обозначения ХНМК:
- дисциркуляторная энцефалопатия (ДЭП);
- хроническая ишемия головного мозга;
- гипертоническая энцефалопатия;
- хроническая сосудистая мозговая недостаточность;
- хроническая цереброваскулярная недостаточность;
- хроническая цереброваскулярная болезнь;
- ишемическая болезнь мозга.
Все приведенные выше диагностические формулировки можно рассматривать как синонимы, которые обозначают клинический синдром, развивающийся при хроническом прогрессирующем неинсультном поражении головного мозга. Столь значительное разнообразие диагноcтических формулировок отражает историю изучения ХНМК, эволюцию взглядов на эту проблему и отсутствие на сегодняшний день единого взгляда на патогенетические механизмы и клинику ХНМК.
Термин «дисциркуляторная энцефалопатия» был предложен в 1958 г. выдающимися отечественными неврологами профессорами Г.Э. Максудовым и В.М. Коганом [5]. Под этим термином было предложено понимать хроническое прогрессирующее диффузное поражение головного мозга в результате хронической ишемии и гипоксии, которое проявляется прогрессирующими когнитивными и другими неврологическими расстройствами. В 1985 г. данный термин был включен в отечественную классификацию сосудистых заболеваний головного мозга, принятую на пленуме Всесоюзного общества неврологов (рис. 1) [6].
Развитие методов нейровизуализации в конце ХХ – начале ХХI в. заставило подвергнуть определенной ревизии представление о патогенетических механизмах развития клинического синдрома ДЭП. Было показано, что наряду с хронической ишемией и гипоксией, которая приводит к развитию диффузных изменений белого вещества (лейкоареоз (ЛА)), существенный вклад в развитие ДЭП также вносят повторные острые нарушения мозгового кровообращения без клиники инсульта – так называемые «немые» инфаркты. Они развиваются бессимптомно или с минимальной, стертой или атипичной симптоматикой, которая не позволяет распознать инсульт. Однако в последующем накопление объема повреждения мозга в результате повторных «немых» инфарктов способствует дальнейшему прогрессированию ДЭП [7, 8].
В связи с новыми представлениями о механизмах формирования ДЭП в 2001 г. академиком РАН, профессором Н.Н. Яхно была предложена новая редакция дефиниции ДЭП: «дисциркуляторная энцефалопатия – это синдром различной этиологии, проявляющийся прогрессирующими неврологическими, нейропсихологическими и психическими расстройствами, который развивается в результате повторных острых нарушений мозгового кровообращения и/или хронической недостаточности мозгового кровообращения» [9]. Приведенное определение наглядно демонстрирует предпочтительность термина «дисциркуляторная энцефалопатия (допускаются различные патогенетические механизмы сосудистого поражения головного мозга), перед термином «хроническая ишемия мозга» (имеется в виду наличие одного механизма поражения головного мозга).
Этиология и патогенез ДЭП
ДЭП – не самостоятельное заболевание, а осложнение разнообразных сердечно-сосудистых заболеваний. Список причин ХНМК повторяет список причин инсультов (табл. 1). На практике чаще всего ХНМК развивается в результате длительно существующей неконтролируемой артериальной гипертензии, атеросклероза церебральных артерий и фибрилляции предсердий с повторяющейся микротромбоэмболией в головной мозг.
Общность этиологических факторов обусловливает высокую коморбидность ДЭП и инсультов. Как правило, пациенты с ДЭП имеют инсульты в анамнезе, а пациенты, перенесшие инсульт, страдают также ДЭП. При наличии инсульта в анамнезе диагноз ДЭП правомерен в том случае, если инсульт не может объяснить всей имеющейся у пациента симптоматики и при исключении иного сопутствующего заболевания (например, нейродегенеративного).
Можно выделить 3 основных патогенетических механизма формирования хронического прогрессирующего неинсультного сосудистого поражения головного мозга при ДЭП [8–11]:
- повторные острые нарушения мозгового кровообращения без клиники инсульта («немые» инфаркты или «немые» кровоизлияния);
- ЛА;
- вторичная церебральная атрофия.
Как правило, «немые» инфаркты имеют небольшой объем, т. е. относятся к категории лакунарных инфарктов (менее 10–15 мм в диаметре). Единичный лакунарный инфаркт может оставаться бессимптомным. Однако при повторных лакунарных инфарктах (что часто наблюдается при отсутствии адекватного лечения артериальной гипертензии) накопление объема повреждения головного мозга приводит к формированию неврологической симптоматики. При этом данная симптоматика будет формироваться постепенно – как хроническое сосудистое поражение головного мозга [7, 8].
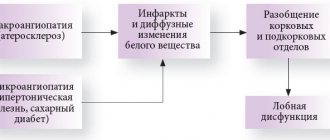
Характер неврологических симптомов при повторных лакунарных инфарктах определяется их локализацией. Вследствие анатомо-физиологических особенностей сосудистой системы головного мозга чаще всего лакунарные инфаркты обнаруживаются в подкорковых базальных ганглиях, внутренней капсуле, мосту и мозжечке [7, 8].
Поражение подкорковых базальных ганглиев (полосатые тела, таламус) в результате лакунарных инфарктов ведет к вторичной дисфункции лобных долей головного мозга. Это объясняется наличием тесной функциональной связи между лобной корой и подкорковыми образованиями. Поэтому нарушение взаимодействия между указанными областями приводит к вторичной дисфункции лобной коры. Клинический анализ неврологической и нейропсихологической симптоматики, которая наблюдается на начальных стадиях ХНМК, неоспоримо свидетельствует о ее связи с нарушением функционирования лобных долей головного мозга [8–11].
Под ЛА принято понимать весьма распространенные в пожилом возрасте изменения плотности и анатомического строения белого вещества головного мозга, которые часто ассоциированы с сосудистыми заболеваниями. При этом макроскопически определяется побледнение определенных участков белого вещества головного мозга, а микроскопически – демиелинизация, глиоз и расширение периваскулярных пространств (криблюры) [8, 10–13].
Патогенетические механизмы развития ЛА остаются не до конца изученными. Предполагается, что важную роль в этом играет эндотелиальная дисфункция, которая приводит к повышению проницаемости стенки сосудов микроциркуляторного русла. В результате нарушается гематоэнцефалический барьер, происходит пропотевание плазмы крови в паренхиму головного мозга, формируется хронический отек определенных отделов белого вещества (в первую очередь перивентрикулярных), который со временем может приводить к вторичным морфологическим изменениям. Считается также, что большое значение для возникновения ЛА имеют повторные эпизоды транзиторной локальной ишемии головного мозга без формирования инфаркта мозга (так называемые «незавершенные» инфаркты) [8, 10–13].
ЛА приводит к нарушению связи между различными корковыми, а также между корковыми и подкорковыми структурами (феномен разобщения). В результате разобщения в наибольшей степени страдают лобные доли головного мозга, что связано с их физиологической ролью. Дело в том, что функцией передних отделов мозга является управление познавательной деятельностью и поведением. При отсутствии связи с другими отделами мозга данная функция не может быть осуществлена [10, 11].
Церебральная атрофия – закономерный итог поражения белого вещества при хронической недостаточности кровоснабжения головного мозга. Она развивается по механизму так называемой «валеровской дегенерации»: разобщение лобных долей с остальными отделами мозга приводит к снижению активности нейронов передних отделов мозга. По общим физиологическим законам в функционально неактивных (а следовательно, «не нужных» мозгу нейронах) запускается процесс генетически запрограммированной гибели (апоптоза), который и приводит к церебральной корковой атрофии. При этом максимальная выраженность атрофического процесса наблюдается в передних отделах головного мозга. При нейровизуализации это проявляется непропорциональным расширением в данной области субарахноидальных пространств [14, 15].
Клиническая картина ДЭП
Клиническая картина ДЭП весьма вариабельна. Однако в подавляющем большинстве случаев в клинике доминируют неврологические, эмоциональные и когнитивные дисфункции лобных долей головного мозга, что отражает патогенетические основы и локализацию патологического процесса при ДЭП. Наиболее часто наблюдаются разнообразные сочетания когнитивных расстройств, депрессии и/или апатии и нарушений постуральной устойчивости, равновесия и походки [10, 11, 16, 17].
Традиционно выделяют 3 стадии ДЭП [9]:
I стадия. Характеризуется так называемыми субъективными неврологическими симптомами: головной болью, головокружением, шумом в ушах или голове, повышенной утомляемостью, нарушением сна, забывчивостью. Объективно выявляется «рассеянная» неврологическая симптоматика в виде повышения и/или асимметрии сухожильных рефлексов, легкой дискоординации, нистагма, интенционного тремора и др. Ранее предполагалась, что в основе клинических симптомов на данной стадии лежит нарушение функции нейронов в результате хронической ишемии и гипоксии без формирования структурного дефекта. Однако развитие методов нейровизуализации убедительно показало, что в реальности структурные изменения предшествуют нарушению функции: достаточно длительное время сосудистое поражение головного мозга может оставаться бессимптомным. В настоящее время распространено представление о том, что в основе субъективных неврологических симптомов I стадии ДЭП лежат эмоциональные нарушения, связанные с лобной дисфункцией: так называемая сосудистая депрессия или эмоциональная лабильность [17–20].
На II стадии ДЭП субъективные неврологические симптомы утрачивают свою актуальность, снижается критика и в то же время формируется более отчетливая объективная неврологическая симптоматика. Может развиваться 1 или несколько из следующих неврологических синдромов [9]:
- умеренные когнитивные нарушения (табл. 2);
- псевдобульбарный;
- нарушения походки и равновесия (лобная дисбазия);
- амиостатический;
- пирамидный.
На III стадии ДЭП отмечается сочетание нескольких из указанных выше неврологических синдромов, когнитивные нарушения достигают выраженности деменции, присоединяются тазовые расстройства [2, 9].
Диагностика и дифференциальная диагностика ДЭП
Для диагностики синдрома ДЭП необходимы наличие когнитивных нарушений и другой характерной неврологической симптоматики, базисного сосудистого заболевания и доказательства причинно-следственной связи между сосудистым заболеванием и поражением ЦНС (табл. 3).
Одним из существенных доказательств сосудистой природы поражения головного мозга являются характерные особенности когнитивного статуса. При ДЭП, по крайней мере на начальных ее стадиях, нарушения памяти отсутствуют или представлены в небольшой степени. На первый план в структуре когнитивных расстройств выходят нарушения управляющих лобных функций в виде снижения активности психической деятельности, нарушения планирования, когнитивной инертности и недостаточности контроля [16, 22, 23]. Для выявления указанных нарушений следует использовать специфические «лобные» нейропсихологические тесты. В частности, «лобные» тесты включены в Монреальскую шкалу когнитивных нарушений (Мока-тест). Международное научное сообщество в настоящее время рекомендует использовать их для скрининга недементных сосудистых когнитивных расстройств [24].
Непростой, но актуальной клинической задачей является дифференциальный диагноз между сосудистыми и первично-дегенеративными когнитивными расстройствами, поскольку ДЭП и нейродегенеративный процесс представляют собой самые распространенные причины когнитивных нарушений у пожилых людей. В основе дифференциального диагноза лежит анализ нейропсихологических особенностей и неврологической симптоматики. Как уже указывалось выше, при ДЭП преобладают нарушения «лобных» управляющих функций, в то время как при нейродегенеративном процессе – нарушения памяти. В неврологическом статусе при ДЭП выявляются псевдобульбарный, амиостатический синдромы, нарушения равновесия и ходьбы. При первичных дегенеративных когнитивных расстройствах очаговая неврологическая симптоматика отсутствует вплоть до стадии тяжелой деменции [2, 9, 17, 22, 23].
Для дифференциального диагноза ДЭП и нейродегенеративного процесса, а также выявления сочетанных форм используется модифицированная шкала Хачинского (табл. 4) [25].
Надежной верификацией диагноза ДЭП является нейровизуализация – компьютерная, рентгеновская или, предпочтительнее, магнитно-резонансная томография. Данный метод исследования позволяет визуализировать последствия перенесенных острых нарушений головного мозга и ЛА [10, 11]. Наличие этих изменений – неоспоримое доказательство сосудистого поражения головного мозга. Однако даже при наличии доказанного сосудистого церебрального поражения клиническая симптоматика может вызываться разными причинами. Так, не менее 15% деменций в пожилом возрасте относятся к так называемой «смешанной» деменции, когда цереброваскулярная недостаточность сочетается с болезнью Альцгеймера. Столь частое сочетание сосудистого и дегенеративного поражения головного мозга объясняется общими факторами риска и патогенетическими механизмами [26].
Лечение ДЭП
ДЭП не является самостоятельной нозологической формой. Это полиэтиологический синдром, который может осложнять течение различных сердечно-сосудистых заболеваний, например, артериальной гипертензии, церебрального атеросклероза и др. Лечение ДЭП в первую очередь должно быть направлено на основное заболевание. Только оптимальный контроль всех имеющихся факторов риска нарушений мозгового кровообращения позволяет приостановить или замедлить прогрессирование недостаточности мозгового кровообращения. Лечение базисного сосудистого заболевания составляет, таким образом, этиотропную терапию ДЭП. Обычно она повторяет мероприятия по вторичной профилактике инсульта и включает антигипертензивную, антитромбоцитарную, или антикоагулянтную, и гиполипидемическую терапию, методы сосудистой хирургии.
Патогенетическая терапия ДЭП должна быть направлена на оптимизацию мозгового кровотока и создание нейрометаболической защиты головного мозга от ишемии и гипоксии.
В повседневной практике чаще всего используются вазоактивные препараты, воздействующие на церебральную микроциркуляцию. К таким препаратам относятся:
- ингибиторы фосфодиэстеразы: пентоксифиллин (Вазонит®), винпоцетин, аминофиллин, стандартный экстракт листьев гинкго двулопастного и др. Фермент фосфодиэстераза участвует в метаболизме циклического аденозинмонофосфата. Увеличение его содержания в гладкомышечных клетках сосудистой стенки в результате снижения активности фосфодиэстеразы ведет к их расслаблению и увеличению просвета сосудов;
- блокаторы кальциевых каналов – циннаризин, нимодипин, дилтиазем также обладают вазодилатирующим эффектом, в основе которого лежит уменьшение содержания внутриклеточного кальция в гладкомышечных клетках сосудистой стенки;
- блокаторы α2-адренорецепторов: ницерголин, пирибедил, α-дигидроэргокриптин. Данные препараты устраняют сосудосуживающее действие медиаторов симпатической нервной системы – адреналина и норадреналина, а также (за счет действия на церебральные пресинаптические рецепторы) увеличивает активность норадренергической медиации в головном мозге.
Эффективным вазоактивным препаратом, который хорошо зарекомендовал себя в многолетней клинической практике, является пентоксифиллин (Вазонит®, , Австрия). Данный препарат представляет собой производное метилксантина, который обладает способностью эффективно ингибировать фосфодиэстеразы 4-го типа в гладкомышечных клетках сосудистой стенки и форменных элементах крови. Применение Вазонита приводит к расширению церебральных сосудов небольшого калибра. При этом, по экспериментальным данным, в наибольшей степени препарат воздействует на пораженные сосуды в ишемизированных отделах головного мозга. Поэтому назначение Вазонита не вызывает эффекта «обкрадывания». Помимо этого, ингибирование фосфодиэстеразы в форменных элементах крови уменьшает агрегационную активность тромбоцитов и эритроцитов, способствует увеличению деформируемости тромбоцитов и эритроцитов и снижению вязкости крови [27–30].
Лекарственная форма Вазонита – таблетки пролонгированного действия, что позволяет принимать их 2 р./сут – утром и вечером. При этом нет ночных перерывов в лечении, т. е. «перекрываются» полные сутки при 2-кратном приеме.
Пентоксифиллин может назначаться как внутрь, так и внутривенно с достаточно широким диапазоном доз. Тем не менее рекомендуется назначать пентоксифиллин в таблетках по 600 мг (пролонгированная форма) 2 р./сут с едой.
Эффект пентоксифиллина может наступать в промежутке от 2-й до 4-й нед., но лечение должно продолжаться как минимум 8 нед. [31].
Высокая эффективность пентоксифиллина была продемонстрирована как в многочисленных клинических исследованиях, так и в многолетней повседневной клинической практике. Так, в исследовании А.Н. Бойко и соавт. пентоксифиллин назначался 55 пациентам с последствиями нетяжелого инсульта. На фоне данной терапии было отмечено достоверное улучшение памяти, внимания и других когнитивных функций [27].
В 1980–1990-е гг. в европейских странах было проведено более 20 рандомизированных двойных слепых плацебо-контролируемых исследований. Их результаты убедительно показали, что использование пентоксифиллина у пациентов с сосудистой деменцией и менее тяжелыми когнитивными нарушениями сопровождается достоверным улучшением когнитивных функций, а также регрессом других неврологических расстройств. При этом терапия пентоксифиллином способствовала клинически значимому уменьшению выраженности когнитивных и других неврологических расстройств как при ХНМК, так и при деменции, развившейся в результате повторных острых нарушений мозгового кровообращения [28–30].
За длительное время практического применения пентоксифиллин показал высокий профиль безопасности и хорошую переносимость, в т. ч. у пациентов пожилого возраста. Препарат не оказывает негативного влияния на жизненно важные функции и крайне редко вызывает побочные эффекты [28–30].
В отечественной практике вазоактивные препараты принято назначать курсами по 2–3 мес. 1–2 р./год. Однако в последнее время обсуждается целесообразность и более длительной сосудистой терапии.
Широко применяется при ДЭП также нейрометаболическая терапия. Целями данного вида лечения являются создание нейрометаболической защиты головного мозга от ишемии и гипоксии, а также стимуляция репаративных процессов в головном мозге. К препаратам нейрометаболического действия относятся пирацетам, этилметилгидроксипиридина сукцинат, холина альфосцерат, цитиколин и др.
Метаболическая терапия проводится курсами 1–2 р./год. Патогенетически оправданным и целесообразным является сочетанное проведение вазоактивной и метаболической терапии.
В заключение следует подчеркнуть, что воздействие и на причину, и на основные симптомы ДЭП, несомненно, будет способствовать как замедлению прогрессирования ДЭП, так и регрессу уже имеющейся симптоматики и, в конечном итоге, повышению качества жизни пациентов и их родственников.
Патогенез преходящих нарушений мозгового кровообращения
При нарушении проходимости сосудов головного мозга или сосудов шеи, например при атеросклерозе, васкулите, тромбозе может происходить затруднение кровообращения тканей головного мозга.
Это приводит к ишемии мозговых тканей и активации метаболизма с выработкой недоокисленных продуктов, которые запускают разрушение фосфолипидов мембран клеток.
Результатом такого воздействия является гибель клеток мозга с развитием атрофических диффузных очагов, что приводит к нарушению функции нервной системы и проявляется разными симптомами.
Этиологические факторы
Причиной развития недостаточности, особенно часто встречающейся у пациентов пожилого и старческого возраста, является мелкоочаговое или диффузное повреждение ткани мозга. Оно развивается на фоне долго существующих проблем с церебральным кровообращением, так как при ишемии ЦНС недополучает кислород и глюкозу.
Наиболее частые причины хронической ишемии:
атеросклеротические изменения (в частности – холестериновые бляшки);- гипертоническая болезнь;
- ВСД (вегето-сосудистая дистония);
- хроническая сердечная недостаточность;
- аритмии (в т. ч. пароксизмальные);
- сахарный диабет;
- системные васкулиты;
- болезни крови (с повышением ее вязкости);
- поражения сосудов на фоне хронических инфекций (туберкулез, сифилис).
Одним из этиологических факторов считается аномалии развития дуги аорты и сосудов шеи и плечевого пояса. Они могут не давать о себе знать до развития атеросклероза и гипертонии. Определенное значение придается компрессии (сдавлению) сосудов костными структурами (при искривлениях позвоночника и остеохондрозе) или же опухолями.
Кровообращение может нарушаться и вследствие отложений специфического белково-полисахаридного комплекса – амилоида на сосудистых стенках. Амилоидоз ведет к дистрофическим изменениям в кровеносных сосудах.
У пожилых людей одним из факторов риска ХНМК нередко становится низкое артериальное давление. При нем не исключен артериосклероз, т. е. поражение мелких артерий мозга.
Клиника преходящих нарушений мозгового кровообращения
Преходящие нарушения мозгового кровообращения, симптомы которой можно разделить на очаговые, общемозговые или смешанные.
Очаговые симптомы: выпадение чувствительности, гипостезии или гиперстезии кожи лица, конечностей или туловища.
Нарушение двигательной активности с развитием парезов по центральному типу, которые захватывают мышцы кистей, стоп.
Гипотония мышц и снижение мышечной силы характерна для ПНМК по типу ТИА. Данные процессы могут приводить к развитию эпилептических припадков парциального характера.
Могут появляться патологические рефлексы.
Появляется нарушение зрения по типу оптико-пирамидного синдрома с развитием монокулярной слепоты на стороне окклюзии сосуда.
Общемозговые симптомы: тошнота, рвота, икота. Шум в ушах, головокружение, нарушение равновесия, горизонтального нистагма, нарушение положения головы, фотопсий, дефектов полей зрения эти симптомы могут указывать на нарушение мозгового кровообращения.
Может происходить нарушение бульбарного отдела мозга: дисфония, дисфагия, дизартрия.
Могут возникать резкие приступы мышечной гипотонии, обездвиженности при сохранном сознании.
Гипертонические кризы являются результатом резкого повышения артериального давления, и сопровождается вегетативными симптомами.
Диагноз преходящих нарушений мозгового кровообращения
Диагноз ставится на основании жалоб больного, анамнеза жизни и болезни, наличии сопутствующей патологии, клинического осмотра, лабораторных и функциональных методов исследования.
Диагноз ПНМК ставится при исключении стеноза интракраниальных артерий, для этого используют УЗДГ сосудов, МР – ангиографию, контрастная ангиография.
Исследуется коагулограмма, а так же проводится КТ и МРТ головного мозга.
Диагноз ПНМК должен исключать субарахноидальное кровоизлияние Диагноз ПНМК может быть выставлен как сопутствующая патология.
Лечение и профилактика преходящих нарушений мозгового кровообращения
Преходящее нарушение мозгового кровообращения, лечение которого начинают сразу же после постановки диагноза.
Лечение ПНМК может включать: медикаментозную терапию, назначение антиагрегантов и антикоагулянтов после изучения анализов крови, плазмоферез и обязательно физиотерапию.
Физиотерапия как метод лечения ПНМК применяется уже много лет и имеет высокую эффективность.
Профилактика сводится к отказу от курения, контроля уровня АД, коррекцию холестерина и липидов в крови, коррекция уровня глюкозы крови, регулярная физическая нагрузка.
Симптомы
Симптомы нарушения мозгового кровообращения зависят от степени повреждения клеток мозга и локализации участка мозга с нарушенным кровотоком. При острых нарушения мозгового кровообращениях (геморрагический или ишемический инсульт) развиваются двигательные расстройства, такие как гемиплегия или гемипарез.
При хронических нарушениях мозгового кровообращения(оно называется также дисциркуляторной энцефалопатией) симптоматика развивается постепенно и проявляется такими симптомами как нарушения памяти, головокружения, головные боли Вначале, у пациента не отмечаются нарушения интеллектуальных способностей. Но по мере хронического недостатка кислорода в тканях мозга, начинают прогрессировать нарушения памяти, возникают личностные нарушения, в значительной степени снижается интеллект. В дальнейшем у пациента развиваются тяжелые интеллектуально-мнестические и когнитивные нарушения и формируется деменция, могут также развиваться экстрапирамидные нарушения, мозжечковая атаксия.