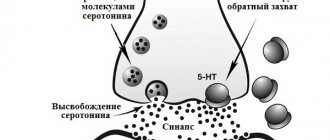
О терапии рассеянного склероза. Интерфероны
Интерфероны (ИФН) — это группа биологически активных белков (гликопротеидов), вырабатываемых различными клетками организма в ответ на вирусную инфекцию или на воздействие некоторых химических и биологических веществ. Связывание интерферонов с клеточными рецепторами приводит к значительному положительному эффекту.
Происходит выработка целого ряда внутриклеточных белков, которые:
- обладают противовирусным действием;
- стабилизируют иммунитет (иммуномодуляция);
- контролирует деление клеток (антипролиферативность);.
Различают альфа-, бета-, и гамма- интерфероны.
Наиболее эффективными в терапии РС признаны интерферон бета. При их применении снижается количество обострений и замедляется развитие заболевания.
Основное действие препаратов интерферон бета заключается в подавлении образования в организме человека веществ, повреждающих миелиновую оболочку нервной ткани. В то же время интерфероны способствуют активации других клеток, уменьшающих действие антител к миелину, тем самым снижая активность воспалительного процесса.
Кроме того, интерфероны бета, защищают слои миелина от дальнейшего разрушения, а также снижают вероятность повреждения гематоэнцефалического барьера (ГЭБ), препятствуя проникновению иммунных комплексов в клетки мозга.
Различают два типа бета-интерферонов:
- Интерферон бета-1b;
- Интерферон бета-1a.
К основным клиническим эффектам препаратов обеих групп можно отнести:
- снижение среднегодовой частоты обострений;
- замедление инвалидизации (увеличения показателя EDSS);
- улучшение качества жизни пациентов[xvii].
Обычно препараты интерферонов бета вводятся пациентом самостоятельно подкожно или внутримышечно, после назначения и рекомендаций врача. Инъекции препарата достаточно малотравматичны и не доставляют трудностей больному. Как правило, курсы терапии интерфероном длительные. Так как неоправданное прекращение лечения интерфероном бета ведет к возврату симптомов рассеянного склероза, его прекращение оправдано только в случае, если препарат недостаточно эффективен или в результате лечения развиваются серьезные побочные эффекты.
В связи с тем, что препараты интерферона участвуют в активации защитных сил организма, после введения могут развиваться реакции, напоминающие состояние «простуды» (гриппоподобный синдром), а также местные реакции в области инъекции в виде зуда, покраснения и отека.
Противопоказаний для лечения интерфероном бета немного:
- беременность;
- повышенная чувствительность к препарату;
- терапия противосудорожными препаратами.
В настоящее время терапия интерферонами бета применяется во всем мире для лечение рецидивирующей и вторично- прогрессирующей форм рассеянного склероза[xix].
Исследования показали, что длительный прием интерферона бета достаточно безопасен и эффективен. Применение препарата у взрослых с ремиттирующей и прогрессирующей формами течения рассеянного склероза снижало частоту обострений, тяжесть симптомов и удлиняло продолжительность ремиссий. Значительно уменьшалось и образование новых очагов, снижалась тяжесть заболевания.
Ключевые слова: рассеянный склероз, дети, Бетаферон.
Рассеянный склероз – хроническое прогрессирующее заболевание центральной нервной системы, которое, как правило, поражает людей молодого и среднего возраста. Клинически заболевание проявляется рассеянной неврологической симптоматикой с вовлечением нескольких функциональных систем в патологический процесс, что приводит к утрате работоспособности, способности к передвижению и самообслуживанию. По данным Всемирной Организации Здравоохранения, среди неврологических заболеваний рассеянный склероз (РС) является наиболее распространённой неврологической причиной стойкой нетрудоспособности молодых людей. В последние годы отмечается увеличение количества больных рассеянным склерозом во всем мире, что связано, во-первых, с улучшением диагностических возможностей и, прежде всего, с широким внедрением в медицинскую практику магнитно-резонансной томографии, во-вторых, с увеличением продолжительности жизни на фоне специфического лечения, в-третьих, с истинным ростом заболеваемости. На территории России, в среднем, рассеянный склероз встречается с частотой от 30 до 100 случаев на 100 000 населения. Примечательно, что ещё 20 лет назад в медицинских кругах рассеянный склероз рассматривался как исключительно взрослое заболевание. Однако в последние годы стало очевидным, что рассеянный склероз встречается и в детском возрасте. Эпидемиологические исследования, проведённые в России и за рубежом, показали, что у 5-10 % больных рассеянный склероз манифестирует в возрасте до 18 лет [1, 2]. Вопросы этиологии и этиотропного лечения этого заболевания остаются открытыми до настоящего времени. В последние годы всё большее признание получает мультифакториальная этиология рассеянного склероза, исходя из которой, основная роль в развитии заболевания отводится влиянию внешних факторов на генетически предрасположенных лиц. Предполагается, что сочетание внешних и генетических факторов может приводить к развитию воспалительных и иммунопатологических реакций, которые сопровождаются иммунологическими и биохимическими изменениями как в ЦНС, так и организме в целом. Исследования, проведённые в НИИ педиатрии НЦЗД РАМН (дир. академик РАМН А.А. Баранов) показали, что рассеянный склероз в детском возрасте имеет свои клинические особенности в виде преобладания симптомов поражения пирамидного тракта и ствола головного мозга, при относительно редко встречающихся сенсорных и тазовых нарушениях. При оптических невритах неблагоприятный прогноз обуславливается ранним развитием вторичной атрофии зрительных нервов. Одним из основных отличий рассеянного склероза с дебютом в детском возрасте, несмотря на высокую частоту обнаруженных «гигантских» очагов, является более медленное формирование необратимых дегенеративных изменений как по данным МРТ (локальная и диффузная атрофия вещества головного мозга), так и клинических (диссоциация между объёмом очагового поражения мозга и степенью выраженности неврологических нарушений). Наличие умеренных клинических проявлений при большом количестве очагов на МРТ указывает на большие возможности компенсации нарушенных функций в детском возрасте. Кривая распределения пациентов по возрасту дебюта рассеянного склероза в зависимости от пола показала преобладание мальчиков в возрастной группе от 3 до 5 лет, и отчётливое преобладание девочек в возрастной группе от 10 до 13 лет [3, 22]. Более чем у 97 % педиатрических пациентов рассеянный склероз дебютирует в форме ремиттирующего типа течения заболевания [3]. Долгосрочный прогноз прогрессирования заболевания у этой категории больных остаётся предметом дискуссий, однако ретроспективные исследования показали, что несмотря на более длительный средний период времени от дебюта рассеянного склероза до достижения стойкой неврологической инвалидности, в целом, по сравнению с взрослыми больными на момент формирования необратимого неврологического дефицита, больные с педиатрическим дебютом заболевания моложе, чем пациенты, заболевшие после 18 лет [3]. Поскольку рассеянный склероз по механизму развития и типам клинического течения является неоднородным заболеванием, терапия носит дифференцированный характер. В рамках существующей концепции патогенеза рассеянного склероза на сегодняшний день наиболее эффективным патогенетическим лечением является иммуномодулирующая терапия, появление которой в клинической практике врача – невролога изменило терапевтические подходы к патологии, ранее считавшейся некурабельной, и дало возможность реально снизить частоту обострений при ремиттирующем и вторично-прогрессирующем течении рассеянного склероза. Лекарственные средства, так называемые «препараты, изменяющие течение рассеянного склероза – ПИТРС», снижают частоту обострений рассеянного склероза в среднем на 30 % и в разной степени замедляют скорость прогрессирования необратимых нарушений, приводящих к инвалидизации. Они давно и широко применяются у взрослых больных рассеянным склерозом, особенно на этапе ремиттирующего течения заболевания. Безопасность и переносимость иммуномодулирующих препаратов хорошо изучены, однако все основные исследования, проведённые в этой области, включают пациентов с 18 лет. Одним из ведущих современных принципов иммуномодулирующего лечения РС является максимально раннее начало терапии пациентов с ремиттирующим типом течения заболевания [14]. Доказана целесообразность применения препаратов для иммуномодулирующего лечения рассеянного склероза даже до постановки достоверного диагноза у пациентов после первого демиелинизирующего эпизода или так называемого клинически изолированного синдрома, с высоким риском прогрессирования по данным МРТ [15]. К иммуномодулирующим препаратам относятся интерфероны бета. Их применение позволяет снизить частоту и тяжесть обострений рассеянного склероза на треть, на фоне лечения отмечено уменьшение количества воспалительных очагов в центральной нервной системе на 50-80 %, кроме того, применение интерферонов бета оказывает положительное влияние на когнитивные функции и качество жизни больных в целом. В настоящее время интерфероны рассматривают, как препараты выбора при лечении ремиттирующего рассеянного склероза, также начато их успешное применение при клинически изолированном синдроме. Интерфероны бета применяются и при вторично-прогрессирующем рассеянном склерозе, поскольку в данном случае они замедляют инвалидизацию и уменьшают образование новых очагов на МРТ. Основные побочные эффекты интерферонов: гриппоподобные симптомы (лихорадка, озноб, недомогание, боли в мышцах и утомляемость) в начале лечения развиваются примерно у половины всех пациентов, однако в дальнейшем они исчезают. Реже отмечаются местные реакции, умеренная тромбоцитопения и анемия, депрессивные эпизоды, повышение концентрации трансаминаз. В ряде случаев, применение интерферонов может сопровождаться образованием нейтрализующих антител. Лечение интерферонами проводят длительно, его прекращение оправдано только при явной неэффективности (обострения чаще 4 раз в год или прогрессирование инвалидизации на 1 балл по шкале EDSS за 6 месяцев) и при развитии побочных эффектов. Интерфероны бета обладают противовирусной и иммуномодулирующей активностью. Известно, что биологический эффект этих препаратов опосредуется их взаимодействием со специфическими рецепторами, которые обнаружены на поверхности клеток человека. Связывание интерферона бета с этими рецепторами индуцирует экспрессию ряда веществ, которые рассматриваются в качестве медиаторов биологических эффектов интерферонов бета. Интерфероны бета снижают связывающую способность и экспрессию рецепторов к гамма-интерферону, усиливают их деградацию. Кроме того, они обладают способностью повышать супрессорную активность мононуклеарных клеток периферической крови и, за счёт блокирования матриксной металлопротеиназы, стабилизируют состояние гемато-энцефалического барьера. Интерферон бета 1b (Бетаферон®) – первый из интерферонов бета, синтезированных для иммуномодулирующего лечения рассеянного склероза, в настоящее время считается признанным лекарственным средством во всём мире. Среди всех ПИТРС Бетаферон имеет самый длительный клинический опыт применения. К настоящему времени представления об эффективности и безопасности применения Бетаферона основаны на результатах контролируемых клинических исследований с участием больных с ремиттирующим и вторично-прогрессирующим течением рассеянного склероза, а также у пациентов с клинически изолированным синдромом. Опыт применения интерферона бета 1b во взрослой неврологической практике насчитывает уже более чем 16-летний катамнез клинического наблюдения. В 2005 году впервые были представлены результаты 16-летнего проспективного мультицентрового исследования 135 взрослых больных РС, у которых на фоне непрерывной иммуномодулирующей терапии интерфероном бета 1b установлена эффективность и безопасность длительного применения этого препарата [16]. Клинические исследования показали, что применение Бетаферона у взрослых пациентов с ремиттирующим и вторично-прогрессирующим течением рассеянного склероза снижает частоту клинических обострений (через 2 года на 34 и 30 % соответственно по сравнению с группой пациентов, принимавших плацебо), тяжесть рецидивов, число госпитализаций, потребность в лечении кортикостероидами, а также удлиняет продолжительность ремиссий. По данным магнитно-резонансной томографии головного мозга у больных с ремиттирующим и вторично-прогрессирующим течением заболевания на фоне лечения Бетафероном имеет место значительное уменьшение образования новых активных очагов, а также снижается тяжесть патологического процесса. Доказано, что применение интерферона бета 1b при клинически изолированном синдроме способствует увеличению времени до постановки диагноза достоверного рассеянного склероза. У больных с вторично-прогрессирующим рассеянным склерозом применение Бетаферона позволяет задержать прогрессирование заболевания на срок до 12 месяцев даже при значительной степени инвалидизации. В настоящее время существует ряд исследований, проведённых как за рубежом, так и в нашей стране, посвящённых исследованию применения интерферона бета 1b (Бетаферон) у детей и подростков [5, 17]. Первым опытом применения препаратов для иммуномодулирующей терапии РС до 18 лет, опубликованным в литературе, было клиническое наблюдение, проведённое A.B. Adams и соавторами в 1999 году, продемонстрировавшее «драматическую» клиническую эффективность (достоверное уменьшение инвалидизации и отсутствие обострений на всем протяжении лечения), подтверждённую динамическими данными МРТ позитивный опыт длительного (30 месяцев) лечения интерфероном бета 1b ребёнка 7 лет с ремиттирующим РС. Учитывая отсутствие опыта применения интерферонов бета у детей, доза препарата была адаптирована к возрасту: начальная – 4 млн МЕ, через год была увеличена до 6 млн МЕ. Ни системных, ни местных побочных реакций за время лечения отмечено не было. За время терапии у ребенка было зарегистрировано кратковременное повышение титра нейтрализующих антител к интерферону бета 1b, не влиявшее на эффективность терапии как клиническую, так и по данным МРТ [5]. Следующим описанием применения интерферона бета 1b у детей с рассеянным склерозом является исследование, проведённое в 2001 году S.N. Tenembaum и соавт., которые также описывают позитивный опыт применения интерферонов бета и глатирамера ацетата у 19 детей с ремиттирующим и вторично-прогрессирующим РС с обострениями (5 детей получали интерферон бета 1b). В данной публикации обращает внимание обоснование применения у детей и подростков «взрослых» стандартных доз интерферонов бета, так как попытка уменьшения дозы препарата в исследовании («адаптация» к возрасту) снижала клиническую эффективность терапии. В отечественной литературе в 2004 году авторами Н.А. Тотолян и А.А. Скоромцом на примере 5 клинических случаев был проиллюстрирован собственный опыт назначения интерферона бета 1b до 18 лет. Полученные данные клинического наблюдения были исследователями проанализированы и предложен ряд аргументированных выводов:
1) о целесообразности максимально раннего назначения препаратов для иммуномодулирующей терапии детям и подросткам с РС, особенно с высокой активностью заболевания, характеризующейся высокой частотой обострений (2 обострения и более в течение первого года от начала манифестации РС); 2) учитывая немногочисленные данные о безопасности применения интерферонов бета в детском и подростковом возрасте, рекомендуется начинать этот вид терапии в условиях стационара, контролируя изменения биохимических и гематологических показателей (например, количество лейкоцитов крови, активность печёночных ферментов, уровень креатинина в сыворотке крови); 3) ожидаемые системные и местные побочные эффекты при назначении интерферонов бета требуют профилактики (например, переноса инъекции препарата на вечернее время) и, при необходимости, коррекции (например, назначение нестероидных противовоспалительных препаратов);
4) в большинстве случаев детям показаны стандартные дозы интерферонов бета, однако для уменьшения выраженности и продолжительности гриппоподобного синдрома целесообразно титрование дозы препарата в начале лечения; 5) терапия препаратами интерферонов бета должна быть непрерывной и длительной, так как необоснованное прекращение лечения влечёт за собой достоверную декомпенсацию иммунопатологического процесса [17].
В 2006 году были опубликованы результаты первого международного мультицентрового ретроспективного исследования безопасности и переносимости применения интерферона бета 1b у детей и подростков с РС, основывавшегося на результатах наблюдения пациентов, получивших до 18 лет хотя бы одну инъекцию интерферона бета 1b, собранных до 2004 года включительно. Проведённое исследование позволило систематизировать разрозненные данные об опыте применения интерферона бета 1b в педиатрии. В исследование были включены 43 пациента педиатрического возраста с ремиттирующим РС из 8 медицинских центров США, Канады, Аргентины, Турции, России и Германии. После заключительной обработки полученных данных, диагностическим критериям достовёрного РС удовлетворили только 39 пациентов [18, 19], у которых и проводился итоговый анализ эффективности лечения, а результаты наблюдения 4 детей, не включённых в эту группу, использовали при оценке переносимости терапии. Средняя продолжительность иммуномодулирующего лечения составила 29,2 месяцев, а средний возраст больных на момент начала терапии был 13 ± 3,0 лет. Клиническая эффективность иммуномодулирующей терапии была подтверждена снижением среднего балла по шкале EDSS с 2,5 (от 0 до 8,5) до 2,0 (от 0 до 6,5) и 50-процентной редукцией среднегодовой частоты обострений (динамика показателя оценивалась у 32 детей, получавших лечение 12 мес. и более). Для объективизации статистической обработки данных о безопасности и переносимости терапии в неоднородной по возрасту группе больных, все пациенты были условно разделены на подгруппу детей до 10 лет включительно (8 больных) и подгруппу подростков от 11 до 17 лет 10 месяцев (35 больных). Следует отметить, что в подгруппе детей до 10-лет было зарегистрировано больше лабораторных отклонений, связанных с активностью печёночных ферментов, что, по-видимому, влияло на увеличение количества побочных реакций в младшей группе в целом (87,5 % по сравнению с 62,9 % у более старших пациентов). На основании спектра, частоты и выраженности клинических побочных реакций (гриппоподобный синдром у 35 % пациентов, местные реакции – 21 % пациентов) и изменений лабораторных показателей (повышение активности печёночных трансаминаз у 26 % пациентов), причём ни один из выявленных побочных эффектов не был расценен как тяжёлый или неожиданный, авторами был сделан вывод о хорошей переносимости лечения [20]. В Научном центре здоровья детей РАМН (дир. академик РАМН А.А. Баранов) было осуществлено клиническое наблюдение 22 подростков с ремиттирующим (18 пациентов) и вторично-прогрессирующим (4 пациента) рассеянным склерозом в возрасте от 13 до 17 лет, на фоне лечения интерфероном бета 1b (продолжительностью от 2 до 15 месяцев) в дозе 8 млн МЕ подкожно через день [21]. Эффективность терапии у пациентов была подтверждена уменьшением среднего показателя инвалидизации (с 2,56 ± 0,23 до 2,09 ± 0,22 балла по шкале EDSS); количеством пациентов без обострений на фоне лечения (13 детей – 59 %); снижением показателя среднегодовой частоты обострений у 7 пациентов, получавших препарат от 12 месяцев и более (от 2 ± 0,37 до 1,14 ± 0,34 обострений в год), и коэффициента прогрессирования с 0,69 ± 0,15 до начала лечения до 0,45 ± 0,07 после курса иммуномодулирующей терапии. На фоне терапии у 12 пациентов (54 %) были отмечены побочные реакции, представленные в 50 % (у 11 пациентов) гриппоподобным синдромом, в 9 % (у 2 пациентов) наблюдались местные реакции, у одного подростка (4,5 %) было зарегистрировано изменение биохимических показателей крови – значительное повышение активности печёночных трансаминаз (более чем в 10 раз), и в одном клиническом случае (4,5 %) наблюдался депрессивный эпизод. В последних двух случаях было принято решение об отмене препарата. Совокупность всех представленных выше данных демонстрирует необходимость и целесообразность своевременного назначения препаратов для иммуномодулирующей терапии как подросткам, так и детям с рассеянным склерозом. Результаты исследования естественного течения рассеянного склероза у детей (67 больных с началом заболевания до 16 лет, наблюдавшихся без применения препаратов для иммуномодулирующего лечения в течение 4,91 ± 0,58 лет), также проведённые в 2002 году в НИИ педиатрии НЦЗД РАМН, свидетельствуют о том, что без терапии, в течение первых пяти лет от момента манифестации заболевания, то есть к окончанию «педиатрического» возраста, практически у 100 % больных с ранним дебютом рассеянного склероза формируется стойкий неврологический дефицит с EDSS = 3 баллам, и около 40 % больных перейдут в стадию вторичного прогрессирования рассеянного склероза [22]. В тоже время, высказанное как отечественными, так и зарубежными авторами предположение о высокой функциональной пластичности, более интенсивной ремиелинизации и о менее тяжёлом нейрональном повреждении у детей было подтверждено данными динамического МРТ-наблюдения детей и подростков с ремиттирующим рассеянным склерозом. Таким образом, опираясь на теоретические данные и практический позитивный опыт применения ПИТРС в детской неврологической практике, можно утверждать, что раннее начало иммуномодулирующей терапии рассеянного склероза у пациентов детского и подросткового возраста не только возможно, но и необходимо, так как дети и подростки, не получившие своевременного и адекватного лечения, к моменту своего совершеннолетия станут стойкими неврологическими инвалидами.
Рекомендуемая литература 1. Duquette P., Murray T.J., Pleines J. et al. Multiple sclerosis in childhood: clinical profile in 125 patients // J Pediatr. 1987; 111: 359-363. 2. Ghezzi A., Deplano V., Faroni J. et al. Multiple sclerosis in childhood: clinical features of 149 cases // Mult Scler. 1997; 3: 43-46. 3. Boiko A., Vorobeychik G., Paty D., Devonshire V., Sadovnick D. Early onset multiple sclerosis: a longitudinal study // Neurology. 2002; 59: 1006-1010. 4. Banwell B.L. Pediatric multiple sclerosis // Curr Neurol Neurosci Rep. 2004; 4: 245-252. 5. Adams A.B., Tyor W.R., Holden K.R. Interferon beta-1b and childhood multiple sclerosis // Pediatr Neurol. 1999; 21: 481-483. 6. Mikaeloff Y., Moreau T., Debouverie M. et al. Interferon-beta treatment in patients with childhood-onset multiple sclerosis // J Pediatr. 2001; 139: 443-446. 7. Waubant E., Hietpas J., Stewart T. et al. Interferon beta-1a in children with multiple sclerosis is well tolerated // Neuropediatrics. 2001; 32: 211-213. 8. Eraksoy M., Demir G., Ozcan H., Bavndir C., Say A., Saruhan G. Multiple Sclerosis in childhood: a prospective study // J Neurol. 1996; 243: 444. 9. Eraksoy M. In: Siva A, Kesselring J, Thompson AJ, eds. Multiple sclerosis in children: a review. London: Martin Dunitz, 1999. 10. Tenembaum S., Segura M., Fejerman N. Tolerability and efficacy of disease-modifying therapies in childhood and juvenile multiple sclerosis // Neurology. 2001; 56: A361. 11. Tenembaum S., Segura M., Fejerman N. Disease-modifying therapies in childhood and juvenile multiple sclerosis // Mult Scler. 2001; 7: S57. 12. Tenembaum S., Segura M. Clinical effects of disease-modifying therapies in early-onset multiple sclerosis // Neurology. 2004; 62: A488. 13. Pohl D., Rostasy K., Gartner J., Hanefeld F. Treatment of early onset multiple sclerosis with subcutaneous interferon beta-1a // Neurology. 2005; 64: 888-890. 14. Rieckmann P., Toyka K.V., Bassetti C. et al. Escalating immunotherapy of multiple sclerosis-new aspects and practical application // J Neurol. 2004; 251: 1329-1339. 15. Kappos L., Polman C.H., Freedman M.S., Edan G., Hartung H.P., Miller D.H., Montalban X., Barkhof F., Bauer L., Jakobs P., Pohl C., Sandbrink R. Treatment with interferon beta-1b delays conversion to clinically definite and McDonald MS in patients with clinically isolated syndromes // Neurology. 2006; 67: 1-8. 16. Ebers G., Rice G., Wolf Ch., Traboulsee A., Langdon D., Kaskel P., Salazar-Grueso E. 16-year long-term follow-up of interferon beta-1b treatment of patients with multiple sclerosis. Presented at Congress: 2005: 21st ECTRIMS, Thesaloniki, Greece. 17. Totolian N.A., Skoromets A.A. Interferon-beta treatment in patients with childhood-onset and juvenile multiple sclerosis // Zh Nevrol Psikhiatr Im S S Korsakova. 2004;104(9):23-31. 18. McDonald W.I., Compston A., Edan G. et al. Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis // Ann Neurol. 2001; 50: 121-127. 19. Poser C.M., Paty D.W., Scheinberg L. et al. New diagnostic criteria for multiple sclerosis: guidelines for research protocols // Ann Neurol. 1983; 13: 227-231. 20. Banwell B., Reder A. T., Krupp L. et al. Safety and tolerability of interferon beta-1b in pediatric multiple sclerosis // Neurology. 2006; 66; 472-476. 21. Быкова О.В., Кузенкова Л.М., Маслова О.И. Применение интерферона бета 1b у подростков с рассеянным склерозом // Ж. неврологии и психиатрии им. С.С. Корсакова 2006;9: 29-33. 22. Gusev E., Boiko A., Bikova O. et al. The natural history of early onset multiple sclerosis: comparison of data from Moscow and Vacouver // Clin Neurol Neurosurg. 2002, 104: 203-207. 23. Higurashi N., Hamano S., Eto Y. Secondary progressive multiple sclerosis in childhood – interferon beta 1b treatment //To Hattatsu. 2006; 38: 3: 209-13.
Интерферон бета-1b (Interferon beta-1b)
Рекомбинантный интерферон бета-lb выделяют из клеток Escherichia coli, в геном которых внедрен ген человеческого интерферона бета, кодирующий аминокислоту серии в 17-й позиции. Интерферон бета-lb представляет собой негликозилированный белок молекулярной массы 18500 дальтон, состоящий из 165 аминокислот.
Фармакодинамика
Интерфероны по своей структуре являются белками и принадлежат к семейству цитокинов. Молекулярная масса интерферонов находится в диапазоне от 15000 до 21000 Дальтон. Выделяют три основных класса интерферонов: альфа, бета и гамма. Интерфероны альфа, бета и гамма имеют схожий механизм действия, однако различные биологические эффекты. Активность интерферонов видоспецифична, и, следовательно, изучить их эффекты возможно только на культурах клеток человека или in vivo на человеке.
Интерферон бета-lb обладает противовирусной и иммуномодулирующей активностями. Механизм действия интерферона бета-lb при рассеянном склерозе до конца не установлен. Однако известно, что биологический эффект интерферона бета-lb опосредуется его взаимодействием со специфическими рецепторами, которые обнаружены на поверхности клеток человека. Связывание интерферона бета-lb с этими рецепторами индуцирует экспрессию ряда веществ, которые рассматриваются в качестве медиаторов биологических эффектов интерферона бета-lb. Содержание некоторых из этих веществ определяли в сыворотке и фракциях клеток крови больных, получавших интерферон бета-lb. Интерферон бета-lb снижает связывающую способность рецептора интерферона гамма и повышает его интернализацию и деградацию. Кроме того, интерферон бета-lb повышает супрессорную активность мононуклеарных клеток периферической крови.
Не проводилось целенаправленных исследований с целью определения воздействия
интерферона бета-lb на функцию сердечно-сосудистой системы, дыхательной и
эндокринной систем.
Результаты клинических исследований
Ремиттирующий рассеянный склероз:
В рамках контролируемого клинического исследования пациентов с ремиттирующей формой рассеянного склероза, способных к самостоятельной ходьбе (EDSS от 0 до 5,5), получавших препарат интерферона бета-lb, получены данные, о том, что препарат снижает частоту обострений на 30%, уменьшает тяжесть обострений и число госпитализаций по причине основного заболевания. В дальнейшем были показаны увеличение интервала между обострениями и тенденция к замедлению прогрессирования ремиттирующего рассеянного склероза.
Вторично-прогрессирующий рассеянный склероз:
Было проведено два контролируемых клинических исследования, включивших 1657 пациентов с вторично прогрессирующей формой рассеянного склероза. В исследованиях приняли участие пациенты с исходным значением EDSS от 3 до 6,5 баллов, т.е. пациенты были способны самостоятельно ходить. При оценке главной конечной точки исследования «время до подтвержденной прогрессии», т.е. способности замедлять прогрессирование заболевания в исследованиях, были получены противоречивые данные. Одно из двух исследований показало статистически значимое замедление скорости прогрессирования инвалидизации (отношение рисков = 0.69 при 95% доверительном интервале (0.55, 0.86), р=0.0010, снижение рисков составило 31% в группе терапии интерфероном бета-lb) и увеличение времени до момента утраты возможности передвигаться самостоятельно, т.е. использования инвалидного кресла или EDSS 7,0 (отношение рисков = 0.61 при 95% доверительном интервале (0.44, 0.85), р=0.0036, снижение рисков составило 39% в группе терапии интерфероном бета-lb) среди пациентов, принимавших интерферон бета-lb. Терапевтический эффект препарата сохранялся и в последующем периоде наблюдения вне зависимости от частоты обострений.
Во втором исследовании препарата интерферона бета-lb у пациентов с вторично прогрессирующей формой рассеянного склероза не показано замедления скорости прогрессирования. Однако, пациенты, включенные в это исследование, имели меньшую активность заболевания, нежели пациенты в других исследованиях при вторично- прогрессирующем течении рассеянного склероза. При проведении ретроспективного мета-анализа данных обоих исследований показан статистически значимый эффект (р=0,0076, при сравнении групп пациентов, получавших интерферон бета-lb 8 млн ME, и группы плацебо).
Ретроспективный анализ по субгруппам показал, что влияние на скорость прогрессирования более выражено в группе пациентов с высокой активностью заболевания до начала терапии (отношение рисков = 0.72 при 95% доверительном интервале (0.59, 0.88), р=0.0011, снижение рисков составило 28% в группе пациентов с обострениями или быстрой прогрессией EDSS, получавших интерферон бета-lb, в сравнении с группой плацебо). По результатам проведенного анализа можно заключить, что анализ частоты рецидивов и быстрой прогрессии EDSS (EDSS> 1 балла или > 0,5 при базовой EDSS>6 баллов за предшествующие терапии два года) может способствовать выявлению пациентов с активным течением заболевания. В данных исследованиях было также показано снижение частоты обострений (30%). Не было показано, что интерферон бета-lb оказывает влияние на продолжительность обострений.
Клинически-изолированный синдром:
Одно контролируемое клиническое исследование интерферона бета-lb провели у пациентов с клинически изолированным синдромом (КИС). КИС предполагает наличие единственного клинического эпизода демиелинизации и/или, по крайней мере, двух клинически не проявляющих себя очагов на Т2-взвешенных изображениях МРТ, которых недостаточно для постановки диагноза клинически достоверного PC. Установлено, что КИС с большой вероятностью в дальнейшем приводит к развитию рассеянного склероза. В исследование включались пациенты с одним клиническим очагом или двумя и более очагами на МРТ, при условии, что все альтернативные заболевания, которые могли бы служить наиболее вероятной причиной имеющихся симптомов, кроме рассеянного склероза, были исключены.
Это исследование состояло из двух фаз, плацебо-контролируемой фазы и фазы последующего наблюдения. Плацебо-контролируемая фаза имела продолжительность 2 года или до момента перехода пациента в клинически достоверный рассеянный склероз (КДРС). После завершения плацебо-контролируемой фазы пациент переводился в фазу последующего наблюдения на фоне терапии интерфероном бета-lb. С целью оценки раннего и отсроченного эффекта назначения интерферона бета-lb сравнивались группы пациентов, первоначально рандомизированных на интерферон бета-lb (группа немедленного лечения) и плацебо (группа отсроченного лечения). В ходе исследования пациенты и исследователи оставались заслеплены относительно распределения пациентов в группы терапии.
Таблица 1. Эффективность интерферона бета-lb в рамках клинических исследований BENEFIT и продленного наблюдения пациентов исследования BENEFIT.
| Результаты 2 летней | Результаты 3-го года | Результаты по итогам 5- | |||||
| терапии | терапии | го года наблюдения | |||||
| Плацебо- | Последующая фаза | Последующая фаза | |||||
| контролируемая фаза | открытой терапии | открытой терапии | |||||
| Интерферон бета-lb 8 млн ME | Плацебо | Группа немедленн ого лечения интерферо ном бета- lb 8 млн ME n=292 | Группа отсроченного лечения интерфероном бета-lb 8 млн ME | Группа немедленного лечения интерфероном бета-lb 8 млн ME | Группа отсроченного лечения интерфероном бета-1 b 8 млн МЕ | ||
| n=292 | n=176 | n=176 | n=292 | n=176 | |||
| Число | 271 (93%) | 166 | 249 | 143 (81%) | 235 (80%) | 123 (70%) | |
| пациентов | (94%) | (85%) | |||||
| завершивших | |||||||
| данную фазу | |||||||
| Основные показатели эффективности | |||||||
| Время до развития клинически достоверного рассеянного склероза (КДРС) | |||||||
| По Каплан- Майеру | 28% | 45% | 37% | 51% | 46% | 57% | |
| Уменьшение риска | 47% в сравнении с плацебо | 41% в сравнении с группой отсроченного лечения интерфероном бета-1b | 37% в сравнении с группой отсроченного лечения интерфероном бета-1b | ||||
| отношение рисков при 95% ДИ | HR=0.53[0.39,0.73] | HR=0.59[0.42,0.83] | HR=0.63[0.48,0.83] | ||||
| Лог- ранговый тест | pO.OOOl интерферон бета-lb продлил время до наступления КДРС на 363 дня, от 255 дней в группе плацебо (до 618 дней в группе интерферона бета-lb) | Р=0.0011 | Р=0.0027 | ||||
| Время до трансформации в PC по критериям Мак-Дональда | |||||||
| По Каплан- Майеру | 69% | 85% | Не являлся главной конечной точкой | Не являлся главной конечной точкой | |||
| Уменьшение риска | 43% в сравнении с группой плацебо | ||||||
| отношение рисков при 95% ДИ | HR=0.57[0.46,0.71] | ||||||
| Лог- ранговый тест | p<0.000l | ||||||
| Время до прогрессии EDSS | |||||||
| По Каплан- | Не являлся главной | 16% | 24% | 25% | 29% | ||
| Майеру | конечной точкой | ||||||
| Уменьшение | 40% в сравнении с | 24% в сравнении с | |||||
| риска | группой отсроченного лечения интерфероном бета-1 b | группой отсроченного лечения интерфероном бета-1 b | |||||
| отношение | HR=0.60[0 | 39,0.92] | HR=0.76[0.52,1.11] | ||||
| рисков при 95% ДИ | |||||||
| Лог- | Р=0.022 | Р=0.177 | |||||
| ранговый | |||||||
| тест | |||||||
В плацебо-контролируемой фазе исследования интерферон бета-lb статистически достоверно предотвращал переход КИС в КДРС. В группе пациентов, получавших интерферон бета-lb, показана задержка трансформации в достоверный рассеянный склероз по критериям Мак-Дональда (см. таблицу 1).
Анализ подгрупп в зависимости от исходных факторов продемонстрировал эффективность интерферона бета-lb в отношении предотвращения трансформации в КДРС во всех подгруппах. Риск трансформации в КДРС в течение 2 лет был выше в группе пациентов с монофокальным КИС с 9 и более очагами на Т2-взвешенных изображениях или с наличием очагов, накапливающих контраст, по данным МРТ в начале исследования. Эффективность интерферона бета-lb в группе пациентов с мультифокальными клиническими проявлениями не зависела от исходных показателей МРТ, что свидетельствует о высоком риске трансформации КИС в КДРС у пациентов данной группы.
В настоящее время нет общепринятого определения высокого риска, однако к группе высокого риска развития КДРС можно отнести пациентов с моноочаговым КИС (клиническим проявлением 1 очага в ЦНС) и по крайней мере 9 очагами на МРТ в Т2- режиме и/или накапливающим контрастное вещество. Пациенты с многоочаговым КИС (клиническими проявлениями >1 очага в ЦНС) относятся к группе высокого риска развития КДРС независимо от количества очагов на МРТ. В любом случае, решение о назначении интерферона бета-lb должно быть принято, исходя из заключения о высоком риске развития КДРС у пациента.
Терапия с интерфероном бета-lb хорошо переносилась пациентами, на что указывает низкий процент выбывших пациентов (93% завершили исследование).
Для улучшения переносимости проводилось титрование дозы интерферона бета-lb, применялись нестероидные противовоспалительные препараты в начале терапии. Кроме того, применялся автоинжектор у большинства пациентов на протяжении всего исследования.
В дальнейшем интерферон бета-lb сохранял высокую эффективность по способности предотвращать развитие КДРС после 3 и 5 лет наблюдения (табл. 1), несмотря на то, что большинство пациентов, получавших плацебо, начали терапию интерфероном бета-lb через два года после начала исследования. Подтвержденная прогрессия EDSS (увеличение EDSS, по крайней мере, на одном визите в сравнении с исходным значением) была ниже в группе немедленного лечения (табл. 1, значительный эффект выявлен на 3-м году терапии, но на 5-м эффект отсутствует). У большинства пациентов в обеих группах не было прогрессирования инвалидности за 5-летний период. Не получено убедительных доказательств в пользу влияния на данный исход немедленного назначения интерферона бета-lb. Не показано влияния немедленного лечения интерфероном бета-lb на качество жизни пациентов.
Ремиттирующий, вторично-прогрессирующий рассеянный склероз и клинически- изолированный синдром:
Эффективность интерферона бета-lb показана во всех клинических исследованиях по способности уменьшать активность заболевания (острое воспаление в ЦНС и стойкое повреждение ткани), оцененную по показателям магнитно-резонансной томографии (МРТ). Соотношение клинической активности рассеянного склероза и активности заболевания по МРТ — показателям в настоящее время до конца не установлено.