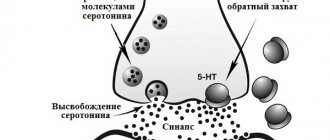
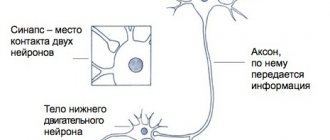
Рассеянный склероз
(РС) ― это хроническое, неизлечимое заболевание аутоиммунного характера. Патологические процессы (демиелинизация) затрагивают миелиновые оболочки нейронов головного и спинного мозга. Здоровая ткань заменяется плотной соединительной тканью, рубцового типа. Она не проводит нервные импульсы, что приводит к различным неврологическим симптомам.
Диагностика рассеянного склероза на начальном этапе заболевания затруднена. Важно проходить полные, регулярные медицинские осмотры. В этом случае можно зафиксировать начало болезни и начать своевременное лечение. Это поможет существенно замедлить патологические изменения и на длительный срок продлить трудоспособность больного.
анализы
Причины возникновения рассеянного склероза
В настоящий момент точной причины болезни не установлено. Одни из наиболее вероятных факторов, влияющих на развитие РС считаются:
- перенесенные вирусные или бактериальные инфекции;
- длительное воздействие повышенной радиационного поля;
- хронические отравления токсическими веществами;
- некачественное, неполноценное питание;
- неблагоприятная экологическая обстановка;
- перенесенные травмы;
- частые стрессовые ситуации.
По статистике заболевание чаще возникает в молодом возрасте, до 40 лет. Однако, редко, но все же встречается как у детей младше 15 лет, так и у людей старшего поколения. Чаще диагностируется у представительниц женского пола, на одного мужчину приходится при больных женщины. Имеет значение не только половая, но и расовая принадлежность. К рассеянному склерозу более склонны представители европеоидной расы.
Заболеваемость выше в крупных, промышленных городах, что может свидетельствовать о влиянии неблагоприятной экологической обстановки и стрессов. Россия относится к зоне высокого риска, поскольку здесь диагностируется более 30 больных на каждые 100 тысяч человек.
Проявление рассеянного склероза
Симптомы зависят от локализации наиболее серьезной демиелинизации.
1. При поражении пирамидной системы:
- Повышение сухожильно-периостальных рефлексов, возникающий в ответ на раздражители.
- Снижение мышечной силы и повышенная мышечная утомляемость с сохранением функциональности.
- Тетрапарез ― повышенный тонус отдельной группы мышц.
2. При поражении мозжечка:
- Атаксия (нарушение согласованности движений) туловища и конечностей.
- Интенционный тремор (колебания всего тела или его частей из-за неконтролируемых мышечных сокращений).
- Мышечная гипотония (понижение тонуса и силы мышц вплоть до пареза).
3. При поражении нейронов могут наблюдаются параличи следующих нервов:
- лицевых;
- глазодвигательных;
- подъязычного;
- тройничного нерва.
4. Другие симптомы РС:
- бульбарные и псевдобульбарные синдромы;
- нистагмы ― непроизвольные движения глаз;
- суставно-мышечные боли;
- потеря тактильной чувствительности;
- возникновение чувство давления в конечностях;
- поверхностное покалывания в пальцах;
- недержание и задержка мочи и дефекации;
- нарушение половой функции;
- снижение остроты и качества зрения (потеря яркости, искаженное восприятие цвета).
При рассеянном склерозе наблюдают и нейропсихологические изменения. Они заключаются в изменении привычек, снижении умственных способностей, вытекающих в специфическое органическое слабоумие. Пациенты страдают депрессиями, сменяемыми периодами эйфории, часто теряют контроль над своими эмоциями. Эмоциональная нестабильность, т. е. быстрая смена настроения, считающаяся одним из ранних симптомов. Для оценки выраженности симптоматики используют шкалу от 0 до 6, а степень инвалидности больного РС в баллах от 0 до 10 по шкале EDSS.
Симптомы и проявления
Развитие заболевания бывает медленным или стремительным – это зависит от формы. В случае второго варианта у больного больше шансов вовремя обратиться за помощью. Если склероз прогрессирует медленно, пациенты долгое время не обращают внимания на ухудшение самочувствия.
Наиболее характерные симптомы рассеянного склероза:
- Повышенная утомляемость, потеря мышечной силы. С развитием заболевания появляются парезы. Как правило, симптомы выражены сильнее для нижних конечностей. При неврологическом осмотре – нарушения рефлексов. Дистония, гипотония.
- Нарушение координации. Проявляется индивидуально – у одного возникает головокружение, почерк становится хуже, появляется дрожание рук. У кого-то возникают проблемы с походкой. С прогрессированием заболевания симптомы усиливаются, сильно нарушается двигательная функция.
- Нарушения речи возникают с развитием болезни – поначалу ярко проявляется скандирование речи.
- Расстройства зрительного нерва – двоение в глазах, нистагм, косоглазие. Могут наблюдаться нарушения со стороны тройничного и лицевого нервов.
- Потеря чувствительности – симптом, который наряду с двигательной дисфункцией позволяет с высокой степенью вероятности предположить рассеянный склероз. Немеют части лица, конечности. Могут наблюдаться покалывания в мышцах.
- Частое или редкое мочеиспускание, частые или уреженные позывы к дефекации.
- Импотенция, снижение либидо.
- Изменения интеллектуальной сферы – снижение памяти, концентрации внимания, способности к анализу. Пациент быстро устает при решении интеллектуальных задач, сложно переключается.
- Психологические нарушения – депрессия, тревожность, нервозность, эйфоричность.
Симптомы могут проявляться по-разному, в зависимости от того, в каких отделах центральной нервной системы локализованы бляшки. Если несколько из перечисленных факторов Вы наблюдете у себя и или кого-то из своих близких – обязательно проконсультируйтесь с опытным неврологом!
Диагностика рассеянного склероза
Заболевание не имеет характерных, присущих только ему симптомов. Поэтому всегда проводится дифференциальное диагностирование. Врачу необходимо исключить большое количество врожденных патологий и болезней нервной системы. Схожими изменениями обладают системная волчанка, инсульт, синдром Шегрена, болезни Паркинсона и Бехчета.
1.
Лабораторная диагностика
При проведении общего анализа крови изменение показателей позволяет заподозрить развитие рассеянного склероза. К ним относятся:
- Концентрация лимфоцитов ― повышенное содержание до 40% и более.
- Количество лейкоцитов ― меньше нормы.
- Скорость оседания эритроцитов ― увеличена.
Проверить наличие аутоиммунного сбоя поможет пункция спинномозговой жидкости. При РС в ней будет выявлен высокий процент иммуноглобулинов и олигоклональных антител (антител IgG).
Проанализировать состояние иммунной системы можно сделав иммунограмму. Для этого необходимо сдать венозную кровь для проведения комплексного исследования. Оно направлено на выявление концентрации лимфоцитов и иммуноглобулинов различных типов. Как правило, при РСВ концентрация иммунных клеток повышена, свидетельствуя об аутоиммунном процессе, а другие параметры понижены, как следствие ослабления защиты организма.
2. Инструментальная диагностика
Наиболее эффективным в настоящий момент считается проведение электромагнитного суперпозиционного сканирование мозговых структур (СПЭМС) или электроэнцефалограмма. Сканирование позволяет диагностировать рассеянный склероз на ранней стадии развития, когда отсутствуют или слабо выражены неврологические признаки. Однако, у СПЭМС высока погрешность, изменения выявляются в одном случае из трех.
Суть метода заключена в выявлении очаговых потерь миелина. При наличие патологических изменений нарушается проводимость нервных импульсов. Проводится через размещение нескольких датчиков, отслеживающих биоэлектрические импульсы, на голове пациента. В результате получается электроэнцефалограмма ― графическое изображение колебательного электрического процесса.
3. Магнитно-резонансная и компьютерная томография
Оценить состояние нервной системы и диагностировать РС позволяет компьютерная и магнитнорезонансная диагностика. Повысить эффективность исследования помогает использование контрастного раствора. Препарат вводится внутривенно, не вызывает никаких ощущений и дискомфорта.
Степень чувствительности томографии крайне высока, достигает точности в 95%. Позволяет с точностью диагностировать рассеянный склероз в следующих случаях:
- обнаружение 4 и более очагов демиелинизация;
- диаметр поражения нервных волокон от 3 мм;
- очаги поражения расположены в нервных волокнах, в черепной ямке, прилегают к боковым желудкам.
Контрастный раствор помогает не только увеличить видимость, но и сам по себе является маркером наличия патологии. Его скопление в очагах поражения говорит об активном воспалительном процессе. Аналогично проводится томограмма спинного мозга.
Рассеянный склероз (РС) — самое распространенное воспалительное демиелинизирующее заболевание ЦНС. Несмотря на многолетнее изучение РС до сих пор не существует ни одного его патогномоничного признака. В связи с этим поиск специфических биомаркеров при РС в настоящее время является актуальной задачей не только клинической медицины, но и нейробиологии.
Биомаркерами называют измеряемые и поддающиеся количественному определению параметры (например, концентрация фермента, распределение фенотипа гена в популяции, присутствие в биологических жидкостях определенных веществ), которые служат для оценки физиологических и патологических процессов в организме, таких как риск возникновения заболевания, воздействие факторов внешней среды и его влияние, диагностика заболевания, метаболические процессы и др.
В настоящее время ведется активный поиск биомаркеров РС, способных предсказать и оценить темп прогрессирования заболевания, помочь в определении тактики лечения и оценить его эффективность, прояснить во многом еще неизученный патогенез заболевания и, наконец, выявить новые мишени для терапии. Кроме того, учитывая неспецифичность клинических проявлений РС, исследуются также диагностические маркеры, позволяющие выявить заболевание на раннем этапе развития и своевременно начать патогенетическую терапию и определить группы риска по РС [42].
На данный момент для РС не выявлено биомаркеров, обладающих достаточной чувствительностью и специфичностью. На сегодняшний день при демиелинизирующих заболеваниях специфичный маркер известен только для оптикомиелита (ОМ), — это антитела к аквапорину-4 (Aqp-4). Их выявление позволяет дифференцировать оптикомиелит Девика от других заболеваний нервной системы. Частота выявления варьирует в различных исследованиях и, вероятно, зависит в том числе от этнической принадлежности изучаемой группы пациентов.
Поиск и валидация биомаркеров РС обусловлены сложностью и гетерогенностью патогенеза этого заболевания. Иммунохимические методы исследования выявили, что формирование бляшки демиелинизации у разных пациентов происходит не одинаково. Было выделено 4 основных морфологических типа (паттерна) демиелинизации при РС. Паттерн I характеризуется интенсивной макрофагальной инфильтрацией, превалирующей над Т-лимфоцитарной. В бляшках паттерна II доминируют иммуноглобулины, также в большом количестве определяется C9neo-антиген. Для бляшек I и II паттернов общими чертами является деструкция всех белков миелина. К особенностям паттерна III относятся преимущественная деструкция миелин-ассоциированного гликопротеина (MAG) в дистальных отделах олигодендроцитарных отростков, фрагментация ядрышек олигодендроцитов. Данный паттерн демиелинизации по своим цитологическим характеристикам очень близок изменениям в белом веществе при ишемии. В бляшках IV паттерна описана первичная олигодендроцитарная дегенерация с равномерным разрушением всех белков миелина и фрагментацией генетического материала.
Таким образом, гистоиммунохимические исследования подтверждают гетерогенность патогенеза РС и диктуют необходимость учитывать, что набор биомаркеров, характеризующих свойства патологического процесса при различных механизмах демиелинизации, также может быть разнородным.
Маркеры воспаления.
Воспалительная реакция при РС является одним из центральных звеньев патогенеза. Считается, что первым этапом развития воспалительной реакции является активация обладающих энцефалитогенным потенциалом лимфоцитов и их проникновение в ЦНС через гематоэнцефалический барьер (ГЭБ). По нынешним представлениям, активация лимфоцитов связана с нарушением иммунного гомеостаза и влиянием дополнительных экзогенных сигналов в первую очередь постоянным воздействием бактериальных и вирусных антигенов. При их мигрировании через ГЭБ они экспрессируют металлопротеиназы и различные цитокины, реактивируются с помощью фрагментов миелиновых антигенов, что приводит к дальнейшему увеличению выброса биологически активных молекул и прогрессивному развитию воспалительной реакции в ЦНС. Дополнительными повреждающими факторами являются активно продуцирующиеся в ходе воспаления токсические медиаторы, такие как нитросоединения и активные формы кислорода. Кроме того, происходят активация В-лимфоцитов и усиление продукции антител против компонентов миелина, которое обусловливают развитие демиелинизации, что было показано как в экспериментальных моделях, так и у людей [6].
Биомаркеры, выявляющиеся в крови и ЦСЖ пациентов с РС, являются отражением описанных реакций. Об активации процесса говорит изменение уровней цитокинов, молекул адгезии, миграции и других маркеров, отражающих текущую воспалительную реакцию, нарушение целостности ГЭБ в биологических жидкостях больных РС. В ряде исследований было отмечено повышение провоспалительных цитокинов TNF-α, IFN-γ, IL-6, IL-23, IL-2, IL-1β, IL-17, CXCL12, CXCL13, IP-10,CCL-5 и др., молекул адгезии sICAM, sVCAM, VLA-4, LFA-1 и др., а также матриксных металлопротеиназ ММР2, ММР8 и ММР9 во время обострения. В то же время выявлено снижение уровней других цитокинов, таких как IL-4, IL-10. Показана связь уровней указанных молекул как с клинической активностью заболевания, так и с количеством накапливающих контраст очагов при магнитно-резонансной томографии (МРТ). Однако в других работах существенного изменения концентрации цитокинов при РС отмечено не было. В связи с этим был сделан вывод, что изменение уровней провоспалительных цитокинов — неспецифическое явление, которое наблюдается как при РС, так и при других воспалительных заболеваниях нервной системы [5, 18, 32, 53, 54, 58, 59, 73, 75]. Достаточно много исследований было посвящено изучению изменения уровней провоспалительных цитокинов в ответ на лечение. При терапии препаратами интерферона-β происходило снижение уровней TNF-α, IFN-γ, VLA-4, повышение IL-4, IL-5, IL-10, CCR-7 [14, 48, 64, 65]. При лечении метилпреднизолоном — снижение уровней VLA-4, LFA-1, VCAM-1 и Е-селектина [16]. После терапии натализумабом снижались уровни IL-1β, IL-6, IL-8, CXCL9, CXCL10, CXCL11, CCL22 [49].
Об активации В-лимфоцитов у больных РС говорит характерное для них выявление интратекального синтеза иммуноглобулинов, которые являются основным компонентом, образующим олигоклональные полосы (ОСВ), выявляемые при иммуноэлектрофорезе (ИЭФ) ЦСЖ у 95-97% больных. При наличии ОСВ в ЦСЖ у пациентов с клинически изолированным синдромом (КИС) значительно увеличивается вероятность перехода в ремиттирующую форму РС, независимо от результатов МРТ. Кроме того, было показано, что у пациентов с РС без ОСВ в ЦСЖ течение заболевания более доброкачественное и часто характеризуется атипичной клинической картиной и данными МРТ [30]. В то же время стоит отметить, что ОСВ могут встречаться при других аутоиммунных, а также инфекционных и онкологических заболеваниях ЦНС [39]. Интересно, что ОСВ появляются в начале заболевания, и в дальнейшем, независимо от течения, активности процесса и лечения, их набор не меняется [39, 80]. Выявление IgM ОСВ, особенно направленных на липидные антигены, коррелирует с более агрессивным течением заболевания (высокая доля прогредиентных форм, ранняя инвалидизация) и худшим ответом на терапию иммуномодуляторами [8, 10, 45, 70, 72, 79].
Другим маркером активации В-лимфоцитов являются легкие каппа-цепи иммуноглобулинов (FLC-&kgr;), представляющие собой белки, продуцируемые В-клетками в процессе выработки антител.
В последующем изучению чувствительности и специфичности указанного маркера для диагностики и дифференциальной диагностики РС было посвящено достаточно много работ. Во многих исследованиях [22, 31, 56] было показано, что определение уровней FLC-&kgr;, а также определение отношения легких мономерных цепей &kgr; к легким димерным цепям λ по диагностической значимости не уступает ОСВ в ЦСЖ. Считается, что состав FLC в течение заболевания стабильный, кроме того, он не меняется в ходе лечения иммуномодуляторами [60, 61]. Наконец, стоит отметить, что в одном исследовании [61] также было показано прогностическое значение FLC-&kgr;: пациентам, имевшим высокую концентрацию маркера в ЦСЖ, раньше требовалась опора при ходьбе.
Изменения «профиля» антител при РС обнаруживаются как в крови, так и в ЦСЖ. При этом соотношение между «профилями» антител в ЦСЖ и сыворотке при РС бывает разным. У большей части пациентов с ремиттирующим течением профили антител указывают на синтез антител только в пределах ЦНС. У 10% пациентов с ремиттирующей или вторично-прогредиентной формой и практически у всех пациентов с первично-прогредиентной часть ОСВ обнаруживается только в ЦСЖ, однако есть полосы, которые встречаются и в ЦСЖ, и в сыворотке крови, что указывает на повреждение ГЭБ [72].
Мишени антител при РС неизвестны. Основные белки, липиды и другие соединения-кандидаты приведены в табл. 1
.
Однако ни в одном исследовании не было выявлено антител, соответствующих основной полосе, получаемой при электрофорезе. Среди антител, составляющих ОСВ, присутствуют иммуноглобулины классов G и M. IgM имеют особое значение при РС. Интратекальный синтез IgM представляет собой не первичный иммунный ответ, а постоянный. Как правило, он возникает в результате активации одного из подтипов В-клеток — CD5+, синтезирующих так называемые естественные антитела, чаще всего IgM-класса, направленные против филогенетически устойчивых структур [9], в первую очередь липидных антигенов. Значение липидных антигенов было показано при ряде других аутоиммунных заболеваний, таких как синдром Гийена-Барре, системная красная волчанка, синдром Шегрена и др. У больных РС чаще, чем у здоровых, встречаются антитела к фосфолипидам, таким как кардиолипин, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и др. [7, 26, 63, 68, 71, 78]; цереброзидам и сульфатидам [28, 34, 47]; ганглиозидам, таким как GM1 [1, 4, 76, 81], асиало-GM1 [1], GM4 [34], GD1a [1, 47]. Однако на настоящий момент не выявлено «профиля» антител к липидам, характерного для той или иной формы РС.
В то же время было отмечено, что антитела к сульфатидам чаще встречаются при вторично-прогредиентном течении [28], а IgG к GD1a — при первично-прогредиентном [1]. Кроме того, некоторые антитела к липидам могут иметь прогностическое значение. Так, выявление антител к галактоцереброзиду у пациентов с КИС является предиктором его перехода в РС с ремиттирующим течением [50]. Обнаружение антител к кардиолипину было связано с проявлением заболевания в виде медленно прогрессирующей миелопатии или нейропатии зрительного нерва [33]. Была выявлена корреляция повышения антител к GM3 с аксональным повреждением и изменением инвалидности в сторону утяжеления при прогредиентных формах РС [62]. Наконец, повышение титров антител к GM1 и фосфолипидам было связано с активностью заболевания, появлением очагов, накапливающих контраст при МРТ [7, 81].
В связи с тем, что в работах на животных моделях многие белки миелина вызывали аутоиммунный аллергический энцефалит (ЕАЕ) [64], было выдвинуто предположение, что они могут быть потенциальными биомаркерами при РС. Было проведено много исследований, посвященных изучению антител к белкам миелина или отдельным их эпитопам. Результаты часто оказывались противоречивыми, однако было показано, что наиболее перспективными биохимическими маркерами среди белков миелина являются MOG (олигодендроцитарный белок миелина) и МВР (основной белок миелина), однако также проводились исследования, посвященные OSP (специфический олигодендроцитарный белок), MAG и др. Антитела к этим компонентам могли выявляться чаще у пациентов с РС, но не имели существенного прогностического значения [3, 12]. На достаточно крупных выборках больных с КИС было продемонстрировано, что выявление антител к MOG и МВР не связано с более высокой частотой перехода заболевания в РС [37]. Титры антител к MOG и МВР в сыворотке и ЦСЖ у пациентов с РС были, как правило, выше, чем у группы контроля, причем более высокими были уровни MOG, в некоторых исследованиях была показана связь с активностью заболевания или более тяжелым течением (при первично-прогредиентном и вторично-прогредиентном РС) [15, 21, 35]. Повышение IgA-титров к МВР и MOG было связано с прогредиентным течением. Поскольку данный вид иммуноглобулинов не может инициировать воспалительную реакцию, считается, что их эффект обусловлен ингибированием ремиелинизации [15].
В связи с предположением, что одним из этиологических факторов при РС являются различные инфекционные агенты, проведено много исследований, направленных на выявление инфекционных маркеров, в том числе антител к вирусным и бактериальным антигенам и определение их диагностического и прогностического значения. Наибольшее число работ посвящено вирусу Эпштейна-Барр (ВЭБ). При РС отмечена более высокая доля серопозитивности к ВЭБ (99% против 90-95% в общей популяции), кроме того, была показана связь РС с инфекционным мононуклеозом [57]. Во многих исследованиях выявлено повышение ассоциированного с латентным течением инфекции ядерного антигена EBNA-1 и 2 в сыворотке крови и ЦСЖ пациентов с РС, в том числе до дебюта заболевания, отмечена связь с активностью заболевания и неблагоприятным прогнозом [2, 13, 17]. Однако подобная ассоциация не была подтверждена другими исследователями [29]. Поэтому на сегодняшний день диагностическое и прогностическое значение определения антител к EBNA при РС остается предметом дискуссий. Еще более противоречивы данные относительно других инфекционных агентов, таких как вирусы кори, ветрянки, краснухи, простого герпеса, цитомегаловируса, HHV-6, хламидии, микоплазмы, стрептококков.
Важным звеном в патогенезе РС является распространение активности процесса на окружающие ткани. Астроглия является максимально метаболически активным компонентом нервной системы, ее изменения при воспалительных заболеваниях, несомненно, более выражены, чем при прочих патологиях ЦНС [82].
Глиальный кислый протеин (GFAP) — большой структурный белок промежуточных филаментов астроцитов. Увеличение его концентрации связано с высокой активностью астроглии, что чаще всего сопровождает воспалительный процесс в ЦНС, сопровождающейся астроцитозом. Показано, что в острый период заболевания концентрация GFAP в ЦСЖ повышается при обширном поражении, какое бывает при оптикомиелите, и является неблагоприятным прогностическим маркером [74]. Среди пациентов с РС увеличение GFAP в ЦСЖ выявлено у больных вторично-прогредиентным РС и редко с ремитирующим РС, положительно коррелирует с выраженностью неврологического дефицита [25, 43, 44, 55].
S100 — кислый кальций-связывающий протеин, экспрессируется преимущественно астроглией, является маркером острого повреждения ЦНС, его повышение выявлялось в острый период инсульта и при черепно-мозговой травме [20, 52]. Данные же по изменению уровня данного пептида у больных РС в период обострения недостаточно убедительны [38, 55].
Наконец, одним из важнейших повреждающих факторов при РС, как и при любом воспалении, является увеличение экспрессии мРНК NO-синтазы в астроцитах, клетках микроглиально-макрофагального ряда, эндотелиальных клетках, причем, как правило, подобные изменения характерны для активных очагов, тогда как в старых очагах и очагах у пациентов с вторично-прогредиентным РС подобной активности не наблюдается [41]. Взаимодействие NO и продуктов его метаболизма с белками приводит к образованию нитрованных аминокислотных остатков, S-нитрозотиолов (RSNOs), N-нитрозаминов (RNNOs), нитрозогемоглобина.
В большинстве исследований показано увеличение уровня нитритов в биологических жидкостях по сравнению с группой контроля: уровень нитритов выше при обострении, зависит от типа течения РС. Пероксинитрит и активные формы кислорода (АФК) приводят к повреждению митохондрий, которое лежит в основе одного из возможных механизмов нейродегенерации при РС.
Маркеры нейродегенерации.
Нейродегенерация до недавнего времени рассматривалась как причина стойких симптомов при прогредиентном течении РС. Однако, благодаря расширению возможностей биохимических и нейровизуализационных методов, было выявлено, что нейродегенерация имеет место уже на самых ранних этапах заболевания. При патоморфологических исследованиях было установлено, что потеря аксонов при РС происходит не только в очагах, но и в окружающем белом веществе, причем не было выявлено корреляции между распространенностью очагов и степенью аксонального повреждения. Методом МР-спектроскопии in vivo было обнаружено снижение количества N-ацетиласпартата в неизмененном на Т2 белом веществе, что подтверждает деструкцию аксонов. Таким образом, можно предположить, что потеря аксонов в белом веществе может происходить по двум механизмам. С одной стороны, повреждение аксонов может протекать по типу дегенерации в очагах вследствие периодически возникающего воспаления и демиелинизации. С другой стороны, повреждение аксонов может протекать по типу диффузной аксонопатии, не коррелирующей с демиелинизацией, что выражается в постоянном нарастании неврологического дефицита, чаще при прогрессирующем течении РС. Согласно гистохимическим исследованиям, в бляшках и в области диффузно-измененного белого вещества происходят идентичные изменения аксонов, представленные увеличением степени фосфорилирования нейрофиламентов и изменением их конформации. Вероятно, оба варианта аксонопатии могут в разной степени присутствовать у разных пациентов и в различных проводящих путях ЦНС, что может обусловливать значительную гетерогенность в течении болезни.
Существует целый ряд исследований, направленных на изучение изменений в сером веществе головного мозга при РС методами МРТ, была показана значимая корреляция степени повреждения серого вещества с баллом EDSS уже на ранних стадиях заболевания [61]. В ходе клинических наблюдений отмечено, что возникающий у больных когнитивный дефицит, как правило, длительно не превышает степени умеренного и не регрессирует в ходе лечения. При нейровизуализационном исследовании больных с когнитивным дефицитом показано значимое снижение объема серого вещества неокортекса. Таким образом, нейродегенеративные изменения происходят и в коре головного мозга больных РС.
Высокоспецифичными маркерами разрушения аксона являются субъединицы нейрофиламентов. Данные гетерополимерные белки состоят из трех пептидов, называемых легкой, средней и тяжелой цепями (NfL, NfM и NfH, соответственно). В предыдущих работах были получены разрозненные сведения о содержании NfL и NfH в ЦСЖ и крови больных РС: концентрация NfL в ЦСЖ выше у больных РС с ремиттирующим течением заболевания в период обострения в сравнении с периодом ремиссии и пациентами с первично-прогредиентным РС. Максимальная концентрация NfL была выявлена на 3-й неделе от начала обострения. Терапия натализумабом приводила к значительному снижению интратекального уровня NfL [25]. Антитела к NfL чаще обнаруживаются у больных с первично-прогредиентным РС [44]. Также было показано, что уровень NfL в ЦСЖ выше в период обострения у больных с ремиттирующим течением заболевания, чем при остальных вариантах [44]; обнаружена положительная корреляция уровня NfL с когнитивными изменениями у пациентов с КИС, показано наличие антител к NfL [19].
Другим компонентом цитоскелета являются микротрубочки, состоящие из α- и β-тубулиновых субъединиц. С микротрубочками ассоциированы tau-протеин и микрофиламенты, в том числе актин. Уровень тубулина и актина в ЦСЖ выше у пациентов с прогредиентными формами заболевания в сравнении с ремиттирующим РС и коррелирует с оценкой по шкале EDSS [66]. Таким образом, актин и тубулин являются маркерами прогрессирования заболевания. Tau-протеин выполняет роль стабилизатора структуры и организации микротрубочек, его повышение в ЦСЖ ранее было описано при болезни Альцгеймера. Данный протеин локализован преимущественно в нейронах и клетках глии. Об ассоциации tau-протеина со стадией РС получены противоречивые данные [69]. Повышение tau-протеина и NfH может быть обнаружено уже в дебюте заболевания, уровень NfH является предиктором перехода демиелинизирующего заболевания в достоверный РС [11].
Для нейродегенеративного процесса характерно изменение активности ферментов и, как следствие, формирование β-амилоида из мембранного белка предшественника амилоида. При РС растет синтез в нейронах белка предшественника амилоида, увеличивается мобильность мембранной секретазы, участвующей в формировании нейротоксичного амилоида 1-42 [27, 40] и β-амилоида 1-40, чаще ассоциированного с микроангиопатией [23]. Данные по уровню пептидов β-амилоида в ЦСЖ больных РС немногочисленны и противоречивы по результатам: не было обнаружено разницы между больными и контрольной группой [67, 77].
Амилоид 1-42 является внеклеточным нерастворимым белком, чем объясняется его снижение в ЦСЖ пациентов с болезнью Альцгеймера. Его снижение также выявлено у пациентов с РС, показана корреляция с когнитивным дефицитом и снижением пластичности, индуцируемой транскраниальной магнитной стимуляцией [51]. Пептиды амилоида также могут являться новыми антигенами, сформированными в результате патологического ферментативного процесса. Была показана нейропротективная роль β-амилоида 1-40 и 1-42 на примере экспериментального аутоиммунного энцефалита [24].
Белок 14-3-3 — растворимый белок цитоплазмы, содержащийся в большинстве тканей млекопитающих, участвующий в регуляции процессов клеточного цикла, апоптоза и сигнальной трансдукции. Белок 14-3-3 является маркером болезни Крейтцфельдта-Якоба, показано повышение его концентрации у пациентов с синдромом Гийена-Барре. При ремиттирующем РС выявлено увеличение белка 14-3-3 в ЦСЖ, по данным протеомных методов исследования (2D-электрофореза и MALDI-MS), белок 14-3-3 является маркером фазы обострения при РС [69].
Цель настоящего исследования — исследование тяжелых цепей нейрофиламентов и антител к сульфатидам при РС.
Материал и методы
В исследование были включены 3 группы больных с РС, а также соответствующие им по полу и возрасту здоровые.
В группу изучения иммуноглобулинов класса IgG к сульфатиду в сыворотке вошел 51 пациент с РС, 15 с вторично-прогредиентным РС, 36 с ремиттирующим РС и 22 соответствующих по полу и возрасту здоровых. Характеристика групп представлена в табл. 2
.
Степень инвалидизации по шкале EDSS составляла 3,2 (2; 7) в группе с ремиттирующим РС и в группе с вторично-прогредиентным РС — 6,1 (4,5; 8). В группе вторично-прогредиентного РС средняя длительность заболевания до его наступления составила 97 (24-220) мес.
Исследование NfH в сыворотке было проведено у 25 пациентов с ремиттирующим РС, у 21 — с вторично-прогредиентным РС, группы сравнения — 13 пациентов с боковым амиотрофическим склерозом. В контрольную группу вошли 13 пациентов без патологии со стороны нервной системы, которым проводилось хирургическое вмешательство с применением спинальной анестезии. Характеристики групп пациентов представлены в табл. 3
.
В группе ремиттирующего РС степень инвалидизации по шкале EDSS составила 4 [2,5; 4,5], в группе вторично-прогредиентного РС длительность заболевания составила 40,5 мес [36; 90], степень инвалидизации по шкале EDSS 6,5 [6,5; 6,5].
Забор крови проводился в утренние часы. Сразу после забора проводилось центрифугирование (2000 об/мин, 15 мин). Полученные сыворотки хранились при температуре -80°С до момента использования.
Определение антител к сульфатиду проводилось с помощью ELISA (human sulfatide ELISA kit, Cusabio), согласно инструкции производителя. Уровень NfH и амилоида 1-42 определялся в сыворотке крови пациентов с вторично-прогредиентным РС, сыворотке и ЦСЖ контрольной группы, пациентов с ремиттирующим РС и пациентов с боковым амиотрофическим склерозом. Определение NfH проводилось с помощью ELISA (ELISA kit for the Sensitive Detection of the Heavily Phosphorylated, Axonal Variants of the Major Neurofilament subunit NF-H, EnCor Biotechnology Inc.), амилоида 1-42 — с помощью ELISA (ELISA kit for Human Aβ42, Invitrogen). Анализ выполнялся строго согласно инструкции производителей.
Результаты
В предшествующих работах выявление у больных антител к галактоцереброзидам было предвестником перехода из КИС в РС, его сульфатиды чаще обнаруживались у пациентов с вторично-прогредиентным РС [28, 34]. Эти данные могут указывать на неблагоприятное прогностическое значение при выявлении подобных антител в биологических жидкостях больных, в связи с чем исследовали антитела к сульфатиду в сыворотке больных с РС.
Антитела к сульфатиду были выявлены у 8 (36%) здоровых и 24 (47%) пациентов с РС. При этом они определялись с одинаковой частотой при ремиттирующем (47%) и вторично-прогредиентном (47%) течении РС, но не были обнаружены ни у одного больного во время первого обострения заболевания. Выявление антител к сульфатидам было связано с более ранним наступлением вторично-прогредиентного течения (40 мес у положительных по IgG к сульфатиду против 115 мес у отрицательных).
Учитывая данные о значении нейродегенерации на всех этапах развития заболевания, вклад дегенеративных процессов в формирование стойкого неврологического дефицита, нарастание визуализационных признаков дегенерации при длительном течении заболевания, нами было проведено исследование концентрации NfH и амилоида 1-42 в сыворотке и ЦСЖ пациентов с ремиттирующим РС и боковым амиотрофическим склерозом (группа сравнения), сыворотке крови пациентов с вторично-прогредиентным РС, сыворотке и ЦСЖ контрольной группы.
При сравнении уровня pNFh в ЦСЖ исследуемые группы достоверно отличались между собой. Было выявлено повышение уровня нейрофиламентов в ЦСЖ больных с ремиттирующим РС (p
=0,015) и у больных боковым амиотрофическим склерозом (
p
=0,005) при сравнении с контрольной группой, при этом между группами больных ремиттирующим РС и боковым амиотрофическим склерозом не было статистическим достоверных различий. Для получения данных, сопоставимых с результатами ранее проведенных в этой области исследований [19, 25, 44], наши результаты были представлены в процентной доле от контрольных образцов. При сравнении уровня pNFh в сыворотке отличия между теми же группами и группой вторично-прогредиентного РС найдено не было.
При исследовании уровня β-амилоида 1-42 в ЦСЖ больных ремиттирующим РС в момент обострения (14 пациентов) и период ремиссии (5 пациентов) выявлено, что в период обострения концентрация амилоида достоверно возрастает в 2 раза — 157,5 [97,8; 199,7] и 71,8 [19,7; 86,3] пг/мл соответственно (p
=0,02).
Полученные данные позволяют предполагать постепенное развитие процесса нейродегенерации в ходе формирования свойственного РС патологического процесса вопреки представлению о ней, как об отдаленном процессе и следствии демиелинизации.
Лечение
Рассеянный склероз
― это хроническое заболевание, полное излечение которого невозможно. Все мероприятия направлены на замедление развития болезни, купирование симптомов и уменьшение частоты обострений. Не существует единого плана терапии, каждый пациент требует индивидуального подхода.
Ремиттирующий характер болезни, характеризующийся периодами ослабления и усиления симптомов, нуждается в симптоматическом лечении, профилактики обострений, торможении перехода в активную стадию. При вторичной, прогрессирующей форме основная цель терапии ― замедление развития склероза. Врач должен понимать в какой стадии находится больной. чтобы корректировать его состояние. Для этого пациент регулярно сдает назначаемые анализы, проходит исследования, чаще это МРТ и иммунологический анализ крови.
Не стоит забывать, что помимо физиологических симптомов, больной проходит психологическое изменение личности. Может впадать в депрессию, испытывать хроническую усталость, тревожно-депрессивные расстройства. При рассеянном склерозе отмечается широкий спектр психических нарушений: от личностных расстройств до измененных психотических состояний. Это также требует внимание со стороны врача.
Основные задачи лечения:
- Предотвратить обострения.
- Затормозить течение болезни.
- Предотвратить развитие новых симптомов, уменьшить их выраженность.
- Облегчить течение текущей симптоматики, помочь пациенту вести привычный ему образ жизни.
Важную роль играет социальная адаптация больного и вовремя оказанная психологическая помощь. Несмотря на то что диагноз рассеянный склероз ставить врач-невролог, в лечение участвует ряд специалистов: иммунолог, электрофизиолог, нейроофтальмолог, нейропсихолог, уролог.
Преимущества сдачи анализов в АО «СЗЦДМ»
- Все виды лабораторных анализов, в том числе и для диагностирования РС.
- Точность данных благодаря современному оборудованию и квалифицированным сотрудникам.
- Быстрая готовность результатов, несколько вариантов получения.
- Доброжелательные сотрудники, конфиденциальность, отсутствие очередей.
- Удобное расположение терминалов.
Лаборатории Северо-западного центра доказательной медицины представлены в Пскове, Великом Новгороде, Калининграде, в Санкт-Петербурге и других городах Ленинградской области.
Выводы:
- Рассеянный склероз является патологией, затрагивающей нервную систему. В основе –повреждение оболочек нервных волокон и нарушению проведения импульсов.
- Заболевание не является наследственным, но при определённых сочетаниях генов – риск выше.
- Спровоцировать развитие заболевания способны повышенный радиационный фон, интоксикация, стресс, перенесенные травмы.
- При появлении первых симптомов рассеянного склероза важно своевременно обратиться к врачу. Лучше пусть подтвердится, что это просто перенапряжение, усталость, а не оказаться в ситуации – когда один на один – острая фаза заболевания.
- При рассеянном склерозе существенно ухудшается качество жизни. Прежде всего, потому что снижается двигательная активность. Но, если раньше рассеянный склероз сразу был приговором, теперь есть методики, препараты, посредством которых удаётся не только купировать симптомы заболевания, но и притормозить развитие болезни. Врачи научились держать болезнь под контролем. При своевременной диагностике и лечении патология перестала негативно влиять на продолжительность жизни.
- При диагностике важна роль принадлежит КТ, лабораторной диагностике. При уточнении диагноза существенное значение имеет, где находятся проблемные очаги: в головном или спинном мозге.
В 5-й больнице города лечение рассеянного склероза – один из главных профилей. База больницы располагает аппаратурой экспертного класса для диагностики этого заболевания. Доступны консультации опытных врачей-неврологов. К лечению подходят комплексно. Организуется медикаментозная терапия, массаж, лечебная физкультура, в том числе с велотренировками на специальных тренажёрах, сеансы гипобарической оксигинации.