Узнать больше о других заболеваниях на букву «Ю»: Ювенильный паркинсонизм; Юношеская абсанс-эпилепсия; Юношеская миоклоническая эпилепсия.
Не все заболевания можно полностью излечить. Речь идет, в первую очередь, о тех, которые возникают в силу генетической обусловленности. Особенно печально, когда речь идет о детских болезнях. Но медицина не стоит на месте, и предлагает варианты терапии, позволяющей поддерживать приемлемое качество жизни малыша. Такое редчайшее заболевание, как ювенильный паркинсонизм, сегодня хоть и не излечивается полностью, но успешно корректируется лечением врача.
Что собой представляет?
Если «классическая» болезнь Паркинсона может появиться по целому ряду причин, детский паркинсонизм всегда возникает из-за сбоев в генетике. Ученые выяснили, что оно поражает не только детей, но и лиц до 25 лет. Чаще всего оно атакует девочек и молодых девушек. При наличии нескольких заболевших в одной семье распространение болезни считается спорадическим.
Заявляет о себе заболевание, как правило, в конце первого десятилетия жизни, либо в начале второго. Более ранний возраст развития патологии крайне редок (менее 1 % от всех заболевших).
От «взрослого» варианта болезни ювенильный паркинсонизм отличается тем, что даже при долгой заболеваемости у больного сохраняется рассудок, интеллектуальные способности. Наблюдается полное отсутствие слабоумия или расстройств психического характера.
Встречаются случаи повышения сухожильного рефлекса или иной пирамидной симптоматики.
Медицинские интернет-конференции
Болезнью Паркинсона с ранним началом принято называть случаи первичного паркинсонизма, развившегося в возрасте до 45 лет. Среди вышеуказанных больных отдельно рассматривают подгруппу с юношеским (ювенильным) паркинсонизмом. К ним относятся лица с дебютом первичного паркинсонизма в возрасте 20-25 лет. Ранний паркинсонизм является достаточно гетерогенным заболеванием. Благодаря развитию молекулярной генетики установлено, что основную роль в развитии раннего начала болезни Паркинсона играют генетические факторы.
Улучшение качества диагностики, применение современнейших методов нейровизуализации с целью выявления патологических изменений в базальных ганглиях позволило выявлять болезнь на ранних стадиях, вплоть до «предболезни» и стандартизировать диагностику данного заболевания.
Представлен клинический случай юношеского (ювенильного) паркинсонизма с началом в возрасте 17 лет
В неврологическое отделение МУЗ ГКБ №9 поступил больной Ф, 32 года. На момент поступления предъявлял жалобы на скованность во всем теле, замедленность движений, нарушение походки, тремор рук, больше выраженной справа, ухудшение памяти.
Из анамнеза заболевания известно, что больным себя считает с 1997 года, когда впервые стал замечать скованность движений и дрожание рук, больше выраженное с правой стороны, обратил внимание, что постепенно изменялась походка: трудно было начать движение, руки прижаты к туловищу, голова наклонена вперед. В 2001 году находился на стационарном лечении в нейрогенетическом отделении НИИ Неврологии г. Москва, где выставлен диагноз: Ювенильный паркинсонизм, назначено лечение мадопар 250 мг/сутки, циклодол по 1/2 таб 3 раза в день. На этом фоне скованность и замедленность движений уменьшились. Однако, через некоторое время появились непроизвольные движения в виде подёргиваний плечами. Принимал проноран по 1 таб. 3 раза в день, без положительного эффекта. В августе 2011 года находился на стационарном лечении в неврологическом отделении МУЗ ГКБ №9 с диагнозом: ювенильный паркинсонизм, приемущественно ригидная форма, 3 ст тяжести по Хен-Яру, прогрессирующее течение, с выраженной постуральной неустойчивостью и нарушением ходьбы, феноменом включения-выключения с моторным флюктуациями и дискинезиями Было скорректировано лечение в виде добавления Мидантана по 1,5 таб два раза в день, продолжения приема Мадопара по 1/4 т 5 раз в день, на фоне чего отмечалось улучшение состояния в виде прекращения подергивания в плечах. При выписке было рекомендовано продолжить курс приема назначенной терапии
Неврологический статус: ясное, контактен. Больной адекватен, ориентирован в собственной личности сознание и окружающей обстановке, месте и времени. Обоняние сохранено. Зрачки S=D, реакция на свет живая, глазные щели S=D, движение глазных яблок в полном объеме. Конвергенция, аккомодация сохранены. Горизонтальный среднеразмашистый нистагм при взгляде влево.Чувствительность на лице сохранена, корнеальные, коньюктивальные рефлексы сохранены. Лицо относительно симметричное. Слух сохранен. Глотание затруднено, преимущественно твёрдой пищи, рефлекс с мягкого неба и задней стенки глотки сохранен. Язык по средней линии Достоверных расстройств чувствительности не выявлено. Активные движения в полном объеме, мышечная сила 5 баллов, мышечный тонус изменен по типу «зубчатого колеса», больше выраженного в правой руке. Тремор покоя рук, больше с правой стороны, усиливающийся при волнении. Мышечных атрофий нет. Сухожильные и периостальные рефлексы S=D, снижены. Брюшные S=D. Патологических рефлексов нет. Гипокинезия в виде замедленности походки, гипомимия, ахейрокинез. В позе Ромберга не устойчив, координаторные пробы выполняет неуверенно. Скованность походки. Легкие когнитивные нарушения. Расстройств мочеиспускания нет. Менингеальных знаков не выявлено.
За время нахождения в стационаре пациент продолжил прием Мидантана по 1,5 таблетки 3 раза в день, Мадопара по ½ таблетки 5 раз в день, проведена антиоксидантная терапия (Мексидол).
На фоне проводимого лечения отмечалось улучшения состояния в виде уменьшения жалоб на скованность и тремор в руках
Вывод: Необходимо принимать во внимание тот факт, что одной из особенностей ювенильного паркинсонизма является раннее появление дискинезий, связанных с приемом леводопы даже в низких дозах. В связи с чем особое внимание должно быть уделено назначаемой терапии и коррекции дозировки принимаемых противопаркинсонических препаратов.
Причины
Ювенильный паркинсонизм всегда генетически обусловлен. Возникает сбой в работе дофаминергических нейронов, которые должны нормально высвобождать дофамин. Но из-за «поломки» в генах, такой процесс затрудняется или полностью останавливается. Это является причиной возникновения уже внешней двигательной дисфункции. При этом нужно учитывать, что такая генетическая погрешность наследуется аутосомно-рецессивным путем.
Бывает так, что оба родителя здоровы, но поврежденный ген у них в цепочке присутствует. То есть они передают рожденному малышу возможность заболевания. В таком случае в дальнейшем симптомы паркинсонизма обнаруживаются не более чем у 25% подросших детей. Если в геноме только одного родителя есть дефект, то процент передачи заболевания потомству практически сведен к нулю.
Классификация
Ювенильный паркинсонизм в большинстве случаев сопровождается тремя проявлениями: гипокинезией, тремором и ригидностью мышц. В зависимости от того, как эта триада скомпонована, можно выделить следующие виды болезни:
- дрожательная;
- дрожательно-ригидная;
- ригидно-дрожательная;
- акинетико-ригидная;
- смешанная.
В первом случае присутствует мелко амплитудное дрожание головы, челюсти и языка. Тремор присутствует и в конечностях. Дрожание не останавливается ни в покое, ни в движении. При этом из-за стресса или небольшого эмоционального всплеска скорость дрожания значительно увеличивается. Также сохраняется нормальная двигательная активность, а мышечный тонус находится в нормальном пределе.
При дрожательно-ригидном паркинсонизме заболевание заявляет о себе возникновением тремора. Со временем картина дополняется расстройством мышечного тонуса, может возникнуть гипертонус. Брадикинезия отсутствует, либо выражена нечетко.
Ригидно-дрожательный «вариант» заболевания всегда начинается с резкого повышения мышечного тонуса в верхних и нижних конечностях. Лишь потом наблюдается тремор. Из-за гипертонуса конечности принимают вынужденное положение (флексорное), затем выражается и гипокинезия.
При акинетико-ригидном паркинсонизме наблюдается гипокинезия с повышением тонуса мышц. Дрожание отсутствует, как и непроизвольные движения.
Если присутствуют черты каждого из перечисленных видов заболевания одновременно, речь идет о смешанном ювенильном паркинсонизме.
Болезнь Паркинсона (паркинсонизм)
Определение.
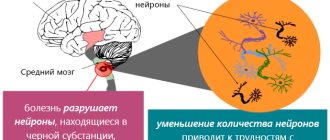
Болезнь Паркинсона (БП) – хроническое заболевание головного мозга. Основные проявления (симптомы) заболевания связаны с уменьшением количества нервных клеток, вырабатывающих вещество дофамин. Дофамин участвует в передаче нервны импульсов для обеспечения нормальной двигательной активности. Недостаток дофамина в отделах мозга, участвующих в регуляции движений, является основной причиной замедленности и ограничения выполнения привычных движений.
Болезнь Паркинсона относится к первичному или идиопатическому паркинсонизму, который составляет 80-90 % от общего числа больных, имеющих синдром паркинсонизма. Вторичный паркинсонизм встречается значительно реже и составляет 10-15 %, например: сосудистый, лекарственный, токсический, постэнцефалитический, посттравматический, паркинсонизм при опухолях и гидроцефалии, на фоне метаболической энцефалопатии. Паркинсонизм в рамках нейродегенеративных заболеваний составляет 8-12 % (атипичный паркинсонизм, «паркинсонизм-плюс» — прогрессирующий надъядерный паралич, мультисистемная атрофия, болезнь диффузных телец Леви, кортикобазальная дегенерация).
Историческая справка.
Болезнь Паркинсона была описана около 200 лет назад (1817 год) английским врачом Джеймсом Паркинсоном в своем знаменитом «Эссе о дрожательном параличе», в котором обобщил результаты наблюдений за шестью пациентами. С тех пор БП была детально изучена, конкретизированы все её симптомы, однако портрет заболевания, составленный Дж. Паркинсоном, остается по-прежнему точным и ёмким.
Эпидемиология.
БП по распространенности занимает 4 место после деменции, эпилепсии, цереброваскулярной патологии у пациентов старшей возрастной группы. Таким образом, около 1-2% людей старше 65 лет страдают БП. В зависимости от того, в каком возрасте выявляются первые признаки БП, выделяют следующие формы: ювенильная форма – начало до 20 лет; раннее начало – до 40 лет; типичное начало – старше 60 лет.
Этиология.
Уже в течение многих лет обсуждается возможность генетической предрасположенности, но генетический фактор не всегда играет главную роль, т.к. на долю семейных форм паркинсонизма приходится всего около 5-10 %, в то время как спорадический паркинсонизм встречается в 80-90% случаев. Генетические факторы наибольшее значение играют при раннем начале заболевания, а в более поздней возрастной группе большее значение приобретают другие факторы, такие как инволюционные изменения в головном мозге и факторы внешней среды или токсические факторы.
Патогенез.
Патогенетическую основу БП составляет резкое уменьшение количества дофамина в черной субстанции и полосатом теле. Синтез дофамина происходит в телах дофаминергических нейронов, располагающихся в компактной зоне черной субстанции. Здесь он образуется в виде небольших пузырьков – гранул, которые по аксонам нигростиарных нейронов транспортируются к окончаниям аксонов в хвостатом ядре и скапливаются перед пресинаптической мембраной. Под влиянием приходящих нервных импульсов происходит выход квантов медиатора в синаптическую щель, который оказывает воздействие на дофаминергические рецепторы постсинаптической мембраны и вызывает её деполяризацию. Предполагается, что около 80% дофамина поглощается обратно в пресинаптическое пространство или инактивируется при помощи фермента КОМТ (катехол –О-метилтрансферазы) или МАО-В (моноаминооксидазы типа В). Наиболее вероятными механизмами повреждения нейронов при БП являются: окисдативный стресс; повышенное содержание ионов железа; выявлены специфичные ферментативные дефекты комплекса I дыхательной цепи в митохондриях черной субстанции; индукция процессов апоптоза, вследствие эксайтотоксического влияния глутамата и аспартата. Но реальный пусковой фактор этих процессов до конца не определен. Помимо дофаминергических нейронов черной субстанции при болезни Паркинсона дегенерации подвергаются и другие группы нейронов, в том числе нейроны дорсального ядра блуждающего нерва, нейроны обонятельной луковицы, норадренергические нейроны голубого пятна, серотонинергические нейроны ядер шва, холинергические нейроны ядра Мейнерта, а также нейроны коры больших полушарий и некоторые вегетативные сплетения. В силу этого, помимо дефицита дофамина, возникает дисфункция серотонинергических, норадренергических и холинергических систем. С поражением экстранигральных структур связаны такие проявления болезни, как аносмия, вегетативная недостаточность, депрессия, деменция.
Клинические проявления.
Болезнь Паркинсона начинается постепенно, медленно прогрессирует. От момента появления первых неспецифических (домоторных проявлений таких как: констипация, нарушения сна, потеря обоняния, депрессия, расстройство поведения в фазе быстрого сна) до основных двигательных симптомов проходит 10-15 лет. Первые двигательные симптомы БП появляются когда гибнет более 50 % нейронов черной субстанции, а снижение уровня дофамина составляет до 80 %.
| Премоторная симптоматика | Связь со структурами головного мозга | Стадия по Брааку |
| Констипация (запор) | Дорсальное ядро вагуса; нейроны брюшного сплетения. | 1 |
| Нарушение сна или потеря обоняния | Обонятельная луковица; переднее ольфакторное ядро | 1 |
| Депрессия | Голубоватое место, ядра шва. | 2 |
| Расстройство поведения в фазе быстрого сна (REM) | Дорзальная часть среднего мозга и мост; голубоватое место. | 2 |
| Акинезия | Черное вещество. | 3 |
Основными в клинической картине являются двигательные симптомы:
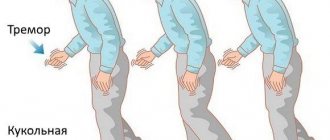
- Снижение двигательной активности (гипокинезия). Основные проявления гипокинезии – затруднения при выполнении «мелких» движений (застегивание пуговиц, завязывание шнурков, нарезка продуктов, чистка зубов); шаркающая походка, затруднения при поворотах в постели, вставании со стула; изменение речи (снижение модуляций и эмоциональной окраски голоса, который становится маловыразительным, монотонным, затухающим); изменение почерка – микрография (почерк становится мелким, буквы связаны, размер их уменьшается к концу предложения); амимия – маскообразное лицо, бедная мимика; «поза прсителя» — шея, туловище и конечности в суставах несколько согнуты, прижаты к туловищу; пропульсия, ретропульсия, латеропульсия – непреодолимое ускорение движения больного вперед, назад, в сторону при ходьбе или после легкого толчка, невозможность остановить начатое движение или изменить направление; ахейрокинез – отсутствие содружественных движений рук при ходьбе; парадоксальные кинезии – у больных, едва передвигающихся с посторонней помощью и лежачих — возможность быстрых движений (бегать, прыгать, вальсировать и т.д.) под воздействием эмоциональных факторов.
- Повышение мышечного тонуса (ригидность) – ощущается как «скованность», напряженность мышц (феномен «восковой куклы», феномен «зубчатого колеса» — возникают когда на ригидность накладывается тремор)
- 3. Тремор покоя (у 80% пациентов) по типу «скатывания пилюль», «счета монет» — ритмичное дрожание дистальных отделов рук, особенно пальцев, малой амплитуды и частоты, прекращающийся во время целенаправленных движений и исчезающий во время сна.
- Нарушение равновесия (постуральная неустойчивость)
БП проявляется клинически не только двигательными нарушениями, но и имеет целый спектр недвигательных проявлений, которые встречаются у всех пациентов независимо от возраста дебюта заболевания и стадии болезни:
- Когнитивные нарушения
- Аффективные нарушения (депрессия, тревога, апатия, обсессивно-компульсивный синдром)
- Поведенческие нарушения (пристрастие к азартным играм, компульсивный шоппинг, гиперсексуальность, булимия)
- Психические нарушения (галлюцинации, бред, делирий)
- Нарушения сна (инсомния, гиперсомния, парасомния)
Вегетативные нарушения при БП:
- Ортостатическая гипотензия
- Сальность покровов головы, повышенное образование ушной серы.
- Сиалорея
- Потливость
- Дистальный гипергидроз
- Нарушение мочеиспускания
- Запоры
- Вагоинсулярные кризы
Классификация.
Классификация болезни Паркинсона проводится по форме, стадии и темпу прогрессирования заболевания. Формы заболевания. В зависимости от преобладания в клинической картине того или иного симптома выделяют следующие формы: смешанную (акинетико-ригидно-дрожательную), акинетико-ригидную и дрожательную. Смешанная форма выявляется в 60–70 % случаев болезни Паркинсона, акинетико-ригидная — в 15–20 % случаев болезни Паркинсона, дрожательная — в 5–10 % случаев болезни Паркинсона. По мере прогрессирования заболевания его форма может меняться.
Стадии заболевания. Общепризнанной является классификация стадий болезни Паркинсона, предложенная Hoehn и Yarh (1967): 1 стадия – Гемипаркинсонизм (односторонние проявления) 1,5 стадия – односторонние проявления с вовлечением аксиальной мускулатуры. 2 стадия – Двусторонние нарушения без нарушения равновесия. 2,5 стадия – Двусторонние нарушения с начальными проявлениями постуральной неустойчивости, но с самостоятельным восстановлением равновесия при толчковой пробе. 3 стадия – Двусторонние нарушения с присоединением постуральных нарушений. 4 стадия – Выраженные нарушения, но может стоять и ходить без посторонней помощи 5 стадия – полная инвалидизация. Больной прикован к постели или к инвалидному креслу.
Темп прогрессирования.
Выделяют три варианта темпа прогрессирования болезни Паркинсона (при условии адекватного лечения):
- быстрый темп прогрессирования, при котором смена стадий заболевания (первая — вторая или вторая — третья) происходит в течение 2 или менее лет;
- умеренный темп прогрессирования, при котором смена стадий происходит более чем за 2 года, но не более чем за 5 лет;
- медленный темп прогрессирования со сменой стадий более чем через 5 лет.
Диагностика.
В настоящее время для клинической диагностики болезни Паркинсона чаще всего используют критерии банка головного мозга Общества болезни Паркинсона Великобритании (A. Hughes et al., 1992). Гипокинезия в сочетании не менее чем с одним из следующих симптомов:
- мышечная ригидность;
- тремор покоя с частотой 4-6 ГЦ;
- постуральная неустойчивость.
Критерии исключения болезни Паркинсона:
- повторные инсульты в анамнезе со ступенеобразным прогрессированием симптомов паркинсонизма;
- повторные черепно-мозговые травмы в анамнезе;
- энцефалит в анемнезе;
- окулогирные кризы;
- лечение нейролептиками на момент появления симптомов;
- семейный характер заболевания (более 1 родственника с аналогичным заболеванием);
- наличие длительной ремиссии;
- строго односторонняя симптоматика более 3 лет;
- паралич взора вниз;
- ранняя быстро прогрессирующая вегетативная недостаточность;
- мозжечковые знаки;
- рано развивающаяся деменция с нарушениями памяти, речи, праксиса;
- симптом Бабинского;
- наличие атрофии мозжечка или сообщающейся гидроцефалии на компьютерной томографии;
- отсутствие реакции на высокие дозы леводопы (при исключении мальабсорбции);
- контакт с токсическими веществами, вызывающими паркинсонизм.
Критерии, подтверждающие диагноз болезни Паркинсона (не менее 3):
- одностороннее начало;
- тремор покоя;
- прогрессирующее течение;
- сохранение асимметрии симптоматики с преобладанием на первоначально вовлеченной стороне;
- высокая эффективность препаратов леводопы (уменьшение симптомов на 70–100 %);
- выраженные хореиформные дискинезии, индуцированные леводопой;
- сохранение реакции на леводопу в течение 5 лет и более;
- продолжительность заболевания в течение 10 лет и более.
Дифференциальная диагностика болезни Паркинсона проводится со следующими заболеваниями: эссенциальный тремор, юношеский (ювенильный) паркинсонизм, лекарственный паркинсонизм, сосудистый паркинсонизм, прогрессирующий надъядерный паралич (синдром Стила — Ричардсона — Ольшевского), мультисистемная атрофия, болезнь диффузных систем Леви, гепатолентикулярная дегенерация.
Дополнительные методы исследования.
- Структурная нейровизуализация – КТ, МРТ – малоинформативны для диагностики БП и используются для исключения вторичного паркинсонизма.
- Функциональная нейровизуализация (ПЭТ с флюородопой, ОФЭКТ) возможность этих методов высока, т.к. позволяют выявить изменения дофаминового обмена за 4-6 лет до появления клинических симптомов, но в данный момент это является технически сложным и дорогим методом исследования, что не позволяет использовать его в рутинной практики для выявления БП.
- Транскраниальная сонография – выявляет повышенную гиперэхогенность черной субстанции, за счет повышенного содержания трехвалентного железа, которые выявляются у 80-90 % пациентов с БП.
- Обонятельные тесты (Пенсильванский тест) Обонятельная дисфункция это наиболее ранний домоторный признак БП. Наиболее часто используется это тест, если в клинике преобладает дрожание, проводя дифференциальную диагностику между эссенциальным тремором и БП, потому что только для идиопатического паркинсонизма будет характерно изменение обонятельных тестов.
Принципы лечения.
В лечении болезни Паркинсона можно выделить три основных направления:
- Нейропротекторная терапия, целью которой является замедлить или остановить дегенерацию нейронов головного мозга. В последние годы экспериментальные и клинические испытания прошли несколько десятков средств, потенциально способных влиять на различные стадии нейродегенеративного каскада гибели клеток (антиоксиданты, антагонисты глутамата, блокаторы кальциевых каналов, противовоспалительные средства, трофические факторы и т.д.), однако пока их эффективность доказать не удалось.
- симптоматическая терапия, позволяющая уменьшить основные симптомы заболевания за счет коррекции возникающего в мозге нейрохимического и нейрофизиологического дисбаланса;
- физическая и социально-психологическая реабилитация.
Медикаментозное лечение.
В настоящее время лечение проводят, ориентируясь главным образом на симптоматический эффект препаратов. На данный момент к числу противопаркинсонических средств, применяемых при болезни Паркинсона, относят 6 групп лекарственных средств:
- препараты, содержащие леводопу (предшественника дофамина) — обеспечивают повышение синтеза дофамина в мозге;
- агонисты дофаминовых рецепторов – стимуляция рецепторов чувствительных к дофамину;
- трициклические антидепрессанты – торможение процесса обратного поглащения (захвата) дофамина пресинаптическими структурами;
- препараты амантадина – стимуляция процесса выброса (высвобождения) дофамина из пресинаптической терминали;
- ингибиторы моноаминооксидазы типа В;
- ингибиторы катехол-О-метилтрансферазы – торможение катаболизма (распада) дофамина;
Поскольку механизм действия препаратов этих групп различен, при необходимости их можно сочетать в рамках комбинированной терапии.
Медикаментозная терапия пациентов с болезнью Паркинсона подбирается индивидуально для каждого клинического случая и зависит от ряда факторов, в том числе от выраженности функциональной недостаточности, формы заболевания, возраста больного, индивидуальной чувствительности к препаратам, фармакоэкономических соображений.
Задачей терапии является восстановление нарушенных двигательных функций при использовании минимальных эффективных доз препаратов. В течение первых месяцев болезни, когда проявления заболевания минимальны и не нарушают повседневной социальной или бытовой активности, лекарственная терапия может не назначаться. В начале лечения обычно прибегают к монотерапии, а в случае снижения ее эффективности при прогрессировании болезни — к комбинированной терапии.
Немедикаментозные методы лечения.
Лечение хронических заболеваний наряду с назначением лекарственных средств требует осуществления мер по социально-психологической поддержке больных. Образовательные программы должны предоставлять больным выборочную информацию о заболевании, необходимую для формирования у них ощущения контроля над болезнью. В комплекс лечения должны входить нейропсихологический тренинг, речевая терапия, лечебная гимнастика. Регулярные физические занятия, включающие аэробные упражнения, упражнения в изометрическом режиме, на растяжение и координацию, способны, не уменьшая паркинсонических симптомов, улучшить подвижность больных. Важное значение имеет полноценное питание, позволяющее предотвратить снижение веса и утрату мышечной массы. Для осуществления всего комплекса мер по медико-социальной реабилитации больных целесообразно создать специальную службу. Необходима подготовка специально обученных средних медработников, которые координировали бы работу социальных служб, обучали родственников приемам ухода, занимались образованием больных.
Нейрохирургическое лечение.
При неэффективности консервативной терапии, особенно когда выраженные дискинезии не позволяют назначать дозы препаратов леводопы, необходимые для коррекции симптомов болезни Паркинсона, ставится вопрос об оперативном лечении (паллидотомия, таламотомия, вживление внутримозговых стимуляторов в бледный шар, таламус, субталамическое ядро, внутримозговая трансплантация эмбриональной ткани надпочечника или черной субстанции).
Симптоматическая картина
Чаще всего заболевание ярко проявляется после 10 и до 25-летнего возраста. Развиваются симптомы двусторонне, что отличает ювенильный паркинсонизм от известной болезни Паркинсона. Появляется задержка или иной сбой в моторике, ухудшается жестикуляция. Может быть ослаблена мимика, в целом двигательная амплитуда при осуществлении бытовых действий и движений уменьшается.
Если раньше ребенок спокойно мог застегнуть пуговицу или зашнуровать ботинки, то после манифестации болезни эти действия вызывают большое затруднение.
В целом ребенок становится медлительным, движения «беднеют», становясь более скованными.
Походка становится «старческой»: больной шаркает, делая маленькие шажочки. Пропадает синхронность в движении рук и ног при ходьбе.
Далее возникают речевые нарушения. У кого-то речь становится угловатой, у кого-то может резко замедлиться темп произнесения слов.
При любом напряжении мышц возникает дрожание в голове и конечностях. Тремор сохраняется и в состоянии покоя. У большинства заболевших детей держится мышечная ригидность. Из-за постоянного напряжения мышц (гипертонуса), руки и ноги могут сгибаться, принимая статичное вынужденное положение.
Симптоматика в течение дня может становиться более или менее выраженной. Так, после сна симптомы практически нивелируются, а затем к вечеру снова нарастают. Могут заявлять о себе дистонические симптомы – чаще всего в стопах.
Для ювенильного паркинсонизма характерно сохранение интеллектуальных способностей и нормальное функционирование когнитивной сферы. Умственное развитие осуществляется по возрастным нормам.
Современные меры диагностики
Важно вовремя обнаружить заболевание, поэтому при первых же признаках патологии нужно обратиться к врачу. Обычно диагноз ставится уже на первом осмотре у невролога. Грамотный врач сразу же отметит брадикинезию, повышение тонуса мышц и тремор. Затем будет проверен рефлекс сухожилий. При детском паркинсонизме он также значительно повышен. Ребенка обязательно ставят в особую позу, чтобы проверить так называемые пирамидные знаки (рефлексы Бабинского).
Далее проводятся электрофизиологические обследования:
- ЭЭГ;
- электромиография.
По результатам этих процедур подтверждается данный диагноз. Обычно картина выражается снижением биоэлектрической активности полушарий мозга. Особенно ярко такое угнетение наблюдается при акинетико-ригидном ювенильном паркинсонизме.
Обязательно проводится и МРТ. Но на нем, как правило, при такой болезни не видно каких-либо серьезных изменений. Такое обследование назначается для того, чтобы исключить некоторые «встречные» заболевания центральной нервной системы. На томографии могут быть зарегистрированы лишь поздние изменения:
- на хвостовом ядре;
- на бледном шаре;
- черной субстанции.
Эти изменения относятся уже к базальным и заявляют о себе на критических стадиях заболевания.
Чтобы узнать, как проходит синтез дофамина, насколько он затруднен, больной направляется на процедуру функциональной нейровизуализации. Для этого вводится особое вещество, которое в норме должно сосредоточиться в специальной области мозга.
Дополнительно проводятся:
- ПЭТ-КТ мозга;
- ОФЭКТ;
- МР-спектроскопия.
Так как заболевание возникает по генетическим причинам, ребенок направляется на обследование к генетику. Специалист устанавливает конкретный ген, в котором имеется сбой, а также выясняет процент его наследуемости в последующем.
Также врачу необходимо отличить ювенильный паркинсонизм от того, который относится к вторичному типу. Он возникает как следствие наркотической зависимости или сбоя в эндокринной системе.
Елена Анатольевна Ефет: «Мнение о том, что болезнь Паркинсона угрожает только пожилым людям ошибочно»
11 апреля 1755 года родился Джеймс Паркинсон, английский врач, впервые описавший «дрожательный паралич», который теперь называют болезнью Паркинсона. По инициативе Всемирной организации здравоохранения ежегодно проводится День борьбы с болезнью Паркинсона, приуроченный ко дню рождения выдающегося врача. О том, что такое паркинсонизм и страдают ли им дети и подростки, рассказала заведующая психоневрологическим отделением СПбГПМУ, врач-невролог, к.м.н. Елена Анатольевна Ефет.
Елена Анатольевна, расскажите, пожалуйста, что такое болезнь и что такое синдром Паркинсона?
Болезнь Паркинсона — хроническое прогрессирующее заболевание центральной нервной системы, преимущественно связанное с дегенерацией нейронов, вырабатывающих дофамин. В этиологии заболевания важную роль играет взаимодействие неблагоприятных генетических и средовых факторов. Среди средовых факторов наибольшее значение придается подверженности населения потенциальным нейротоксинам (пестициды, гербициды), также есть данные о повышении риска возникновения болезни Паркинсона при контактах с тяжелыми металлами.
Синдром паркинсонизма или симптоматический паркинсонизм развивается в качестве одного из клинических проявлений (осложнений) ряда самостоятельных заболеваний и поражений ЦНС. Наиболее известными вариантами вторичного паркинсонизма являются сосудистый, токсический (в том числе лекарственный), посттравматический, постинфекционный.
Какие структуры и клетки головного мозга поражаются при этой болезни?
При этом заболевании происходит гибель нейронов черной субстанции головного мозга, относящейся к эстрапирамидной системе. Эта система отвечает за коррекцию мышечного тонуса, координацию и точность осуществляемого движения.
Какой механизм развития болезни?
В основе развития болезни Паркинсона лежит прогрессирущая гибель дофаминсодержащих нейронов ряда структур ствола мозга (дофамин — химическое вещество, участвующее в передаче нервных импульсов, контролирующих движения и функцию координации), что сопровождается резким снижением содержания дофамина и хронической дисфункцией дофаминергических путей центральной нервной системы. По мере развития болезни количество вырабатываемого дофамина уменьшается, а больной теряет способность контролировать собственные движения.
Патоморфологически нормальное старение сопровождается уменьшением числа нейронов черной субстанции головного мозга и наличием в них телец Леви (патологических агрегатов белка α-синуклеина), а также снижением содержания дофамина и уменьшением числа дофаминовых рецепторов. Было доказано, что темпы гибели нейронов при болезни Паркинсона в несколько раз выше, чем при нормальном старении.
Ключевым процессом, приводящим к гибели дофаминергических нейронов при болезни Паркинсона, является накопление в них белка α-синуклеина и формирование из него агрегатов и телец Леви. Эти тельца встречаются не только в серединной части мозга, но и в его стволе, а также в обонятельных луковицах. Несмотря на то, что эти участки мозга не относятся к моторным, они тоже важны, поскольку регулируют ощущение запахов и процесса сна. Присутствие телец Леви в этих участках мозга вполне объясняет немоторные симптомы, которые сопровождают некоторых пациентов болезнью Паркинсона. В кишечнике также имеются дофаминовые клетки, вырождающиеся и приводящие к возникновению нарушений в работе желудочно-кишечного тракта, характерных для этого заболевания.
Гибель клеток предположительно происходит вследствие активации генетически запрограммированного механизма (апоптоз). Пациент начинает ощущать первые симптомы заболевания лишь тогда, когда погибло уже около 70% этих клеток.
Синдром Паркинсона это только болезнь пожилых людей? Встречается ли она у детей и у подростков?
Мнение о том, что болезнь Паркинсона угрожает только пожилым людям ошибочно. Существует ранняя и ювенильная формы болезни Паркинсона. Ранняя проявляется после 20 лет, ювенильная — до 20 лет. По данным статистики, у каждого десятого пациента болезнь диагностируется в возрасте до 40 лет. Среди причин возникновения болезни Паркинсона в молодом возрасте преобладают наследственные факторы, затем травмы, интоксикации, вирусные и бактериальные инфекции, нарушение обмена веществ.
Это наследственное заболевание?
Несмотря на достигнутый в последние годы прогресс в понимании биохимических и молекулярных механизмов болезни Паркинсона, истинная этиология спорадических форм этого заболевания остается неизвестной. На долю наследственных форм приходится не более 10–15%. Взаимодействие генетической предрасположенности и факторов внешней среды запускает гибель нейронов ствола головного мозга. Раз возникнув, этот дегенеративный процесс становится необратимым и начинает экспансивно распространяться по мозгу.
Насколько часто дети и подростки болеют ювенильным паркинсонизмом?
Заболевание среди этих групп пациентов встречается очень редко (менее 1% от всех форм паркинсонизма).
Какие симптомы должны насторожить родителей?
Самым ранним признаком ювенильного Паркинсонизма считается брадикинезия — замедление и уменьшение двигательной активности, снижение жестикуляции, малая амплитуда движений. У детей проявляется чаще симметрично. Может быть изменение речи в виде ее замедления. В начальной стадии возникают затруднения с быстрым выполнением двигательных актов, требующих участия мелкой моторики. Ребёнок с трудом застёгивает пуговицы, завязывает шнурки, не может собрать мозаику. Диагностировать нарушение просто: достаточно попробовать быстро постучать пальцами по любой поверхности.
Второй признак — неестественное положение нижних конечностей во время ходьбы. Внешне это выглядит как полусогнутые, вывернутые ноги, часто стопы, отмечается скованность движения.
Третий симптом — тремор-дрожание, возникающее в любой части тела. Тремор у детей может касаться даже голосовых связок, что выражается в изменении тембра голоса, нижних и верхних конечностей. На ранних стадиях дрожание возникает в состоянии покоя, по мере прогрессирования патологии нарастает и проявляется во время движения.
Характерно резкое ухудшение симптоматики к вечеру, улучшение состояния утром либо после дневного сна.
Отличается ли клиническая картина у детей и пожилых людей?
У детей обычно отсутствует четкая стадийность клинических проявлений, нежели у взрослых. Заболевание протекает без деменции (по крайней мере, клинически у детей факт деменции подтвердить сложно). Акинетико-ригидный синдром зачастую связан с ювенильным паркинсонизмом, синдромом Секава. Описано несколько случаев развития синдрома паркинсонизма после перенесённого клещевого энцефалита в виде менингоэнцефалитической его формы — постэнцефалический паркинсонизм. Основная часть детского паркинсонизма достоверно описана как генетическая (повреждены гены, кодирующие рецепторный аппарат дофаминергических рецепторов, или гены, кодирующие синтез самого дофамина). Сама картина акинетико-ригидного синдрома сходна с таковой у пожилых людей.
Как лечат детей с ювенильным паркинсонизмом?
Ювенильный паркинсонизм хорошо реагирует даже на маленькие дозы дофамина. Чтобы отсрочить в дальнейшем прием более серьезных препаратов, ребенку постоянно увеличивают дозу жизненно важного гормона.
Основное место в лечении ювенильного паркинсонизма отводится медикаментозной терапии. Назначаются следующие группы лекарственных средств:
· АДР (агонисты дофаминовых рецепторов);
· препараты диоксифенилаланина;
· холинолитики центральной группы;
· метаболиты.
Классический вариант лечения всегда начинается с приема агонистов дофаминовых рецепторов. При необходимости они могут быть дополнены иными лекарствами. Если сохраняется значительное двигательное расстройство, может потребоваться прием небольших доз диоксифенилаланина.
Центральные холинолитики служат для снижения тремора. Совсем юным пациентам назначаются минимальные дозы этих препаратов. Но терапия должна продолжаться непрерывно не менее 3–5 лет.
К метаболическим препаратам относят витамины группы В, коэнзим Q10, L-карнитин, магний и аминофенилмасляную кислоту. Курс приема таких средств необходимо повторять 3 раза в год. Они призваны поддержать функционирование нервной системы в целом, а также способствовать сохранению здорового мышечного тонуса.
Применяют в лечении ювенильного паркинсонизма и новые перспективные методы. К примеру, электростимуляцию базальных ганглиев.
Также в данный момент изучается возможность введения в организм диоксифенилаланина через специальную дуоденальную помпу.
Паркинсонизм в пожилом возрасте – неизлечимое заболевание, так ли это в случае ювенильного паркинсонизма у детей и подростков?
В сравнении с типичной болезнью Паркинсона ювенильный вариант имеет более доброкачественное течение с медленным прогрессированием. Хороший отклик на терапию, отсутствие выраженных атрофических изменений, когнитивных расстройств позволяют пациентам нормально развиваться, длительно сохранять подвижность. Тяжёлая инвалидизация может наблюдаться спустя несколько десятилетий от клинического дебюта.
Дата публикации: 11.04.2020